Najlepsze pytania
Chronologia
Czat
Perspektywa
Azotan amonu
związek chemiczny Z Wikipedii, wolnej encyklopedii
Remove ads
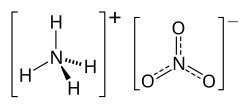
Azotan amonu, pot. saletra amonowa, NH
4NO
3 – nieorganiczny związek chemiczny z grupy saletr, sól kwasu azotowego i amoniaku.
Remove ads
Otrzymywanie
- Metody przemysłowe
- HNO
3 + NH
3 → NH
4NO
3
Ze względu na egzotermiczny charakter reakcji, konieczna jest specjalna konstrukcja reaktorów, pozwalająca na szybkie mieszanie reagentów. Ciepło wytworzone w tej reakcji wykorzystywane jest do odparowania wody, co pozwala na uzyskanie roztworu o stężeniu 95–97%.
Podczas produkcji nawozów azotanowo-fosforanowych powstaje nadmiar azotanu wapnia, na który nie ma wystarczającego zapotrzebowania na rynku. Przerabia się go więc na azotan amonu w reakcji z amoniakiem i dwutlenkiem węgla:
- Ca(NO
3)
2·4H
2O + 2NH
3 + CO
2 → 2NH
4NO
3 + CaCO
3↓ + 3H
2O
Podobnie jak w poprzednim procesie, ciepło wytworzone w tej reakcji wykorzystywane jest do odparowania wody.
- Inne metody
- reakcje nieorganicznych soli amonowych z azotanami, np.[7]:
Remove ads
Właściwości
Saletra amonowa jest bezbarwnym, krystalicznym ciałem stałym. Jest higroskopijna. Bardzo dobrze rozpuszcza się w wodzie (w 25 °C 214 g w 100 g H
2O[3], a w 80 °C 576 g/100 g H
2O[7]). Proces rozpuszczania się NH
4NO
3 w wodzie jest dość silnie endotermiczny (ΔHo = 26 kJ/mol), dzięki czemu mieszanina saletry amonowej z lodem jest bardzo dobrą mieszaniną chłodzącą.
Azotan amonu ma właściwości utleniające.
W umiarkowanych temperaturach ulatnia się w wyniku odwracalnej dysocjacji na amoniak i kwas azotowy[7]:
- NH
4NO
3 ⇄ NH
3↑ + HNO
3↑
Przy ogrzewaniu, w temperaturze około 200–260 °C rozkłada się na podtlenek azotu i wodę[7][8]:
- NH
4NO
3 → N
2O↑ + 2H
2O↑
Rozkład jest reakcją egzotermiczną co może doprowadzić do celowego lub przypadkowego wybuchu, gdyż powyżej 260 °C rozkład może gwałtownie przejść w kierunku[7]:
- 2NH
4NO
3 → 2N
2↑ + 4H
2O↑ + O
2↑
Zanieczyszczenie niektórymi substancjami obniża temperaturę rozkładu i zwiększa energię wybuchu, co może być przyczyną przypadkowego wybuchu i jest wykorzystywane do tworzenia materiałów wybuchowych[8].
Remove ads
Zastosowanie
Podsumowanie
Perspektywa
Materiał wybuchowy
Azotan amonu jest składnikiem wielu materiałów wybuchowych, np.: ANFO, ANNM, amonale, amonity, Dynamon K, sznajderyt. Wybuchowość saletry amonowej była przyczyną wielu katastrof, na przykład:
- eksplozja w Oppau 21 września 1921 – wybuch ok. 4500 ton mieszaniny saletry amonowej i siarczanu amonu w fabryce nawozów azotowych w Oppau (obecnie część Ludwigshafen am Rhein, Niemcy), 561 zabitych[9];
- katastrofa w Texas City 16 kwietnia 1947 – wybuchło ok. 2300 ton NH
4NO
3, ok. 570 ofiar śmiertelnych; - katastrofa kolejowa w Ryongch’ŏn (Korea Północna) 23 kwietnia 2004 – kolizja pociągów przewożących saletrę amonową i paliwo – zerwana sieć trakcyjna spowodowała wybuch, 154 ofiary śmiertelne;
- eksplozja w West 17 kwietnia 2013 w miejscowości West blisko Waco w stanie Teksas – wybuch w fabryce nawozów sztucznych West Fertilizer Company; śmierć poniosło 15 osób, a ponad 160 zostało rannych.
- eksplozja w Mihăilești (Rumunia) 24 maja 2004 – eksplozja ciężarówki przewożącej azotan amonu, 18 ofiar śmiertelnych;
- eksplozja w Bejrucie 4 sierpnia 2020 w stolicy Libanu – wybuch 2750 ton w porcie; śmierć poniosło co najmniej 218 osób, a 7,5 tysięcy zostało rannych.
Azotan amonu został również wykorzystany w zamachu na World Trade Center 26 lutego 1993 – pod północną wieżą World Trade Center eksplodowała zaparkowana w podziemnym garażu ciężarówka wypełniona ok. 700 kg tego związku. W wyniku zamachu zginęło 6 osób, a ponad tysiąc zostało rannych.
Nawóz mineralny

Saletra amonowa jest używana jako nawóz oraz jako składnik mieszanek nawozów mineralnych. W czystej postaci jest jednym z najpopularniejszych jednoskładnikowych nawozów mineralnych; charakteryzuje się największą zawartością azotu w grupie nawozów saletrzano-amonowych (34%). Zawiera dwie formy azotu: azotanową i amonową. Przez dobrą rozpuszczalność w wodzie i higroskopijność bardzo szybko przenika do gleby. Nawóz uniwersalny, stosowany do wszystkich roślin i rodzajów gleb, przedsiewnie i pogłównie[10]. Do azotanu amonu dodaje się środki zapobiegające zbrylaniu się i zmniejszające higroskopijność – węglan wapnia lub węglan magnezu – a także związki zawierające mikroelementy. Azotan amonu jest także składnikiem nawozów wieloskładnikowych. Nawozy oparte na saletrze amonowej produkowane w Polsce przez Zakłady Azotowe „Kędzierzyn” (np.: ZAKsan, Salmag – również z siarką i borem), Zakłady Azotowe „Puławy” (Pulan[11] i nawóz płynny RSM – roztwór azotanu amonu i mocznika) oraz Azoty Tarnów (Saletrosan[12]).
Remove ads
Produkcja
Remove ads
Transport i magazynowanie
Roztwory azotanu amonu produkowane w polskich przedsiębiorstwach chemicznych transportuje się w postaci ciekłej jako gorący stężony roztwór. Do tego celu wykorzystywane są cysterny ze zbiornikami produkowanymi na bazie stali kwasoodpornej, zaopatrzonymi dodatkowo w elementy grzewcze podtrzymujące temperaturę roztworu.
Podobnie jak w przypadku transportu, również magazynowanie wymaga stosowania właściwych środków bezpieczeństwa. Azotan amonu można przechowywać w temperaturze wyższej od temperatury krystalizacji i jednocześnie niższej od temperatury wrzenia[20].
Remove ads
Przypisy
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads