Najlepsze pytania
Chronologia
Czat
Perspektywa
Glukoza
grupa izomerów Z Wikipedii, wolnej encyklopedii
Remove ads
Glukoza, D-glukoza[a] – organiczny związek chemiczny, monosacharyd (cukier prosty) z grupy aldoheksoz. Jest białym, drobnokrystalicznym ciałem stałym[2], z roztworów wodnych łatwo krystalizuje jako monohydrat[8]. Jest bardzo dobrze rozpuszczalna w wodzie[2] (nie zmienia pH roztworu). Ma słodki smak, nieco mniej intensywny od sacharozy[9].
Enancjomerem D-glukozy jest L-glukoza, niewystępująca w organizmach wyższych.
Remove ads
Występowanie
Glukoza powstaje w organizmach roślinnych podczas fotosyntezy[10]:
Występuje w znacznych ilościach w owocach (szczególnie w winogronach, stąd nazywana jest czasem cukrem gronowym) i miodzie. W organizmach jest składowana w postaci dwóch polimerów: skrobi u roślin i glikogenu u zwierząt[11].
Budowa cząsteczki
Podsumowanie
Perspektywa
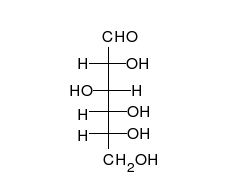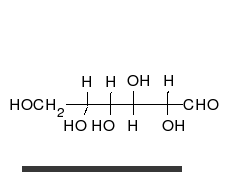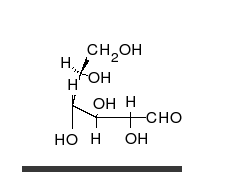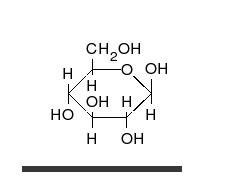
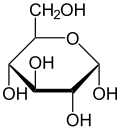
Krystaliczna glukoza ma budowę cykliczną. Sześcioczłonowy pierścień hemiacetalu powstaje w wyniku reakcji grupy aldehydowej przy atomie węgla C1 z grupą hydroksylową przy atomie węgla C5 w łańcuchu. Możliwe są zatem dwa anomery – α oraz β w zależności od położenia grupy OH przy pierwszym atomie węgla formy cyklicznej.
W roztworze wodnym oba anomery mogą ulegać reakcji otwarcia pierścienia i ponownego zamknięcia z utworzeniem ponownie takiego samego lub przeciwnego anomeru. Proces taki nazywa się mutarotacją. Forma otwartołańcuchowa występuje wyłącznie w roztworze wodnym, a jej termodynamiczna stabilność jest znacznie mniejsza od formy cyklicznej, dlatego równowaga procesu mutarotacji przesunięta jest silnie w kierunku formy cyklicznej, która występuje w przewadze.
W łańcuchowej formie glukozy znajdują się cztery asymetryczne atomy węgla (tj. C2, C3, C4 i C5), podczas gdy w formie cyklicznej występuje pięć takich atomów (dodatkowo asymetryczny jest węgiel anomeryczny, C1). W zależności od położenia grupy karbonylowej w łańcuchu i konfiguracji asymetrycznych atomów węgla, możliwych jest kilkadziesiąt izomerów glukozy (zob. heksozy). Jednym z często występujących naturalnie izomerów glukozy jest fruktoza, różniąca się położeniem grupy karbonylowej.
Remove ads
Właściwości
Podsumowanie
Perspektywa
Właściwości chemiczne
Naturalna glukoza jest jednym z wielu izomerów optycznych tego związku – α-D-glukopiranozą (dekstrozą). Jest ona czynna optycznie – w temperaturze pokojowej skręca płaszczyznę spolaryzowanego światła białego w prawo. Skręcalność właściwa anomeru α wynosi +112°, natomiast anomeru β +19°. W roztworze wodnym w wyniku mutarotacji ustala się stan równowagi obu anomerów w stosunku 36:64, o skręcalności właściwej +52,6°[12].
Glukoza w przeciwieństwie do fruktozy odbarwia wodę bromową w obecności wodorowęglanu sodu[13] (następuje utlenienie grupy aldehydowej do grupy karboksylowej, w wyniku czego powstaje kwas glukonowy)[2]:
- CH
2OH−(CHOH)
4−CHO + Br
2 + 2NaHCO
3 → CH
2OH−(CHOH)
4−COOH + 2NaBr + H
2O + 2CO
2↑
Pod wpływem kwasu azotowego grupa aldehydowa oraz atom węgla C6 są utleniane do grup karboksylowych, w wyniku czego powstaje kwas glukarowy (który w gorącej wodzie przechodzi w lakton)[2].
W temperaturze powyżej 150 °C topi się i brunatnieje, tworząc (podobnie jak sacharoza) karmel[2].
Właściwości biologiczne
D-Glukoza jest podstawowym związkiem energetycznym dla większości organizmów, przechowywanym pod postacią polimerów – skrobi i glikogenu. Stanowi cukier najłatwiej przyswajalny przez człowieka[2]. W procesie glikolizy jest rozkładana na kwas pirogronowy. Jest także substratem wielu procesów zachodzących w komórce, a u roślin, jako celuloza, podstawowym budulcem ściany komórkowej.
Wykrywanie glukozy w roztworach
Podsumowanie
Perspektywa
Glukozę, podobnie jak inne cukry redukujące, można wykryć m.in. za pomocą prób Trommera i Tollensa[2]. W obydwu próbach glukoza jest przeprowadzana w kwas glukonowy.
Próba Trommera
Do świeżo strąconego osadu wodorotlenku miedzi(II) dodaje się badany roztwór i ogrzewa. W obecności glukozy niebieski osad Cu(OH)2 zmienia barwę na ceglastoczerwoną, wskutek redukcji do Cu
2O:
- 2Cu(OH)
2 + C
6H
12O
6 → Cu
2O + C
6H
12O
7 + 2H
2O
Próba Tollensa
Do probówki napełnionej niewielką ilością roztworu azotanu srebra należy dodać kilka kropli stężonego roztworu wodorotlenku sodu (NaOH), a następnie dolewać kroplami roztworu amoniaku (NH
3), aż do rozpuszczenia się powstałego wcześniej osadu.
- 1. AgNO
3 + NaOH → AgOH + NaNO
3 - 2a. 2AgOH → Ag
2O + H
2O - 2b. Ag
2O + CH
2(OH)(CHOH)
4CHO → 2 Ag + CH
2(OH)(CHOH)
4COOH
Tak przygotowaną probówkę należy umieścić w zlewce z gorącą wodą (na łaźni wodnej). Na koniec do probówki dodaje się badany roztwór. Podczas ogrzewania substancji o barwie brunatnej – Ag
2O (powstałej z reakcji AgNO
3 z NaOH) – na ściankach probówki osadza się warstewka metalicznego srebra – lustro srebrowe (z tej przyczyny próba Tollensa zwana jest także próbą lustra srebrnego).
- 3. Ag
2O + glukoza → 2 Ag + kwas organiczny (kwas glukonowy) - Ag
2O + C
6H
12O
6 → 2 Ag + C
6H
12O
7
Remove ads
Zastosowanie
W medycynie (np. kroplówki), a także w przemyśle spożywczym (np. syrop glukozowy[14], syrop glukozowo-fruktozowy) oraz farmaceutycznym[2]. Stosowana jest również jako dodatek o właściwościach nawilżających do kosmetyków[15][16], np. przeznaczonych do makijażu, pielęgnacji skóry i włosów[15].
Uwagi
Przypisy
Bibliografia
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads