Top Qs
Linha do tempo
Chat
Contexto
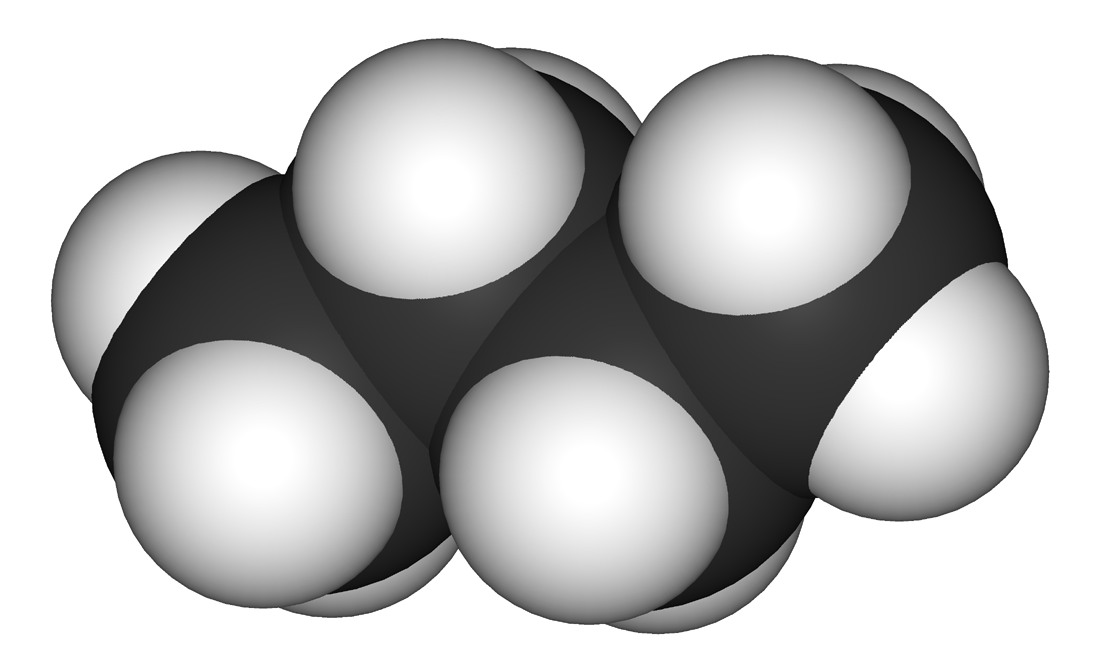
Butano
composto químico Da Wikipédia, a enciclopédia livre
Remove ads
O butano é um hidrocarboneto saturado da família dos alcanos e de fórmula C4H10.[2] É obtido mediante o aquecimento lento do petróleo. É um gás incolor, inodoro e altamente inflamável. Existe sob duas formas isômeras: o n-butano e o isobutano ou 2-metilpropano.[3]
Remove ads
Utilização
O butano está presente no gás liquefeito de petróleo (o gás de cozinha, fornecido via tubulação ou em botijões), que é uma mistura de gases, cujo principal componente é o propano.[4]
Uma vez que o butano é inodoro, por convenção - e para que possamos distingui-lo de outro gás - adiciona-se a ele uma substância de cheiro específico (etanotiol). O vazamento de gás butano pode produzir asfixia, por expulsar o oxigênio do ambiente, pois, ao contrário da maioria dos gases, a densidade do butano corresponde a aproximadamente o dobro da densidade do ar atmosférico.[5]
Remove ads
Química
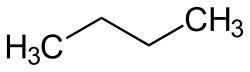
O termo "butano" pode referir-se tanto aos dois isômeros estruturais, n-butano e isobutano, CH(CH3)3, como à mistura desses isômeros. Todavia, na nomenclatura IUPAC, "butano" designa apenas o isômero n-butano.[6]
- Estruturas dos dois isômeros do butano
 |
 |
| n-Butano | i-Butano |
Sua molécula é apolar (por ser um hidrocarboneto), portanto, não é solúvel em água com óleo. Outras misturas de hidrocarbonetos obtidas a partir do petróleo, como a gasolina, o querosene ou o diesel, são igualmente homogêneas e insolúveis em água. As ligações intermoleculares do butano - como todos outros hidrocarbonetos apolares - são feitas pelas forças de van der Waals por dipolos temporários, que são as mais fracas das ligações intermoleculares. Por isso, as temperaturas de fusão e ebulição são menores que de outros componentes.[7]
Remove ads
Obtenção
O n-butano é obtido por destilação sob pressão do GLP, bem como pela purificação do gás natural.[8]
Efeitos e problemas para a saúde
A inalação do butano pode causar euforia, sonolência, narcose, asfixia, arritmia cardíaca, flutuações na pressão sanguínea e perda de memória temporária. Quando inalado diretamente de um recipiente altamente pressurizado pode resultar em morte por asfixia e fibrilação ventricular, com a rápida intoxicação sanguínea.[9]
Referências
- Registo de Butan na Base de Dados de Substâncias GESTIS do IFA, accessado em 22 de Dezembro de 2008.
- «Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names (Blue Book)». Royal Society of Chemistry. Front Matter: 4. 2014. ISBN 978-0-85404-182-4. doi:10.1039/9781849733069-FP001
- Field-Smith M., Bland J. M., Taylor J. C. «Trends in death Associated with Abuse of Volatile Substances» (PDF). Londres: Department of Public Health Sciences. Cópia arquivada (PDF) em 27 de março de 2007
- Balabin, Romam M. (2009). «Enthalpy Difference between Conformations of Normal Alkanes: Raman Spectroscopy Study of n-Pentane and n-Butane». J. Phys. Chem. A. 113: 9–1012. Bibcode:2009JPCA..113.1012B. PMID 19152252. doi:10.1021/jp809639s
- Russel, Colin A. (20 de março de 2009). «Frankland – the First Organometallic Chemist» (PDF). Royal Society of Chemistry. Consultado em 6 de dezembro de 2021
- W. B., Kay (1940). «Pressure-Volume-Temperature Relations for n-Butane». Industrial & Engineering Chemistry. Pressure-Volume-Temperature Relations for n-Butane. 32: 358–360. doi:10.1021/ie50363a016
- Ramsey J., Anderson H. R., Bloor K. (1989). «An introduction to the practice, prevalence and chemical toxicology of volatile substance abuse». Hum Toxicol. 8: 261–269. PMID 2777265. doi:10.1177/096032718900800403
Remove ads
Ligações externas
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads