Top Qs
Linha do tempo
Chat
Contexto
Esquistossomose
esquistosomose mansoni Da Wikipédia, a enciclopédia livre
Remove ads
A esquistossomose, também conhecida como barriga d'água, xistose,[2] febre do caramujo ou bilharzíaze,[3][4] é uma doença causada pelos platelmintos do gênero Schistosoma. O trato urinário e/ou intestinos podem ser infectados.
A doença é transmitida por contato com água doce contaminada com parasitas, que são liberados a partir de caracóis infectados de água doce. A doença é especialmente comum entre as crianças em países em desenvolvimento como elas são mais propensas a brincar na água contaminada. Outros grupos de alto risco incluem: agricultores, pescadores ou pessoas que utilizam a água suja para uso diário.[1] Ela pertence ao grupo de infecções helmínticas[5] e o diagnóstico é através da identificação de ovos do parasita, na urina ou fezes da pessoa. Também pode ser confirmada pela identificação de anticorpos contra a doença no sangue.[1]
Métodos de prevenção da doença incluem a melhoria do acesso a água potável e a redução do número de caracóis. Em áreas onde a doença é comum, o medicamento praziquantel pode ser dado uma vez por ano, para todo o grupo. Isto é feito para diminuir o número de pessoas infectadas e, consequentemente, a propagação da doença. O praziquantel também é o tratamento recomendado pela Organização Mundial de Saúde (OMS) para aqueles que estão infectados.[1]
A esquistossomose afetou cerca de 252 milhões de pessoas em todo o mundo em 2015. Estima-se que 4.400 a 200.000 pessoas morrem a cada ano.[6] A doença é mais comum na África, bem como a Ásia e a América do Sul.[1] Em torno de 700 milhões de pessoas, em mais de 70 países, vivem em áreas onde a doença é comum.[7] Em países tropicais, a esquistossomose é segunda apenas para a malária entre doenças parasitárias com o maior impacto económico.[8] Está listada como uma doença tropical negligenciada.[9]
Remove ads
Sinais e sintomas
Resumir
Perspectiva


Muitos indivíduos não apresentam sintomas. Se os sintomas aparecerem, eles geralmente levam de 4 a 6 semanas a partir do momento da infecção. O primeiro sintoma da doença pode ser uma sensação de mal-estar geral]. Dentro de 12 horas após a infecção, a pessoa pode reclamar de uma sensação de formigamento ou leve erupção cutânea, comumente referido como "coceira do nadador", devido à irritação no ponto de entrada. A erupção que pode se desenvolver pode simular sarna e outros tipos de erupções cutâneas. Outros sintomas podem ocorrer 2 a 10 semanas depois e podem incluir febre, dor, tosse, diarreia, calafrios ou aumento da glândula. Esses sintomas também podem estar relacionados à esquistossomose aviária, que não causa mais sintomas em humanos.[10]
As manifestações da infecção esquistossomótica variam ao longo do tempo à medida que as cercárias e, posteriormente, os vermes adultos e seus ovos migram pelo corpo.[11] Se os ovos migrarem para o cérebro ou medula espinhal, podem ocorrer convulsões, paralisia ou inflamação da medula espinhal.[12]
Aqueles que foram infectados por um longo tempo podem apresentar dano hepático, insuficiência renal, infertilidade ou câncer de bexiga.[1] Em crianças, pode causar baixo crescimento e dificuldade de aprendizagem.[1]
Esquistossomose aguda
Dermatite cercária
A primeira reação potencial é uma erupção pruriginosa, maculopapular que resulta da penetração de cercárias na pele nas primeiras 12 horas a dias após a penetração da cercária na pele.[13][14] A primeira vez que uma pessoa não sensibilizada é exposta, as erupções são geralmente leves com uma sensação de formigamento associada que desaparece rapidamente por conta própria, pois esse é um tipo de reação de hipersensibilidade. Em pessoas sensibilizadas que foram previamente infectadas, a erupção cutânea pode se desenvolver em lesões elevadas, pruriginosas e vermelhas (pápula), algumas se transformando em lesões cheias de líquido (vesículas).[14] Infecções prévias com cercárias causam um desenvolvimento mais rápido e pior apresentação da dermatite devido à resposta imune mais forte.[15] The round bumps are usually one to three centimeters across.[16] Como as pessoas que vivem nas áreas afetadas foram frequentemente expostas repetidamente, as reações agudas são mais comuns em turistas e migrantes.[17] A erupção pode ocorrer entre as primeiras horas e uma semana após a exposição, e normalmente desaparece por conta própria em cerca de 7 a 10 dias.[14][16] Para a esquistossomose humana, um tipo semelhante de dermatite chamado "coceira do nadador" também pode ser causado por cercárias de animais trematódeos que freqüentemente infectam pássaros.[11][14][18] A dermatite cercariana não é contagiosa e não pode ser transmitida de pessoa para pessoa.[19]
Os sintomas podem incluir:[14][19]
- Erupção plana e vermelha
- Pequenas espinhas vermelhas e salientes
- Pequenas bolhas vermelhas
- Sensação de formigamento ou formigamento, queimação, coceira na pele
Coçar a erupção cutânea pode levar a uma infecção bacteriana secundária da pele, por isso é importante evitar coçar. Alguns tratamentos comuns para a coceira incluem creme corticosteroide, loção anti-coceira e aplicação de compressas frias a erupções cutâneas, tomar banho com sais de Epsom ou bicarbonato de sódio e, em casos de coceira intensa, cremes e loções fortes prescritos, anti-histamínicos orais também podem ajudar a aliviar a coceira.[14][19]
Esquistossomose aguda (febre de Katayama)
A esquistossomose aguda (febre de Katayama) pode ocorrer semanas ou meses (cerca de 2 a 8 semanas)[20] após a infecção inicial como uma reação sistêmica contra a migração dos esquistossômulos conforme eles passam pela corrente sanguínea através dos pulmões para o fígado e também contra os antígenos dos ovos.[11] Da mesma forma que a coceira do nadador, a febre de Katayama é mais comumente visto em pessoas com sua primeira infecção, como migrantes e turistas, e está associado a infecções pesadas.[21] É visto, no entanto, em residentes nativos da China infectados com S. japonicum.[22] S. japonicum pode causar esquistossomose aguda em população cronicamente infectada e pode levar a uma forma mais grave de esquistossomose aguda.[14]
Os sintomas podem incluir:[20][21]
- Tosse seca com alterações na radiografia de tórax
- Febre
- Fadiga
- Dores musculares
- Dor de cabeça
- Mal-estar
- Dor abdominal
- Diarreia
- Aumento do fígado e do baço
- Colmeias
A esquistossomose aguda geralmente se resolve em 2 a 8 semanas na maioria dos casos,[20] mas uma pequena proporção de pessoas apresenta perda de peso persistente, diarreia, dor abdominal difusa e erupção cutânea.[11]
As complicações podem incluir:
- Inflamação da medula espinhal (mielite transversa) pode ocorrer se vermes ou ovos viajarem para a medula espinhal durante esta fase aguda da infecção.[14]
Infecção crônica
Na doença de longa data, os vermes adultos põem ovos que podem causar reações inflamatória. Os ovos secretam proteolítico e enzimas que os ajudam a migrar para a bexiga e os intestinos para serem eliminados. As enzimas também causam uma reação inflamatória eosinofílica quando os ovos ficam presos nos tecidos ou embolizam para o fígado, baço, pulmões ou cérebro.[11] As manifestações de longo prazo são dependentes da espécie de esquistossomo, pois os vermes adultos de diferentes espécies migram para diferentes áreas.[23] Muitas infecções são levemente sintomáticas, sendo anemia e desnutrição comuns em áreas endêmicas.[24]
Esquistossomose intestinal
Os vermes de S. mansoni e S. japonicum migram para as veias do trato gastrointestinal e fígado.[18] Ovos na parede do intestino podem causar dor, sangue nas fezes e diarréia (especialmente em crianças).[18] A doença grave pode levar ao estreitamento do cólon ou reto.[16]
Na esquistossomose intestinal, os ovos ficam alojados na parede intestinal durante sua migração das vênulas mesentéricas para o lúmen intestinal, e os ovos aprisionados causam uma reação do sistema imunológico chamada reação granulomatosa.[25] Eles afetam principalmente o intestino grosso e o reto, e o envolvimento do intestino delgado é mais raro.[14] Essa resposta imune pode levar à obstrução do cólon e à perda de sangue. O indivíduo infectado pode ter o que parece ser uma barriga. Existe uma forte correlação entre a morbidade da esquistossomose intestinal e a intensidade da infecção.[14] Em casos de infecções leves, os sintomas podem ser leves e passar despercebidos.[21] As espécies mais comuns de causar esquistossomose intestinal são S. mansoni e S. japonicum, porém, S. mekongi e S. intercalatum também pode causar esta doença.[21]
Os sintomas podem incluir:[14]
- Dor e desconforto abdominal
- Perda de apetite
- Diarréia mucosa com ou sem sangue bruto
- Sangue nas fezes que não está visivelmente presente (sangue oculto nas fezes)
- Distensão abdominal
As complicações podem incluir:
- Pólipos intestinais
- Úlceras intestinais
- Anemia por deficiência de ferro[26]
- Fístula[14]
- Estenose intestinal (estreitamento do cólon ou reto)
- Enteropatia perdedora de proteínas
- Obstrução intestinal parcial ou completa
- Apendicite (raro)
Aproximadamente 10-50% das pessoas que vivem em regiões endêmicas de S. mansoni e S. japonicum desenvolve esquistossomose intestinal.[14] S. mansoni sobrepõe-se epidemiologicamente com alta prevalência de HIV na África Subsaariana, onde a esquistossomose gastrointestinal tem sido associada ao aumento da transmissão do HIV.[27]
Esquistossomose hepatoesplênica

Os ovos também migram para o fígado, causando fibrose em 4 a 8% das pessoas com infecção crônica, principalmente aquelas com infecção grave de longa duração.[18]
Os ovos podem ficar alojados no fígado,[25] levando a hipertensão portal, esplenomegalia, acúmulo de líquido no abdômen e risco de vida potencial dilatações ou áreas inchadas no esôfago ou trato gastrointestinal que podem rasgar e sangrar profusamente (varizes esofágicas). Esta condição pode ser dividida em duas fases distintas: esquistossomose hepática inflamatória (reação inflamatória precoce) e esquistossomose hepática crônica. As espécies mais comuns que causam esta condição são S. mansoni, S. japonicum, e S. mekongi.
- Esquistossomose hepática inflamatória
- Esta condição ocorre principalmente em crianças e adolescentes devido à reação imune precoce aos ovos presos nos espaços periportal e pré-sinusoidal do fígado, criando numerosos granulomas.[14] A função hepática não é afetada e a gravidade da doença o aumento do fígado e do baço está correlacionado com a intensidade da infecção.[14] Caracteriza-se por um lobo esquerdo do fígado aumentado com uma borda afiada e baço aumentado com nódulos.[28] O aumento do fígado e baço geralmente é leve, mas em casos graves, eles podem aumentar até o nível do umbigo e até mesmo na pelve.[14]
- Esquistossomose hepática crônica (fibrótica)
- Esta é uma doença hepática em estágio avançado que ocorre principalmente em adultos jovens e de meia-idade que foram infectados cronicamente por uma infecção grave e cuja regulação imunológica da fibrose não está funcionando adequadamente.[14] Afeta apenas uma pequena proporção de pessoas infectadas.[14] A função e a arquitetura do fígado não são afetadas, ao contrário da cirrose.[14] A patogênese dessa doença é causada pela deposição de colágeno e proteínas da matriz extracelular dentro do espaço periportal, o que leva à fibrose portal do fígado e tratos portais fibróticos aumentados (fibrose da haste do tubo de Symmer).[26] A fibrose periportal comprime fisicamente a veia porta levando a hipertensão portal (aumento da pressão venosa portal), aumento da pressão da veia esplênica e subsequente aumento do baço.[14] A hipertensão portal também pode aumentar a pressão nas anastomoses portossistêmicas (conexões de vasos entre a circulação portal e a circulação sistêmica) levando a varizes esofágicas e caput medusae. , ou cérebro.[14] A co-infecção com hepatite é comum em regiões endêmicas de esquistossomose com hepatite B ou hepatite C, e a co-infecção com hepatite C está associada a deterioração hepática mais rápida e pior prognóstico .[26] Esquistossomose hepática fibrótica causada por S. mansoni geralmente se desenvolve em cerca de 5 a 15 anos, enquanto pode levar menos tempo para S. japonicum.[14]
- Os sintomas podem incluir:
- Varizes esofágicas (pode causar sangramento varicoso esofágico com risco de vida)[26]
- Ascite (estágio final)[26]
- Caput medusae[14]
- Baço e fígado aumentados[14]
- As complicações podem incluir:
Esquistossomose pulmonar
A hipertensão portal secundária à esquistossomose hepatoesplênica pode causar conexões de vasos entre a circulação portal (fígado e intestino) e a circulação sistêmica, o que cria um caminho para os ovos e vermes viajarem para os pulmões.[14] Os ovos podem se depositar ao redor dos leitos capilares alveolares e causar inflamação granulomatosa das arteríolas pulmonares, seguida de fibrose.[14] Isso leva à hipertensão arterial no sistema circulatório pulmonar (hipertensão pulmonar ), aumento da pressão no coração direito, dilatação da artéria pulmonar e do átrio direito e espessamento da parede ventricular direita.[14]
Os sintomas de hipertensão pulmonar podem incluir:
- Falta de ar
- Dor no peito
- Sentindo-se cansado
- Desmaio durante o esforço físico
Esquistossomose urogenital

Os vermes de S. haematobium migram para as veias ao redor da bexiga e ureter onde se reproduzem.[23][29] O S. haematobium pode produzir até 3.000 ovos por dia, esses ovos migram das veias para a bexiga e os lúmens do ureter, mas até 50% deles podem ficar presos nos tecidos circundantes, causando inflamação granulomatosa, formação de pólipos e ulceração da bexiga, do ureter e tecidos do trato genital.[14][29] Isso pode levar a sangue na urina 10 a 12 semanas após a infecção.[11][16] Com o tempo, fibrose pode levar à obstrução do trato urinário, hidronefrose e insuficiência renal.[11][16] Câncer de bexiga o diagnóstico e a mortalidade geralmente são elevados nas áreas afetadas; os esforços para controlar a esquistossomose no Egito levaram a uma diminuição na taxa de câncer de bexiga.[16][30] O risco de câncer de bexiga parece ser especialmente alto em fumantes do sexo masculino, talvez devido à irritação crônica do revestimento da bexiga, permitindo que ela seja exposta a cancerígenos do fumo.[18][23]
Nas mulheres, a doença geniturinária também pode incluir lesões genitais que podem levar ao aumento das taxas de transmissão do HIV.[16][27][31] Se as lesões envolverem as trompas de falópio ou os ovários, podem levar à infertilidade, se os órgãos reprodutivos masculinos forem afetados, pode haver sangue no esperma.[14]
Os sintomas urinários podem incluir:[14]
- Sangue na urina - o sangue geralmente é visto no final do jato urinário (sintoma mais comum)[21]
- Dor ao urinar
- Aumentar a frequência de micção
- Proteína na urina
- Infecção urinária secundária
- Infecção renal secundária
Os sintomas genitais podem incluir:
- Inflamação e ulceração do colo uterino, vagina ou vulva[21]
- Sangue no esperma
- Infertilidade feminina
A função renal não é afetada em muitos casos, e as lesões são reversíveis com o tratamento adequado para eliminar os vermes.[14]
Neuroesquistossomose
A complicação ectópica da esquistossomose, conhecida como neuroesquistossomose, tem sido cada vez mais relatada na literatura médica devido à sua incidência que varia de 0,4% a 3% entre pacientes com esquistossomose. No Brasil, onde há cerca de 16 milhões de esquistossomóticos, a ocorrência desse distúrbio neurológico é particularmente relevante. A apresentação clínica da neuroesquistossomose mansônica é variável e depende do estágio de evolução da esquistossomose.[32]
Remove ads
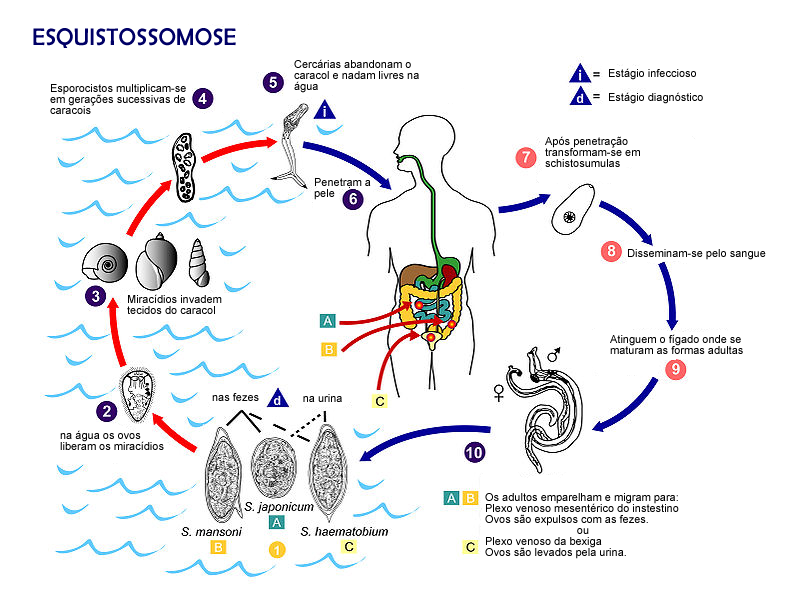
O ciclo da esquistossomose
Resumir
Perspectiva
A infecção humana pelo Schistosoma começa quando larvas aquáticas de vida livre, denominadas cercárias, entram em contato com a pele do hospedeiro. Estas cercárias são liberadas em grande número por caramujos de água doce, os hospedeiros intermediários do parasita, que foram previamente infectados por miracídios eclodidos de ovos eliminados por hospedeiros definitivos infectados. O contato com águas contaminadas por cercárias – seja em rios, lagos, canais de irrigação ou córregos – é o modo de transmissão da doença. A penetração da cercária na pele é um processo ativo e rápido, podendo ocorrer em questão de minutos após o contato. As cercárias são atraídas por secreções da pele e, ao encontrarem o hospedeiro, aderem à superfície cutânea e iniciam a invasão. Durante este processo, as cercárias perdem sua cauda bifurcada, uma estrutura utilizada para natação na água, e penetram através das camadas da epiderme.[33]
Uma vez no interior da pele, a larva, agora denominada esquistossômula, sofre uma série de transformações morfológicas e bioquímicas cruciais para sua sobrevivência e adaptação ao ambiente interno do hospedeiro. Uma das mudanças mais significativas é a perda do glicocálice externo, que é antigênico, e a formação de um novo revestimento superficial complexo, o tegumento heptalaminar. Este novo tegumento confere à esquistossômula resistência a mecanismos de defesa do hospedeiro, como o sistema complemento, e é fundamental para a evasão imune durante as fases subsequentes da infecção. Após a transformação na pele, as esquistossômulas iniciam uma complexa jornada migratória através dos tecidos do hospedeiro para alcançar seu destino final, o sistema vascular portal-hepático, onde ocorrerá a maturação sexual. Da derme, as esquistossômulas penetram em pequenos vasos sanguíneos (vênulas) ou linfáticos. O tempo necessário para alcançar a circulação varia entre as espécies.[33]
Uma vez na circulação sanguínea ou linfática periférica, as esquistossômulas são transportadas passivamente pelo fluxo sanguíneo. Elas atingem o lado direito do coração e são subsequentemente bombeadas, através da artéria pulmonar, para a microvasculatura dos pulmões. Os capilares pulmonares representam uma barreira física significativa devido ao seu pequeno diâmetro. Para atravessá-los, as jovens esquistossômulas devem se alongar e se deformar consideravelmente. A chegada e a permanência nos pulmões também variam temporalmente entre as espécies e podem ser influenciadas pelo tipo de hospedeiro definitivo. Após atravessarem os capilares pulmonares, as esquistossômulas entram nas veias pulmonares, retornam ao lado esquerdo do coração e são distribuídas pela circulação arterial sistêmica para diversos órgãos. A chegada ao sistema porta-hepático, o principal local de maturação, pode ocorrer por diferentes rotas[34]. As larvas que entram na artéria celíaca ou nas artérias mesentéricas superior ou inferior podem alcançar o fígado diretamente através da artéria hepática ou, mais comumente, atravessando a vasculatura capilar de órgãos como estômago, intestino delgado, baço ou pâncreas, e então entrando na veia porta hepática. Uma vez no fígado, as esquistossômulas são predominantemente encontradas nos ramos intra-hepáticos da veia porta e parecem ficar retidas nesse sistema, incapazes de atravessar os sinusoides hepáticos para retornar à circulação sistêmica. Esta fase pulmonar e de migração sistêmica é crítica, pois o parasita está exposto a respostas imunes do hospedeiro, e a passagem pelos pulmões é um evento obrigatório para o desenvolvimento subsequente.[33]
Ao alcançarem o ambiente vascular intra-hepático, principalmente os ramos da veia porta, as esquistossômulas encontram um nicho rico em nutrientes, onde iniciam um período de intenso crescimento e desenvolvimento. Alimentando-se de componentes sanguíneos do hospedeiro, como eritrócitos, e utilizando glicose e ácidos graxos para seu metabolismo energético e para a produção de ovos , as larvas amadurecem sexualmente, transformando-se em vermes adultos machos e fêmeas. Este processo de maturação, desde a penetração na pele até a capacidade de produzir ovos, leva aproximadamente de 5 a 7 semanas. Em S. mansoni, por exemplo, as esquistossômulas podem dobrar de peso a cada 2,3 dias durante as duas primeiras semanas no fígado. Após o acasalamento, os casais de vermes iniciam uma segunda migração, desta vez do fígado para seus sítios preferenciais de oviposição no sistema vascular.[33] Notavelmente, esta migração ocorre, em grande parte, contra o fluxo sanguíneo predominante no sistema portal, que é direcionado para o fígado.Após atingirem a maturidade sexual e se estabelecerem nos sítios vasculares preferenciais, as fêmeas de Schistosoma iniciam a oviposição. São precisamente estes ovos retidos nos tecidos do hospedeiro que constituem o principal estímulo para a resposta inflamatória crônica e a subsequente patologia associada à esquistossomose.[35] Cada ovo aprisionado induz a formação de um granuloma, uma reação inflamatória celular organizada que, embora possa ter um papel protetor inicial, a longo prazo leva à fibrose tecidual, disfunção orgânica e às manifestações clínicas crônicas da doença.[36]
Remove ads
Imunopatologia
Resumir
Perspectiva
A esquistossomose, como outras doenças parasitárias, é marcada por uma complexa interação imunológica entre parasita-hospedeiro que pertime a cronificação da infecção ao inibir respostas imunes efetivas contra o parasito. A penetração das cercárias e a subsequente transformação em esquistossômulas na derme eliciam uma resposta inflamatória localizada e imediata. Esta resposta é caracterizada pela infiltração de células do sistema imune inato, como neutrófilos (células polimorfonucleares) e macrófagos (células mononucleares), no local da invasão. Em indivíduos previamente expostos à cercária, a reinfecção é acompanhada por forte expressão de citocinas na região penetrada, desencadeando uma reação de hipersensibilidade com prurido e dermatite, popularmente referidas como "coceira do nadador".[37] Na epiderme, a cercária passa a expressar uma série de proteases, penetrando, pela derme, nos capilares superficiais, ao passo que se transforma em esquistossômulo - um processo que dura até 3 dias após a penetração inicial.[36]
Concomitantemente, o parasita secreta a proteína Sm16, que impede a ativação clássica de macrófagos, retarda o processamento e a apresentação de antígenos pelas células fagocíticas, e interfere na via de sinalização NF-Kb.[36] A Sm16 é uma dos diversos produtos secretados pelo esquistossoma para evadir o sistema imune e aumentar suas chances de sobrevivência. As proteínas regulatórias secretadas promovem a polariazação Th1/Th17, menos eficazes contra o estado larval, ao passo que a troca frequente do glicocálice larval impede ataques do sistema complemento ou reconhecimento antigênico por anticorpos ou eosinófilos. Os produtos secretados pelo esquistossômulo estimulam os queratinócitos a produzir prostaglandina E2 (PGE2). A PGE2, por sua vez, induz a produção de IL-10 e atua como um vasodilatador, o que pode facilitar a entrada das esquistossômulas na circulação sanguínea. Além disso, a prostaglandina D2 (PGD2), que também pode ser produzida pelo parasita, inibe a migração das células de Langerhans (LCs), as principais células apresentadoras de antígenos da epiderme, para os linfonodos regionais. Esta inibição da migração das LCs prejudica a iniciação de uma resposta imune adaptativa eficaz.[38] Notavelmente, o parasita é capaz de apresentar antígenos do próprio hospedeiro em seu tegumento, como proteínas do MHC, atígenos sanguíneos e IgG. A apresentação destes antígenos do hospedeiro iibe a ação celular inata, sobretudo de células Natural Killer sobre o esquistossômulo.[36] O conjunto de mecanismos imunomodeladores induzidos pela larva permite sua sobreviência e penetração na pele até atingir a corrente sanguína, possibilitando a continuação do ciclo.
Após penetrarem na pele e entrarem na circulação, as esquistossômulas migram para os pulmões, uma passagem obrigatória antes de alcançarem o sistema porta-hepático. Este período de migração e desenvolvimento larval, que geralmente ocorre entre 2 e 12 semanas após a exposição inicial e pode coincidir com o início da maturação dos vermes e a primeira oviposição, está associado a uma síndrome clínica conhecida como esquistossomose aguda ou Febre de Katayama.[34] Após a complexa migração e o período de maturação no sistema porta-hepático, os vermes adultos de Schistosoma estabelecem-se nos vasos mesentéricos ou perivesicais, onde podem residir por muitos anos, acasalando-se e produzindo ovos continuamente. A resposta inicial ao parasita é marcada por IL-6, IL-12 eTNF-alfa, condizentes com um padrão Th1 de resposta celular, eficaz contra o esquistossoma adulto.[38]
A oviposição é um aspecto essencial da imunopatogênese da esquistossomose. Cada ovo, contendo um miracídio vivo e metabolicamente ativo, libera continuamente uma série de antígenos solúveis (SEA, do inglês, Soluble Egg Antigens). Os SEA, específicamente epítopos de carboidrato presentes no ovo, promovem uma intensa transição da reposta Th1 para a resposta Th2, aproximadamente na sexta semana de infecção.[35] A expressão de IL-4 por esquistossomas adultos também promove esta transição. A resposta Th2 com ativação alternativa de macrófagos é o principal promotor de granulomas, que se formam em torno dos ovos a partir da fibrosação do tecido subjascente. Na esquistossomose, a fibrose ocorre predominantemente no fígado (levando à esquistossomose hepatoesplênica, com a característica fibrose periportal ou "fibrose de Symmers") e no trato urinário.[39] Apesar da repsosta Th2 ser associada a resistência à reinfecção em humanos, é também a resposta Th2 a responsável pela fibrosação tecidual associada aos granulomas que envolvem os ovos. Assim, a resposta Th2 intensa em infecções crônicas é a principal causa da patogênese hepática.[39] Dessa forma, o equilíbrio de polarização Th1/Th2 de resposta imune é um compontente importante da infecção controlada. A subpopulação de linfócitos T regulatórios (Treg) realiza expansão clonal em repsota ao aumento da expressão de IL-4 e IL-5 associadas à resposta Th2 e libera IL-10 e TGF-β, citocinas importantes na regulação da resposta granulomatosa promovida pela Th2.
Além das clássicas subpopulações Th1 e Th2, um terceiro tipo de célula T CD4+ efetora, as células Th17, emergiu como um importante contribuinte para a imunopatologia na esquistossomose. As células Th17 são caracterizadas pela produção da citocina IL-17, IL-21 e IL-22. Os SEA são capazes de induzir o desenvolvimento de respostas Th17. Na esquistossomose, a IL-17 parece exacerbar a imunopatologia hepática e a formação de granulomas. Estudos em modelos murinos demonstraram que níveis elevados de IL-17 correlacionam-se com granulomas maiores e maior inflamação hepática.[40]
Remove ads
Diagnóstico
Resumir
Perspectiva
Nas análises sanguíneas há eosinofilia (aumento dos eosinófilos, células do sistema imunitário antiparasitas). Estes quadros só ocorrem secundariamente à hipersensibilidade ao parasita, sendo uma doença mais comum em pacientes moradores de áreas não endêmicas que se expõem a coleções hídricas contaminadas. Estes quadros duram em geral alguns dias, mas podem durar até meses e em casos raros podem ser fatais. Estes pacientes apresentam grandes granulomas periovulares necrótico-exsudativos dispersos pelos intestinos, fígado e outros órgãos. Estes sintomas podem ceder espontaneamente ou podem nem sequer surgir, mas a doença crônica silenciosa.
Os ovos podem ser encontrados no exame parasitológico de fezes, mas nas infecções recentes o exame apresenta baixa sensibilidade. Para aumentar a sensibilidade podem ser usados de coproscopia qualitativa, como Hoffman ou quantitativo, como Kato-Katz. A eficácia com três amostras chega apenas a 75%.
O hemograma demonstra leucopenia, anemia e plaquetopenia. Ocorrem alterações das provas de função hepática, com aumento de TGO, TGP e fosfatase alcalina. Embora crie a hipertensão portal, classicamente a esquistossomose preserva a função hepática. Assim, os critérios de Child-Pught, úteis no cirrótico, nem sempre funcionam no esquistossomótico que não tem associado hepatite viral ou alcoólica.
A ultrassonografia em mãos experientes pode fazer o diagnóstico, sendo patognomônico a fibrose e espessamento periportal, hipertrofia do lobo hepático esquerdo e aumento do calibre da mesentérica superior.[41]
A biopsia retal é uma técnica também utilizável, tendo uma sensibilidade de 80%.
Remove ads
Prevenção
Saneamento básico com esgotos e água tratada. Controle dos caramujos que são hospedeiros intermediários da doença. Proteção dos pés e pernas com botas de borracha com solado antiderrapante. Informar a população das medidas profiláticas da doença. Evitar entrar em contato com água que contenha cercárias. A Educação em saúde é fundamental para o controle da doença. No entanto deve ser pensada em conjunto com a população local para que tenha um impacto sustentável ao longo do tempo.
Em junho de 2012, a Fundação Oswaldo Cruz anunciou a criação de uma vacina contra a esquistossomose,[42] utilizando a proteína SM14, que se encontra em fase final de testes.[43]
Remove ads
Tratamento
Resumir
Perspectiva
Existem duas drogas: praziquantel e oxamniquina[44], para o tratamento da esquistossomose.[45] Eles são considerados equivalentes em relação à eficácia e segurança contra a S. mansoni.[46] Devido ao menor custo por tratamento do praziquantel e à falta de eficácia da oxaminiquina contra a forma urogenital da doença causada por S. haematobium, em geral o praziquantel é considerado a primeira opção de tratamento.[47] Praziquantel pode ser usado com segurança em crianças e mulheres grávidas.[21] O objetivo do tratamento é curar a doença e prevenir a evolução da forma aguda para a crônica da doença. Todos os casos de suspeita de esquistossomose devem ser tratados independentemente da apresentação, pois o parasita adulto pode viver no hospedeiro por anos.[48]
A esquistossomose é tratável tomando por via oral, uma única dose do praziquantel, anualmente.[49]
O praziquantel elimina apenas os esquistossomas adultos, não é eficaz em matar os ovos e os vermes imaturos, os ovos vivos podem ser excretados pela pessoa infectada semanas após o tratamento com praziquantel, os vermes imaturos podem sobreviver e crescer até se tornarem esquistossomas adultos após a terapia com praziquantel, sendo assim, é importante repetir o teste de esquistossomose nas fezes e/ou urina cerca de 4 a 6 semanas após a terapia com praziquantel, o tratamento com praziquantel pode ser repetido para garantir a eliminação completa do parasita.[14]
A OMS desenvolveu diretrizes para o tratamento comunitário com base no impacto que a doença tem nas crianças das aldeias nas quais é comum:[49]
- Quando uma aldeia informa que mais de 50 por cento das crianças têm sangue na urina, todos na aldeia recebem tratamento.[49]
- Quando 20 a 50 por cento das crianças têm urina com sangue, apenas crianças em idade escolar são tratadas.[49]
- Quando menos de 20% das crianças apresentam sintomas, o tratamento em massa não é implementado.[49]
Outros tratamentos possíveis incluem uma combinação de praziquantel com metrifonato, artesunato ou mefloquina.[50] Uma revisão Cochrane encontrou evidências preliminares de que, quando usado sozinho, o metrifonato era tão eficaz quanto o praziquantel.[50] A mefloquina, que já foi usada para tratar e prevenir a malária, foi reconhecida em 2008-2009 como eficaz contra esquistossomos.[51]
Historicamente, o Antimonium tartaricum permaneceu como o tratamento de escolha para a esquistossomose até o desenvolvimento do praziquantel na década de 1980.[52]
Monitoramento pós-tratamento
A Osteopontina (OPN) é uma ferramenta promissora para monitorar a eficácia do praziquantel e a regressão da fibrose pós-tratamento à medida que a expressão (OPN) é modulada por S. mansoni e seus níveis se correlacionam com a gravidade da fibrose da esquistossomose e hipertensão portal em camundongos e humanos. A farmacoterapia com praziquantel reduz os níveis sistêmicos de OPN e o conteúdo de colágeno hepático em camundongos.[53]
Brasil
No Brasil o composto do praziquantel é importando da China e produzido exclusivamente pelo Farmanguinhos, laboratório da Fundação Oswaldo Cruz (Fiocruz), e vende somente só para o Ministério da Saúde, que o distribui para postos de saúde pelo país, o medicamento não é encontrado em farmácias.[54]
A Merck, empresa detentora dos direitos patenteados dos medicamentos praziquantel Cisticid®, disponível em comprimidos de 500 mg, e Cestox®, em comprimidos de 150 mg - informou que solicitou à Anvisa a suspensão da produção do Cestox em abril de 2012. A suspensão ocorreu 180 dias depois, embora a razão não tenha sido divulgada pela empresa. Enquanto isso, o Cisticid é vendido por uma distribuidora de São Paulo e destinado ao uso hospitalar. O SUS fornece o praziquantel produzido pela Fundação Oswaldo Cruz (Fiocruz) no Rio de Janeiro, em cápsulas de 600 mg e 150 mg, e garante que não há falta do medicamento na rede pública.[55]
Remove ads
História
Com o desenvolvimento da agricultura, a esquistossomose passou de doença rara a problema sério. Muitas múmias egípcias apresentam as lesões inconfundíveis da esquistossomose por S. haematobium. A infecção pelos parasitas dava-se nos trabalhos de irrigação da agricultura. As cheias do Nilo sempre foram a fonte da prosperidade do Egito, mas também traziam os caracóis portadores dos schistosomas. O hábito dos agricultores de fazer as plantações e trabalhos de irrigação com os pés descalços metidos na água parada, favorecia a disseminação da doença crônica causada por estes parasitas.
A doença foi descrita cientificamente pela primeira vez em 1851 pelo médico alemão Theodor Maximilian Bilharz, que lhe dá o nome alternativo de bilharzíase.
Remove ads
Referências
- «Schistosomiasis Fact sheet N°115». World Health Organization. 3 de fevereiro de 2014. Consultado em 15 de março de 2014. Arquivado do original em 12 de março de 2014
- «Esquistossomose». Ministério da Saúde. Consultado em 31 de dezembro de 2022
- Colley, Daniel G.; Bustinduy, Amaya L.; Secor, W. Evan; King, Charles H. «Human schistosomiasis». The Lancet. 383 (9936): 2253–2264. PMC 4672382
 . PMID 24698483. doi:10.1016/s0140-6736(13)61949-2. Cópia arquivada em 29 de agosto de 2014
. PMID 24698483. doi:10.1016/s0140-6736(13)61949-2. Cópia arquivada em 29 de agosto de 2014 - «Chapter 3 Infectious Diseases Related To Travel». cdc.gov. 1 de agosto de 2013. Consultado em 30 de novembro de 2014. Cópia arquivada em 2 de abril de 2015
- Thétiot-Laurent, S. A.; Boissier, J.; Robert, A.; Meunier, B. (27 de junho de 2013). «Schistosomiasis Chemotherapy». Angewandte Chemie International Edition in English. 52 (31): 7936–56. PMID 23813602. doi:10.1002/anie.201208390
- «Schistosomiasis A major public health problem». World Health Organization. Consultado em 15 de março de 2014. Cópia arquivada em 5 de abril de 2014
- The Carter Center. «Schistosomiasis Control Program». Consultado em 17 de julho de 2008. Cópia arquivada em 20 de julho de 2008
- «Neglected Tropical Diseases». cdc.gov. 6 de junho de 2011. Consultado em 28 de novembro de 2014. Cópia arquivada em 4 de dezembro de 2014
- «Schistosoma/Schistosomiasis». The Lecturio Medical Concept Library. Consultado em 2 de julho de 2021
- Gryseels B, Polman K, Clerinx J, Kestens L (setembro de 2006). «Human schistosomiasis». Lancet. 368 (9541): 1106–18. PMID 16997665. doi:10.1016/s0140-6736(06)69440-3
- «Parasites - Schistosomiasis, Disease». www.cdc.gov. Consultado em 4 de dezembro de 2016. Cópia arquivada em 2 de dezembro de 2016
- «Esquistossomose (Bilharzíase)». Manual Merck Sharp-Dhome. Consultado em 18 de abril de 2023
- Hunter's Tropical Medicine and Emerging Infectious Diseases (em inglês). [S.l.]: Elsevier. 2020. ISBN 978-0-323-55512-8. doi:10.1016/c2016-0-01879-x
- «CDC - DPDx - Cercarial Dermatitis». www.cdc.gov (em inglês). 13 de maio de 2019. Consultado em 1 de novembro de 2021
- Gray DJ, Ross AG, Li YS, McManus DP (maio de 2011). «Diagnosis and management of schistosomiasis». BMJ. 342: d2651. PMC 3230106
 . PMID 21586478. doi:10.1136/bmj.d2651
. PMID 21586478. doi:10.1136/bmj.d2651 - Bottieau E, Clerinx J, de Vega MR, Van den Enden E, Colebunders R, Van Esbroeck M, et al. (maio 2006). «Imported Katayama fever: clinical and biological features at presentation and during treatment». The Journal of Infection. 52 (5): 339–45. PMID 16169593. doi:10.1016/j.jinf.2005.07.022
- Ross AG, Bartley PB, Sleigh AC, Olds GR, Li Y, Williams GM, McManus DP (abril de 2002). «Schistosomiasis» (PDF). The New England Journal of Medicine. 346 (16): 1212–20. PMID 11961151. doi:10.1056/NEJMra012396
- Rosenthal, Philip J. (2021), Papadakis, Maxine A.; McPhee, Stephen J.; Rabow, Michael W., eds., «Schistosomiasis (Bilharziasis)», New York, NY: McGraw-Hill Education, Current Medical Diagnosis & Treatment 2021, consultado em 1 de novembro de 2021
- Ross AG, Sleigh AC, Li Y, Davis GM, Williams GM, Jiang Z, et al. (abril 2001). «Schistosomiasis in the People's Republic of China: prospects and challenges for the 21st century». Clinical Microbiology Reviews. 14 (2): 270–95. PMC 88974
 . PMID 11292639. doi:10.1128/CMR.14.2.270-295.2001
. PMID 11292639. doi:10.1128/CMR.14.2.270-295.2001 - Mandell GL, Bennett JE, Dolin R, Douglas RG (2010). «Trematodes (Schistosomes and Liver, Intestinal, and Lung Flukes)». Mandell, Douglas, and Bennett's Principles and Practice of Infectious Diseases. [S.l.: s.n.] pp. 3216–3226.e3. ISBN 978-0443068393
- «Schistosomiasis». www.niaid.nih.gov. Consultado em 7 de fevereiro de 2016. Cópia arquivada em 13 de fevereiro de 2016
- Elbaz, Tamer; Esmat, Gamal (1 de setembro de 2013). «Hepatic and Intestinal Schistosomiasis: Review». Journal of Advanced Research (em inglês). 4 (5): 445–452. ISSN 2090-1232. PMC 4293886
 . PMID 25685451. doi:10.1016/j.jare.2012.12.001
. PMID 25685451. doi:10.1016/j.jare.2012.12.001 - Elbaz, Tamer; Esmat, Gamal (setembro 2013). «Hepatic and Intestinal Schistosomiasis: Review». Journal of Advanced Research (em inglês). 4 (5): 445–452. ISSN 2090-1232. PMC 4293886
 . PMID 25685451. doi:10.1016/j.jare.2012.12.001
. PMID 25685451. doi:10.1016/j.jare.2012.12.001 - Yegorov S, Joag V, Galiwango RM, Good SV, Okech B, Kaul R (2019). «Impact of Endemic Infections on HIV Susceptibility in Sub-Saharan Africa». Tropical Diseases, Travel Medicine and Vaccines. 5. 22 páginas. PMC 6884859
 . PMID 31798936. doi:10.1186/s40794-019-0097-5
. PMID 31798936. doi:10.1186/s40794-019-0097-5 - Mostafa MH, Sheweita SA, O'Connor PJ (janeiro de 1999). «Relationship between schistosomiasis and bladder cancer». Clinical Microbiology Reviews. 12 (1): 97–111. PMC 88908
 . PMID 9880476. doi:10.1128/CMR.12.1.97
. PMID 9880476. doi:10.1128/CMR.12.1.97 - Feldmeier H, Krantz I, Poggensee G (março de 1995). «Female genital schistosomiasis: a neglected risk factor for the transmission of HIV?». Transactions of the Royal Society of Tropical Medicine and Hygiene. 89 (2). 237 páginas. PMID 7778161. doi:10.1016/0035-9203(95)90512-x
- «Neuroesquistossomose». Revista Neurociências - UNIFESP. Consultado em 18 de abril de 2023
- Nation, Catherine S.; Da’dara, Akram A.; Marchant, Jeffrey K.; Skelly, Patrick J. (2 de abr. de 2020). «Schistosome migration in the definitive host». PLOS Neglected Tropical Diseases (em inglês) (4): e0007951. ISSN 1935-2735. PMC 7117656
 . PMID 32240157. doi:10.1371/journal.pntd.0007951. Consultado em 31 de maio de 2025
. PMID 32240157. doi:10.1371/journal.pntd.0007951. Consultado em 31 de maio de 2025 - Houlder, Emma L.; Costain, Alice H.; Cook, Peter C.; MacDonald, Andrew S. (19 de abril de 2021). «Schistosomes in the Lung: Immunobiology and Opportunity». Frontiers in Immunology (em inglês). ISSN 1664-3224. PMC 8089482
 . PMID 33953712. doi:10.3389/fimmu.2021.635513. Consultado em 31 de maio de 2025
. PMID 33953712. doi:10.3389/fimmu.2021.635513. Consultado em 31 de maio de 2025 - Molehin, Adebayo J. (2 de novembro de 2020). «Current Understanding of Immunity Against Schistosomiasis: Impact on Vaccine and Drug Development». Research and Reports in Tropical Medicine (em inglês): 119–128. PMC 7646453
 . PMID 33173371. doi:10.2147/RRTM.S274518. Consultado em 31 de maio de 2025
. PMID 33173371. doi:10.2147/RRTM.S274518. Consultado em 31 de maio de 2025 - Rogers, Madeleine; Kamath, Sandip; McManus, Donald; Jones, Malcolm; Gordon, Catherine; Navarro, Severine (setembro de 2024). «Schistosoma excretory/secretory products: an untapped library of tolerogenic immunotherapeutics against food allergy». Clinical & Translational Immunology (em inglês) (9). ISSN 2050-0068. PMC 11359118
 . PMID 39221178. doi:10.1002/cti2.70001. Consultado em 31 de maio de 2025
. PMID 39221178. doi:10.1002/cti2.70001. Consultado em 31 de maio de 2025 - «Validate User». academic.oup.com. doi:10.1093/oxfordjournals.bmb.a011693. Consultado em 31 de maio de 2025
- Hambrook, Jacob R.; Hanington, Patrick C. (4 de fevereiro de 2021). «Immune Evasion Strategies of Schistosomes». Frontiers in Immunology (em inglês). ISSN 1664-3224. PMC 7889519
 . PMID 33613562. doi:10.3389/fimmu.2020.624178. Consultado em 31 de maio de 2025
. PMID 33613562. doi:10.3389/fimmu.2020.624178. Consultado em 31 de maio de 2025 - Zheng, Bing; Zhang, Jianqiang; Chen, Hui; Nie, Hao; Miller, Heather; Gong, Quan; Liu, Chaohong (18 de fevereiro de 2020). «T Lymphocyte-Mediated Liver Immunopathology of Schistosomiasis». Frontiers in Immunology (em inglês). ISSN 1664-3224. PMC 7040032
 . PMID 32132991. doi:10.3389/fimmu.2020.00061. Consultado em 31 de maio de 2025
. PMID 32132991. doi:10.3389/fimmu.2020.00061. Consultado em 31 de maio de 2025 - Angeles, Jose Ma M.; Mercado, Van Jerwin P.; Rivera, Pilarita T. (9 de junho de 2020). «Behind Enemy Lines: Immunomodulatory Armamentarium of the Schistosome Parasite». Frontiers in Immunology (em inglês). ISSN 1664-3224. PMC 7295904
 . PMID 32582161. doi:10.3389/fimmu.2020.01018. Consultado em 31 de maio de 2025
. PMID 32582161. doi:10.3389/fimmu.2020.01018. Consultado em 31 de maio de 2025 - Neher, Clarissa (24 de março de 2014). «Brasil está perto de lançar vacina pioneira contra esquistossomose». DW. Consultado em 7 de maio de 2014
- «eMedicine - Schistosomiasis». eMedicine. Consultado em 14 de junho de 2007. Arquivado do original em 7 de julho de 2007
- Danso-Appiah A, Olliaro PL, Donegan S, Sinclair D, Utzinger J (fevereiro 2013). «Drugs for treating Schistosoma mansoni infection» (PDF). The Cochrane Database of Systematic Reviews. 2 (2): CD000528. PMC 6532716
 . PMID 23450530. doi:10.1002/14651858.cd000528.pub2
. PMID 23450530. doi:10.1002/14651858.cd000528.pub2 - «WHO TDR news item, 4th Dec 2014, Praziquantel dose confirmed for schistosomiasis». Consultado em 5 de setembro de 2016. Arquivado do original em 13 de setembro de 2016
- The Carter Center. «How is Schistosomiasis Treated?». Consultado em 17 julho de 2008. Cópia arquivada em 25 de fevereiro de 2008
- Kramer CV, Zhang F, Sinclair D, Olliaro PL (agosto 2014). «Drugs for treating urinary schistosomiasis». The Cochrane Database of Systematic Reviews. 8 (8): CD000053. PMC 4447116
 . PMID 25099517. doi:10.1002/14651858.CD000053.pub3
. PMID 25099517. doi:10.1002/14651858.CD000053.pub3 - Xiao SH (novembro 2013). «Mefloquine, a new type of compound against schistosomes and other helminthes in experimental studies». Parasitology Research. 112 (11): 3723–40. PMID 23979493. doi:10.1007/s00436-013-3559-0
- Walker MD (agosto 2018). «Etymologia: Antimony». Emerg. Infect. Dis. 24 (8). 1601 páginas. doi:10.3201/eid2408.et2408
 .
. citing public domain text, published by the CDC
- Pereira, Thiago A.; Vaz De Melo Trindade, Guilherme; Trindade Santos, Elisangela; Pereira, Fausto E.L.; Souza, Márcia Maria de (23 de janeiro de 2021). «Praziquantel pharmacotherapy reduces systemic osteopontin levels and liver collagen content in murine schistosomiasis mansoni». International Journal for Parasitology (em inglês). 51 (6): 437–440. ISSN 0020-7519. PMID 33493521. doi:10.1016/j.ijpara.2020.11.002
- «Esquistossomose: os perigos presentes e futuros do declínio do praziquantel». Marco Zero. Consultado em 17 de abril de 2023
- «Falta remédio para xistose nas farmácias». Estado de Minas. 31 de maio de 2013. Consultado em 17 de abril de 2023
Remove ads
Ligações externas
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads