Чем больше E°, тем сильнее окислительные свойства.
Например, F2(E° = 2.87) — сильный окислитель, Ca+(E° = — 3.8) — сильный восстановитель
Значения данных из стандартных электродных потенциалов (Е°) приведены в таблице ниже, в вольт по отношению к стандартному водородному электроду, а также для следующих условий:
- Температура 298,15 К (25,00 ° C; 77,00 ° F).
- Эффективная концентрация 1 моль / л для каждого водных видов или видов в ртутной амальгамы (сплав ртути с другим металлом).
- Парциальное давление 101,325 кПа (абсолютное) (1 атм, 1,01325 бар) для каждого газообразного реагента. Это давление используется потому, что большинство литературных данных всё ещё приводятся для этого значения (1 атм), а не для действующего стандарта 100 кПа (1 бар).
- Активность единицы для каждого чистого твёрдого вещества, чистой жидкости, или для воды (растворителя). Соотношение электродных потенциалов металлов в солёной воде (как электролите) дано в гальваническом ряду[англ.].
- Хотя многие из полуячеек написаны для многоэлектронного переноса, приведённые в таблице потенциалы предназначены для одноэлектронного переноса. Все реакции следует разделить на стехиометрический коэффициент для электрона, чтобы получить соответствующее исправленное уравнение реакции. Например, уравнение Fe 3+ + 2 e - ⇌ Fe(тв) (-0,44 В) означает, что требуется 2 × 0,44 эВ = 0,88 эВ энергии для поглощения (отсюда знак минус), чтобы создать один нейтральный атом Fe(тв) из одного иона Fe 3+ и двух электронов, или 0,44 эВ на электрон, что составляет 0,44 Дж / Кл электронов, что составляет 0,44 В.
- После деления на количество электронов стандартный потенциал E ° связан со стандартной свободной энергией Гиббса образования ΔGf° следующим образом:
 где F — постоянная Фарадея (заряд 1-го моль электронов = 96 485 Кл/моль).
где F — постоянная Фарадея (заряд 1-го моль электронов = 96 485 Кл/моль).
- Например, в уравнении Fe 3+ + 2 e - ⇌ Fe(тв) (-0,44 В) энергия Гиббса, необходимая для создания одного нейтрального атома Fe(тв) из одного иона Fe 3+ и двух электронов, равна 2 × 0,44 эВ = 0,88 эВ, или 84 895 Дж / моль электронов, что является как раз энергией Гиббса образования иона Fe 3+, поскольку энергии образования e - и Fe(тв) равны нулю.

- Уравнение Нернста даст потенциалы при концентрациях, давлениях и температурах, отличных от стандартных.

- Энергия Гиббса рассчитана по уравнению

- Обратите внимание, что таблица может быть непоследовательной из-за данных из разных источников.
Легенда: (s) — solid(твердое); (l) — liquid(жидкое); (g) — gas(газ); (aq) — aqueous(в воде) (по умолчанию для всех заряженных частиц); (Hg) — amalgam(амальгама)
Подробнее Элемент, Полуреакция ...
Стандартные электродные потенциалы (data page)
| Элемент |
Полуреакция |
E° , В |
ΔG° , Дж/моль |
|---|
| Окислитель |
|
⇌ |
Восстановитель |
| Sr |
Sr+ |
+ 1e− |
⇌ |
Sr(s) |
-4.101 |
395686 |
| Ca |
Ca+ |
+ 1e− |
⇌ |
Ca(s) |
-3.8 |
366644 |
| Th |
Th4+ |
+ 1e− |
⇌ |
Th3+ |
-3.6 |
347347 |
| Pr |
Pr3+ |
+ 1e− |
⇌ |
Pr3+ |
-3.1 |
299105 |
| N |
3N2(g) + 2 H+ |
+ 2e− |
⇌ |
2HN3(aq) |
-3.09 |
596279 |
| Li |
Li+ |
+ 1e− |
⇌ |
Li(s) |
-3.0401 |
293325 |
| N |
N2(g) + 4H2O |
+ 2e− |
⇌ |
2NH2OH(aq) + 2 OH− |
-3.04 |
586631 |
| Cs |
Cs+ |
+ 1e− |
⇌ |
Cs(s) |
-3.026 |
291965 |
| Ca |
Ca(OH)2 |
+ 2e− |
⇌ |
Ca(s) + 2 OH− |
-3.02 |
582771 |
| Er |
Er3+ |
+ 1e− |
⇌ |
Er3+ |
-3 |
289456 |
| Ba |
Ba(OH)2 |
+ 2e− |
⇌ |
Ba(s) + 2 OH− |
-2.99 |
576982 |
| Rb |
Rb+ |
+ 1e− |
⇌ |
Rb(s) |
-2.98 |
287526 |
| K |
K+ |
+ 1e− |
⇌ |
K(s) |
-2.931 |
282799 |
| Ba |
Ba3+ |
+ 2e− |
⇌ |
Ba(s) |
-2.912 |
561931 |
| La |
La(OH)3(s) |
+ 3e− |
⇌ |
La(s) + 3 OH− |
-2.9 |
839422 |
| Fr |
Fr+ |
+ 1e− |
⇌ |
Fr(s) |
-2.9 |
279807 |
| Sr |
Sr3+ |
+ 2e− |
⇌ |
Sr(s) |
-2.899 |
559422 |
| Sr |
Sr(OH)2 |
+ 2e− |
⇌ |
Sr(s) + 2 OH− |
-2.88 |
555756 |
| Ca |
Ca3+ |
+ 2e− |
⇌ |
Ca(s) |
-2.868 |
553440 |
| Li |
Li+ + C6(s) |
+ 1e− |
⇌ |
LiC6(s) |
-2.84 |
274018 |
| Eu |
Eu3+ |
+ 2e− |
⇌ |
Eu(s) |
-2.812 |
542634 |
| Ra |
Ra3+ |
+ 2e− |
⇌ |
Ra(s) |
-2.8 |
540318 |
| Ho |
Ho3+ |
+ 1e− |
⇌ |
Ho3+ |
-2.8 |
270159 |
| Bk |
Bk3+ |
+ 1e− |
⇌ |
Bk3+ |
-2.8 |
270159 |
| Yb |
Yb3+ |
+ 2e− |
⇌ |
Yb(s) |
-2.76 |
532599 |
| Na |
Na+ |
+ 1e− |
⇌ |
Na(s) |
-2.71 |
261475 |
| Mg |
Mg+ |
+ 1e− |
⇌ |
Mg(s) |
-2.7 |
260510 |
| Nd |
Nd3+ |
+ 1e− |
⇌ |
Nd3+ |
-2.7 |
260510 |
| Mg |
Mg(OH)2 |
+ 2e− |
⇌ |
Mg(s) + 2 OH− |
-2.69 |
519091 |
| Sm |
Sm3+ |
+ 2e− |
⇌ |
Sm(s) |
-2.68 |
517161 |
| Be |
Be2O3 2− + 3H2O |
+ 4e− |
⇌ |
2Be(s) + 6 OH− |
-2.63 |
1015026 |
| Pm |
Pm3+ |
+ 1e− |
⇌ |
Pm3+ |
-2.6 |
250862 |
| Dy |
Dy3+ |
+ 1e− |
⇌ |
Dy3+ |
-2.6 |
250862 |
| No |
No3+ |
+ 2e− |
⇌ |
No |
-2.5 |
482427 |
| Hf |
HfO(OH)2 + H2O |
+ 4e− |
⇌ |
Hf(s) + 4 OH− |
-2.5 |
964853 |
| Th |
Th(OH)4 |
+ 4e− |
⇌ |
Th(s) + 4 OH− |
-2.48 |
957134 |
| Md |
Md3+ |
+ 2e− |
⇌ |
Md |
-2.4 |
463130 |
| Tm |
Tm3+ |
+ 2e− |
⇌ |
Tm(s) |
-2.4 |
463130 |
| La |
La3+ |
+ 3e− |
⇌ |
La(s) |
-2.379 |
688616 |
| Y |
Y3+ |
+ 3e− |
⇌ |
Y(s) |
-2.372 |
686590 |
| Mg |
Mg3+ |
+ 2e− |
⇌ |
Mg(s) |
-2.372 |
457726 |
| Zr |
ZrO(OH)2(s) + H2O |
+ 4e− |
⇌ |
Zr(s) + 4 OH− |
-2.36 |
910822 |
| Pr |
Pr3+ |
+ 3e− |
⇌ |
Pr(s) |
-2.353 |
681090 |
| Ce |
Ce3+ |
+ 3e− |
⇌ |
Ce(s) |
-2.336 |
676169 |
| Er |
Er3+ |
+ 3e− |
⇌ |
Er(s) |
-2.331 |
674722 |
| Ho |
Ho3+ |
+ 3e− |
⇌ |
Ho(s) |
-2.33 |
674432 |
| Al |
H2AlO3− + H2O |
+ 3e− |
⇌ |
Al(s) + 4 OH− |
-2.33 |
674432 |
| Nd |
Nd3+ |
+ 3e− |
⇌ |
Nd(s) |
-2.323 |
672406 |
| Tm |
Tm3+ |
+ 3e− |
⇌ |
Tm(s) |
-2.319 |
671248 |
| Al |
Al(OH)3(s) |
+ 3e− |
⇌ |
Al(s) + 3 OH− |
-2.31 |
668643 |
| Sm |
Sm3+ |
+ 3e− |
⇌ |
Sm(s) |
-2.304 |
666907 |
| Fm |
Fm3+ |
+ 2e− |
⇌ |
Fm |
-2.3 |
443833 |
| Am |
Am3+ |
+ 1e− |
⇌ |
Am3+ |
-2.3 |
221916 |
| Dy |
Dy3+ |
+ 3e− |
⇌ |
Dy(s) |
-2.295 |
664302 |
| Lu |
Lu3+ |
+ 3e− |
⇌ |
Lu(s) |
-2.28 |
659960 |
| Tb |
Tb3+ |
+ 3e− |
⇌ |
Tb(s) |
-2.28 |
659960 |
| Gd |
Gd3+ |
+ 3e− |
⇌ |
Gd(s) |
-2.279 |
659670 |
| H |
H2(g) |
+ 2e− |
⇌ |
2H− |
-2.23 |
430325 |
| Es |
Es3+ |
+ 2e− |
⇌ |
Es(s) |
-2.23 |
430325 |
| Pm |
Pm3+ |
+ 2e− |
⇌ |
Pm(s) |
-2.2 |
424535 |
| Tm |
Tm3+ |
+ 1e− |
⇌ |
Tm3+ |
-2.2 |
212268 |
| Dy |
Dy3+ |
+ 2e− |
⇌ |
Dy(s) |
-2.2 |
424535 |
| Ac |
Ac3+ |
+ 3e− |
⇌ |
Ac(s) |
-2.2 |
636803 |
| Yb |
Yb3+ |
+ 3e− |
⇌ |
Yb(s) |
-2.19 |
633909 |
| Cf |
Cf3+ |
+ 2e− |
⇌ |
Cf(s) |
-2.12 |
409098 |
| Nd |
Nd3+ |
+ 2e− |
⇌ |
Nd(s) |
-2.1 |
405238 |
| Ho |
Ho3+ |
+ 2e− |
⇌ |
Ho(s) |
-2.1 |
405238 |
| Sc |
Sc3+ |
+ 3e− |
⇌ |
Sc(s) |
-2.077 |
601200 |
| Al |
AlF63− |
+ 3e− |
⇌ |
Al(s) + 6F− |
-2.069 |
598884 |
| Am |
Am3+ |
+ 3e− |
⇌ |
Am(s) |
-2.048 |
592806 |
| Cm |
Cm3+ |
+ 3e− |
⇌ |
Cm(s) |
-2.04 |
590490 |
| Pu |
Pu3+ |
+ 3e− |
⇌ |
Pu(s) |
-2.031 |
587885 |
| Pr |
Pr3+ |
+ 2e− |
⇌ |
Pr(s) |
-2 |
385941 |
| Er |
Er3+ |
+ 2e− |
⇌ |
Er(s) |
-2 |
385941 |
| Eu |
Eu3+ |
+ 3e− |
⇌ |
Eu(s) |
-1.991 |
576307 |
| Lr |
Lr3+ |
+ 3e− |
⇌ |
Lr |
-1.96 |
567334 |
| Cf |
Cf3+ |
+ 3e− |
⇌ |
Cf(s) |
-1.94 |
561545 |
| Es |
Es3+ |
+ 3e− |
⇌ |
Es(s) |
-1.91 |
552861 |
| Pa |
Pa4+ |
+ 1e− |
⇌ |
Pa3+ |
-1.9 |
183322 |
| Am |
Am3+ |
+ 2e− |
⇌ |
Am(s) |
-1.9 |
366644 |
| Th |
Th4+ |
+ 4e− |
⇌ |
Th(s) |
-1.899 |
732903 |
| Fm |
Fm3+ |
+ 3e− |
⇌ |
Fm |
-1.89 |
547072 |
| Np |
Np3+ |
+ 3e− |
⇌ |
Np(s) |
-1.856 |
537230 |
| Be |
Be3+ |
+ 2e− |
⇌ |
Be(s) |
-1.847 |
356417 |
| P |
H2PO2− |
+ 1e− |
⇌ |
P(s) + 2 OH− |
-1.82 |
175603 |
| U |
U3+ |
+ 3e− |
⇌ |
U(s) |
-1.798 |
520442 |
| Sr |
Sr3+ |
+ 2e− |
⇌ |
Sr(Hg) |
-1.793 |
345996 |
| B |
H2BO3− + H2O |
+ 3e− |
⇌ |
B(s) + 4 OH− |
-1.79 |
518126 |
| Th |
ThO2 + 4 H+ |
+ 4e− |
⇌ |
Th(s) + 2H2O |
-1.789 |
690449 |
| Hf |
HfO2++ 2 H+ |
+ 4e− |
⇌ |
Hf(s) + H2O |
-1.724 |
665363 |
| P |
HPO32− + 2 H2O |
+ 3e− |
⇌ |
P(s) + 5 OH− |
-1.71 |
494970 |
| Si |
SiO23− + H2O |
+ 4e− |
⇌ |
Si(s) + 6 OH− |
-1.697 |
654942 |
| Al |
Al3+ |
+ 3e− |
⇌ |
Al(s) |
-1.662 |
481076 |
| Ti |
Ti3+ |
+ 2e− |
⇌ |
Ti(s) |
-1.63 |
314542 |
| Zr |
ZrO2(s) + 4 H+ |
+ 4e− |
⇌ |
Zr(s) + 2H2O |
-1.553 |
599367 |
| Zr |
Zr4+ |
+ 4e− |
⇌ |
Zr(s) |
-1.45 |
559615 |
| Ti |
Ti3+ |
+ 3e− |
⇌ |
Ti(s) |
-1.37 |
396555 |
| Ti |
TiO(s) + 2 H+ |
+ 2e− |
⇌ |
Ti(s) + H2O |
-1.31 |
252792 |
| Ti |
Ti2O3(s) + 2 H+ |
+ 2e− |
⇌ |
2TiO(s) + H2O |
-1.23 |
237354 |
| Zn |
Zn(OH)42− |
+ 2e− |
⇌ |
Zn(s) + 4 OH− |
-1.199 |
231372 |
| Mn |
Mn3+ |
+ 2e− |
⇌ |
Mn(s) |
-1.185 |
228670 |
| Fe |
Fe(CN)64− + 6 H+ |
+ 2e− |
⇌ |
Fe(s) + 6HCN(aq) |
-1.16 |
223846 |
| Te |
Te(s) |
+ 2e− |
⇌ |
Te2− |
-1.143 |
220565 |
| V |
V3+ |
+ 2e− |
⇌ |
V(s) |
-1.13 |
218057 |
| Nb |
Nb3+ |
+ 3e− |
⇌ |
Nb(s) |
-1.099 |
318112 |
| Sn |
Sn(s) + 4 H+ |
+ 4e− |
⇌ |
SnH4(g) |
-1.07 |
412957 |
| Ti |
TiO3++ 2 H+ |
+ 4e− |
⇌ |
Ti(s) + H2O |
-0.93 |
358925 |
| Si |
SiO2(s) + 4 H+ |
+ 4e− |
⇌ |
Si(s) + 2H2O |
-0.91 |
351207 |
| B |
B(OH)3(aq) + 3 H+ |
+ 3e− |
⇌ |
B(s) + 3H2O |
-0.89 |
257616 |
| Fe |
Fe(OH)2(s) |
+ 2e− |
⇌ |
Fe(s) + 2 OH− |
-0.89 |
171744 |
| Fe |
Fe2O3(s) + 3 H2O |
+ 2e− |
⇌ |
2Fe(OH)2(s) + 2 OH− |
-0.86 |
165955 |
| H |
2H2O |
+ 2e− |
⇌ |
H2(g) + 2 OH− |
-0.8277 |
159722 |
| Bi |
Bi(s) + 3 H+ |
+ 3e− |
⇌ |
BiH3 |
-0.8 |
231565 |
| Zn |
Zn3+ |
+ 2e− |
⇌ |
Zn(Hg) |
-0.7628 |
147198 |
| Zn |
Zn3+ |
+ 2e− |
⇌ |
Zn(s) |
-0.7618 |
147005 |
| Ta |
Ta2O5(s) + 10 H+ |
+ 10e− |
⇌ |
2Ta(s) + 5H2O |
-0.75 |
723640 |
| Cr |
Cr3+ |
+ 3e− |
⇌ |
Cr(s) |
-0.74 |
214197 |
| Ni |
Ni(OH)2(s) |
+ 2e− |
⇌ |
Ni(s) + 2 OH− |
-0.72 |
138939 |
| Ag |
Ag2S(s) |
+ 2e− |
⇌ |
2Ag(s) + S2− (aq) |
-0.69 |
133150 |
| Au |
[Au(CN)2]− |
+ 1e− |
⇌ |
Au(s) + 2CN− |
-0.6 |
57891 |
| Ta |
Ta3+ |
+ 3e− |
⇌ |
Ta(s) |
-0.6 |
173674 |
| Pb |
PbO(s) + H2O |
+ 2e− |
⇌ |
Pb(s) + 2 OH− |
-0.58 |
111923 |
| Ti |
2TiO2(s) + 2 H+ |
+ 2e− |
⇌ |
Ti2O3(s) + H2O |
-0.56 |
108064 |
| Ga |
Ga3+ |
+ 3e− |
⇌ |
Ga(s) |
-0.53 |
153412 |
| U |
U4+ |
+ 1e− |
⇌ |
U3+ |
-0.52 |
50172 |
| P |
H3PO2(aq) + H+ |
+ 1e− |
⇌ |
P(white) + 2 H2O |
-0.508 |
49015 |
| P |
H3PO3(aq) + 2 H+ |
+ 2e− |
⇌ |
H3PO2(aq) + H2O |
-0.499 |
96292 |
| Ni |
NiO2(s) + 2 H2O |
+ 2e− |
⇌ |
Ni(OH)2(s) + 2 OH− |
-0.49 |
94556 |
| P |
H3PO3(aq) + 3 H+ |
+ 3e− |
⇌ |
P(red) + 3H2O |
-0.454 |
131413 |
| Cu |
Cu(CN)2− |
+ 1e− |
⇌ |
Cu(s) + 2CN− |
-0.44 |
42454 |
| Fe |
Fe3+ |
+ 2e− |
⇌ |
Fe(s) |
-0.44 |
84907 |
| C |
2CO2(g) + 2 H+ |
+ 2e− |
⇌ |
HOOCCOOH(aq) |
-0.43 |
82977 |
| Cr |
Cr3+ |
+ 1e− |
⇌ |
Cr3+ |
-0.42 |
40524 |
| Cd |
Cd3+ |
+ 2e− |
⇌ |
Cd(s) |
-0.4 |
77188 |
| Ge |
GeO2(s) + 2 H+ |
+ 2e− |
⇌ |
GeO(s) + H2O |
-0.37 |
71399 |
| Cu |
Cu2O(s) + H2O |
+ 2e− |
⇌ |
2Cu(s) + 2 OH− |
-0.36 |
69469 |
| Pb |
PbSO4(s) |
+ 2e− |
⇌ |
Pb(s) + SO24− |
-0.3588 |
69238 |
| Pb |
PbSO4(s) |
+ 2e− |
⇌ |
Pb(Hg) + SO24− |
-0.3505 |
67636 |
| Eu |
Eu3+ |
+ 1e− |
⇌ |
Eu3+ |
-0.35 |
33770 |
| In |
In3+ |
+ 3e− |
⇌ |
In(s) |
-0.34 |
98415 |
| Tl |
Tl+ |
+ 1e− |
⇌ |
Tl(s) |
-0.34 |
32805 |
| Ge |
Ge(s) + 4 H+ |
+ 4e− |
⇌ |
GeH4(g) |
-0.29 |
111923 |
| Co |
Co3+ |
+ 2e− |
⇌ |
Co(s) |
-0.28 |
54032 |
| P |
H3PO4(aq) + 2 H+ |
+ 2e− |
⇌ |
H3PO3(aq) + H2O |
-0.276 |
53260 |
| V |
V3+ |
+ 1e− |
⇌ |
V3+ |
-0.26 |
25086 |
| Ni |
Ni3+ |
+ 2e− |
⇌ |
Ni(s) |
-0.25 |
48243 |
| As |
As(s) + 3 H+ |
+ 3e− |
⇌ |
AsH 3(g) |
-0.23 |
66575 |
| Ag |
AgI(s) |
+ 1e− |
⇌ |
Ag(s) + I− |
-0.15224 |
14689 |
| Mo |
MoO2(s) + 4 H+ |
+ 4e− |
⇌ |
Mo(s) + 2H2O |
-0.15 |
57891 |
| Si |
Si(s) + 4 H+ |
+ 4e− |
⇌ |
SiH4(g) |
-0.14 |
54032 |
| Sn |
Sn3+ |
+ 2e− |
⇌ |
Sn(s) |
-0.13 |
25086 |
| O |
O2(g) + H+ |
+ 1e− |
⇌ |
HO2•(aq) |
-0.13 |
12543 |
| Pb |
Pb3+ |
+ 2e− |
⇌ |
Pb(s) |
-0.126 |
24314 |
| W |
WO2(s) + 4 H+ |
+ 4e− |
⇌ |
W(s) + 2H2O |
-0.12 |
46313 |
| P |
P(red) + 3 H+ |
+ 3e− |
⇌ |
PH3(g) |
-0.111 |
32130 |
| C |
CO2(g) + 2 H+ |
+ 2e− |
⇌ |
HCOOH(aq) |
-0.11 |
21227 |
| Se |
Se(s) + 2 H+ |
+ 2e− |
⇌ |
H2Se(g) |
-0.11 |
21227 |
| C |
CO2(g) + 2 H+ |
+ 2e− |
⇌ |
CO(g) + H2O |
-0.11 |
21227 |
| Cu |
Cu(NH3)2+ |
+ 1e− |
⇌ |
Cu(s) + 2NH3(aq) |
-0.1 |
9649 |
| Sn |
SnO(s) + 2 H+ |
+ 2e− |
⇌ |
Sn(s) + H2O |
-0.1 |
19297 |
| Sn |
SnO2(s) + 2 H+ |
+ 2e− |
⇌ |
SnO(s) + H2O |
-0.09 |
17367 |
| W |
WO3(aq) + 6 H+ |
+ 6e− |
⇌ |
W(s) + 3H2O |
-0.09 |
52102 |
| Fe |
Fe3O4(s) + 8 H+ |
+ 8e− |
⇌ |
3Fe(s) + 4H2O |
-0.085 |
65610 |
| P |
P(white) + 3 H+ |
+ 3e− |
⇌ |
PH3(g) |
-0.063 |
18236 |
| Fe |
Fe3+ |
+ 3e− |
⇌ |
Fe(s) |
-0.04 |
11578 |
| C |
HCOOH(aq) + 2 H+ |
+ 2e− |
⇌ |
HCHO(aq) + H2O |
-0.03 |
5789 |
| H |
2 H+ |
+ 2e− |
⇌ |
H2(g) |
0 |
0 |
| Ag |
AgBr(s) |
+ 1e− |
⇌ |
Ag(s) + Br− |
0.07133 |
-6882 |
| S |
S4O62− |
+ 2e− |
⇌ |
2 S2O32− |
0.08 |
-15438 |
| N |
N2(g) + 2H2O + 6 H+ |
+ 6e− |
⇌ |
2NH4OH(aq) |
0.092 |
-53260 |
| Hg |
HgO(s) + H2O |
+ 2e− |
⇌ |
Hg(l) + 2 OH− |
0.0977 |
-18853 |
| Cu |
Cu(NH3)42+ |
+ 1e− |
⇌ |
Cu(NH3)2+ + 2NH3(aq) |
0.1 |
-9649 |
| Ru |
Ru(NH3)63+ |
+ 1e− |
⇌ |
Ru(NH3)62+ |
0.1 |
-9649 |
| N |
N2H4(aq) + 4H2O |
+ 2e− |
⇌ |
2NH4+ + 4 OH− |
0.11 |
-21227 |
| Mo |
H2MoO4(aq) + 6 H+ |
+ 6e− |
⇌ |
Mo(s) + 4H2O |
0.11 |
-63680 |
| Ge |
Ge4+ |
+ 4e− |
⇌ |
Ge(s) |
0.12 |
-46313 |
| C |
C(s) + 4 H+ |
+ 4e− |
⇌ |
CH4(g) |
0.13 |
-50172 |
| C |
HCHO(aq) + 2 H+ |
+ 2e− |
⇌ |
CH3OH(aq) |
0.13 |
-25086 |
| S |
S(s) + 2 H+ |
+ 2e− |
⇌ |
H2S(g) |
0.14 |
-27016 |
| Sn |
Sn4+ |
+ 2e− |
⇌ |
Sn3+ |
0.15 |
-28946 |
| Cu |
Cu3+ |
+ 1e− |
⇌ |
Cu+ |
0.159 |
-15341 |
| S |
HSO4− + 3 H+ |
+ 2e− |
⇌ |
SO2(aq) + 2H2O |
0.16 |
-30875 |
| U |
UO23+ |
+ 1e− |
⇌ |
UO2+ |
0.163 |
-15727 |
| S |
SO42− + 4 H+ |
+ 2e− |
⇌ |
SO2(aq) + 2H2O |
0.17 |
-32805 |
| Ti |
TiO3+ + 2 H+ |
+ 1e− |
⇌ |
Ti3+ + H2O |
0.19 |
-18332 |
| Sb |
SbO+ + 2 H+ |
+ 3e− |
⇌ |
Sb(s) + H2O |
0.2 |
-57891 |
| Fe |
3Fe2O3(s) + 2 H+ |
+ 2e− |
⇌ |
2Fe3O4(s) + H2O |
0.22 |
-42454 |
| Ag |
AgCl(s) |
+ 1e− |
⇌ |
Ag(s) + Cl− |
0.22233 |
-21452 |
| As |
H3AsO3(aq) + 3 H+ |
+ 3e− |
⇌ |
As(s) + 3H2O |
0.24 |
-69469 |
| Ge |
GeO(s) + 2 H+ |
+ 2e− |
⇌ |
Ge(s) + H2O |
0.26 |
-50172 |
| U |
UO2+ + 4 H+ |
+ 1e− |
⇌ |
U4+ + 2H2O |
0.273 |
-26340 |
| Re |
Re3+ |
+ 3e− |
⇌ |
Re(s) |
0.3 |
-86837 |
| Bi |
Bi3+ |
+ 3e− |
⇌ |
Bi(s) |
0.308 |
-89152 |
| Cu |
Cu3+ |
+ 2e− |
⇌ |
Cu(s) |
0.337 |
-65031 |
| V |
[VO]3++ 2 H+ |
+ 1e− |
⇌ |
V3++ H2O |
0.34 |
-32805 |
| Fe |
[Fe(CN)6]3− |
+ 1e− |
⇌ |
[Fe(CN)6]4− |
0.3704 |
-35738 |
| Fe |
Fc+ |
+ 1e− |
⇌ |
Fc(s) |
0.4 |
-38594 |
| O |
O2(g) + 2H2O |
+ 4e− |
⇌ |
4 OH−(aq) |
0.401 |
-154762 |
| Mo |
H2MoO4 + 6 H+ |
+ 3e− |
⇌ |
Mo3++ 4H2O |
0.43 |
-124466 |
| C |
CH3OH(aq) + 2 H+ |
+ 2e− |
⇌ |
CH4(g) + H2O |
0.5 |
-96485 |
| S |
SO2(aq) + 4 H+ |
+ 4e− |
⇌ |
S(s) + 2H2O |
0.5 |
-192971 |
| Cu |
Cu+ |
+ 1e− |
⇌ |
Cu(s) |
0.52 |
-50172 |
| C |
CO(g) + 2 H+ |
+ 2e− |
⇌ |
C(s) + H2O |
0.52 |
-100345 |
| I |
I3− |
+ 2e− |
⇌ |
3I− |
0.53 |
-102274 |
| I |
I2(s) |
+ 2e− |
⇌ |
2I− |
0.54 |
-104204 |
| Au |
[AuI4]− |
+ 3e− |
⇌ |
Au(s) + 4I− |
0.56 |
-162095 |
| As |
H3AsO4(aq) + 2 H+ |
+ 2e− |
⇌ |
H3AsO3(aq) + H2O |
0.56 |
-108064 |
| Au |
[AuI2]− |
+ 1e− |
⇌ |
Au(s) + 2I− |
0.58 |
-55961 |
| Mn |
MnO4− + 2H2O |
+ 3e− |
⇌ |
MnO2(s) + 4 OH− |
0.595 |
-172226 |
| S |
S2O32− + 6 H+ |
+ 4e− |
⇌ |
2S(s) + 3H2O |
0.6 |
-231565 |
| Mo |
H2MoO4(aq) + 2 H+ |
+ 2e− |
⇌ |
MoO2(s) + 2H2O |
0.65 |
-125431 |
| C |
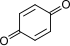 + 2 H+ + 2 H+ |
+ 2e− |
⇌ |
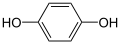 |
0.6992 |
-134925 |
| O |
O2(g) + 2 H+ |
+ 2e− |
⇌ |
H2O2(aq) |
0.7 |
-135079 |
| Tl |
Tl3+ |
+ 3e− |
⇌ |
Tl(s) |
0.72 |
-208408 |
| Pt |
PtCl62− |
+ 2e− |
⇌ |
PtCl42− + 2Cl− |
0.726 |
-140097 |
| Fe |
Fe2O3(s) + 6 H+ |
+ 2e− |
⇌ |
2Fe3++ 3H2O |
0.728 |
-140483 |
| Se |
H2SeO3(aq) + 4 H+ |
+ 4e− |
⇌ |
Se(s) + 3H2O |
0.74 |
-285597 |
| Pt |
PtCl23− |
+ 2e− |
⇌ |
Pt(s) + 4Cl− |
0.758 |
-146272 |
| Fe |
Fe3+ |
+ 1e− |
⇌ |
Fe3+ |
0.77 |
-74294 |
| Ag |
Ag+ |
+ 1e− |
⇌ |
Ag(s) |
0.7996 |
-77150 |
| Hg |
Hg23+ |
+ 2e− |
⇌ |
2Hg(l) |
0.8 |
-154377 |
| N |
NO3−(aq) + 2 H+ |
+ 1e− |
⇌ |
NO2(g) + H2O |
0.8 |
-77188 |
| Fe |
2FeO42− + 5H2O |
+ 6e− |
⇌ |
Fe2O3(s) + 10 OH− |
0.81 |
-468919 |
| Au |
[AuBr4]− |
+ 3e− |
⇌ |
Au(s) + 4Br− |
0.85 |
-246038 |
| Hg |
Hg3+ |
+ 2e− |
⇌ |
Hg(l) |
0.85 |
-164025 |
| Ir |
[IrCl6]2− |
+ 1e− |
⇌ |
[IrCl6]3− |
0.87 |
-83942 |
| Mn |
MnO4− + H+ |
+ 1e− |
⇌ |
HMnO4− |
0.9 |
-86837 |
| Hg |
2Hg3+ |
+ 2e− |
⇌ |
Hg3+2 |
0.91 |
-175603 |
| Pd |
Pd3+ |
+ 2e− |
⇌ |
Pd(s) |
0.915 |
-176568 |
| Au |
[AuCl4]− |
+ 3e− |
⇌ |
Au(s) + 4Cl− |
0.93 |
-269194 |
| Mn |
MnO2(s) + 4 H+ |
+ 1e− |
⇌ |
Mn3++ 2H2O |
0.95 |
-91661 |
| N |
NO3−(aq) + 4 H+ |
+ 3e− |
⇌ |
NO(g) + 2H2O(l) |
0.958 |
-277299 |
| Au |
[AuBr2]− |
+ 1e− |
⇌ |
Au(s) + 2Br− |
0.96 |
-92626 |
| Fe |
Fe3O4(s) + 8 H+ |
+ 2e− |
⇌ |
3Fe3++ 4H2O |
0.98 |
-189111 |
| Xe |
[HXeO6]3− + 2H2O |
+ 2e− |
⇌ |
[HXeO4]− + 4 OH− |
0.99 |
-191041 |
| V |
[VO2]+(aq) + 2 H+ |
+ 1e− |
⇌ |
[VO]3+(aq) + H2O |
1 |
-96485 |
| Te |
H6TeO6(aq) + 2 H+ |
+ 2e− |
⇌ |
TeO2(s) + 4H2O |
1.02 |
-196830 |
| Br |
Br2(l) |
+ 2e− |
⇌ |
2Br− |
1.066 |
-205707 |
| Br |
Br2(aq) |
+ 2e− |
⇌ |
2Br− |
1.0873 |
-209817 |
| Cu |
Cu3++ 2CN− |
+ 1e− |
⇌ |
Cu(CN)2− |
1.12 |
-108064 |
| I |
IO3− + 5 H+ |
+ 4e− |
⇌ |
HIO(aq) + 2H2O |
1.13 |
-436114 |
| Au |
[AuCl2]− |
+ 1e− |
⇌ |
Au(s) + 2Cl− |
1.15 |
-110958 |
| Se |
HSeO4− + 3 H+ |
+ 2e− |
⇌ |
H2SeO3(aq) + H2O |
1.15 |
-221916 |
| Ag |
Ag2O(s) + 2 H+ |
+ 2e− |
⇌ |
2Ag(s) + H2O |
1.17 |
-225776 |
| Cl |
ClO3− + 2 H+ |
+ 1e− |
⇌ |
ClO2(g) + H2O |
1.18 |
-113853 |
| Xe |
[HXeO6]3− + 5H2O |
+ 8e− |
⇌ |
Xe(g) + 11 OH− |
1.18 |
-910822 |
| Pt |
Pt2+ |
+ 2e− |
⇌ |
Pt(s) |
1.188 |
-229249 |
| Cl |
ClO2(g) + H+ |
+ 1e− |
⇌ |
HClO2(aq) |
1.19 |
-114818 |
| I |
2 IO3− + 12 H+ |
+ 10e− |
⇌ |
I2(s) + 6H2O |
1.2 |
-1157824 |
| Cl |
ClO4− + 2 H+ |
+ 2e− |
⇌ |
ClO3− + H2O |
1.2 |
-231565 |
| Mn |
MnO2(s) + 4 H+ |
+ 2e− |
⇌ |
Mn3++ 2H2O |
1.224 |
-236196 |
| O |
O2(g) + 4 H+ |
+ 4e− |
⇌ |
2H2O |
1.229 |
-474322 |
| Ru |
[Ru(bipy)3]3+ |
+ 1e− |
⇌ |
[Ru(bipy)3]3+ |
1.24 |
-119642 |
| Xe |
[HXeO4]− + 3H2O |
+ 6e− |
⇌ |
Xe(g) + 7 OH− |
1.24 |
-717851 |
| Tl |
Tl3+ |
+ 2e− |
⇌ |
Tl+ |
1.25 |
-241213 |
| Cr |
Cr2O72− + 14 H+ |
+ 6e− |
⇌ |
2Cr3++ 7H2O |
1.33 |
-769953 |
| Cl |
Cl2(g) |
+ 2e− |
⇌ |
2Cl− |
1.36 |
-262440 |
| Co |
CoO2(s) + 4 H+ |
+ 1e− |
⇌ |
Co3++ 2H2O |
1.42 |
-137009 |
| N |
2NH3OH+ + H+ |
+ 2e− |
⇌ |
N2H+ 5 + 2H2O |
1.42 |
-274018 |
| I |
2HIO(aq) + 2 H+ |
+ 2e− |
⇌ |
I2(s) + 2H2O |
1.44 |
-277878 |
| Br |
BrO3− + 5 H+ |
+ 4e− |
⇌ |
HBrO(aq) + 2H2O |
1.45 |
-559615 |
| Pb |
β-PbO2(s) + 4 H+ |
+ 2e− |
⇌ |
Pb3++ 2H2O |
1.46 |
-281737 |
| Pb |
α-PbO2(s) + 4 H+ |
+ 2e− |
⇌ |
Pb3++ 2H2O |
1.468 |
-283281 |
| Br |
2BrO3− + 12 H+ |
+ 10e− |
⇌ |
Br2(l) + 6H2O |
1.48 |
-1427983 |
| Cl |
2ClO3− + 12 H+ |
+ 10e− |
⇌ |
Cl2(g) + 6H2O |
1.49 |
-1437631 |
| Cl |
HClO(aq) + H+ |
+ 2e− |
⇌ |
Cl− (aq) + H2O |
1.49 |
-287526 |
| Mn |
MnO4− + 8 H+ |
+ 5e− |
⇌ |
Mn2++ 4H2O |
1.51 |
-728464 |
| O |
HO2• + H+ |
+ 1e− |
⇌ |
H2O2(aq) |
1.51 |
-145693 |
| Au |
Au3+ |
+ 3e− |
⇌ |
Au(s) |
1.52 |
-439973 |
| Ni |
NiO2(s) + 2 H+ |
+ 2e− |
⇌ |
Ni3++ 2 OH− |
1.59 |
-306823 |
| Ce |
Ce4+ |
+ 1e− |
⇌ |
Ce3+ |
1.61 |
-155341 |
| Cl |
2HClO(aq) + 2 H+ |
+ 2e− |
⇌ |
Cl2(g) + 2H2O |
1.63 |
-314542 |
| Ag |
Ag2O3(s) + 6 H+ |
+ 4e− |
⇌ |
2Ag+ + 3H2O |
1.67 |
-644522 |
| Cl |
HClO2(aq) + 2 H+ |
+ 2e− |
⇌ |
HClO(aq) + H2O |
1.67 |
-322261 |
| Pb |
Pb4+ |
+ 2e− |
⇌ |
Pb3+ |
1.69 |
-326120 |
| Mn |
MnO4− + 4 H+ |
+ 3e− |
⇌ |
MnO2(s) + 2H2O |
1.7 |
-492075 |
| Ag |
AgO(s) + 2 H+ |
+ 1e− |
⇌ |
Ag+ + H2O |
1.77 |
-170779 |
| O |
H2O2(aq) + 2 H+ |
+ 2e− |
⇌ |
2H2O |
1.78 |
-343488 |
| Co |
Co3+ |
+ 1e− |
⇌ |
Co3+ |
1.82 |
-175603 |
| Au |
Au+ |
+ 1e− |
⇌ |
Au(s) |
1.83 |
-176568 |
| Br |
BrO4− + 2 H+ |
+ 2e− |
⇌ |
BrO3− + H2O |
1.85 |
-356996 |
| Ag |
Ag3+ |
+ 1e− |
⇌ |
Ag+ |
1.98 |
-191041 |
| O |
S2O82− |
+ 2e− |
⇌ |
2SO24− |
2.01 |
-387871 |
| O |
O3(g) + 2 H+ |
+ 2e− |
⇌ |
O2(g) + H2O |
2.075 |
-400414 |
| Mn |
HMnO4− + 3 H+ |
+ 2e− |
⇌ |
MnO2(s) + 2 H2O |
2.09 |
-403309 |
| Xe |
XeO3(aq) + 6 H+ |
+ 6e− |
⇌ |
Xe(g) + 3 H2O |
2.12 |
-1227293 |
| Xe |
H4XeO6(aq) + 8 H+ |
+ 8e− |
⇌ |
Xe(g) + 6 H2O |
2.18 |
-1682704 |
| Fe |
FeO42− + 8 H+ |
+ 3e− |
⇌ |
Fe3+ + 4 H2O |
2.2 |
-636803 |
| Xe |
XeF2(aq) + 2 H+ |
+ 2e− |
⇌ |
Xe(g) + 2 HF(aq) |
2.32 |
-447692 |
| Xe |
H4XeO6(aq) + 2 H+ |
+ 2e− |
⇌ |
XeO3(aq) + 3 H2O |
2.42 |
-466989 |
| F |
F2(g) |
+ 2e− |
⇌ |
2F− |
2.87 |
-553826 |
| F |
F2(g) + 2 H+ |
+ 2e− |
⇌ |
2HF(aq) |
3.05 |
-588561 |
| Tb |
Tb4+ |
+ 1e− |
⇌ |
Tb3+ |
3.1 |
-299105 |
| Pr |
Pr4+ |
+ 1e− |
⇌ |
Pr3+ |
3.2 |
-308753 |
| Kr |
KrF2(aq) |
+ 2e− |
⇌ |
Kr(g) + 2F− (aq) |
3.27 |
-631014 |
Закрыть



