Silicijev dioksid
From Wikipedia, the free encyclopedia
Remove ads
Silicijev dioksid, kremen ali kvarc je skupno ime različnih oblik silicijevega oksida s kemijsko formulo SiO2. V naravi se najpogosteje pojavlja kot bolj ali manj čist kremenčev pesek, v kristalni obliki kot kamena strela in v celičnih stenah kremenčevih alg.[1][2]
Imeni kremen in kvarc sta nastali iz starih rudarskih imen. Češki rudarji so pred več stoletji trde jalove žile imenovali křem, rudarji na Saškem pa so enake žile imenovali quertz.[3]
Številni različki silicijevega dioksida so posledica prisotnosti drugih atomov v strukturi, manjših vključkov drugih mineralov ali naravne radioaktivnosti. Vijoličnemu kremenu ametistu daje barvo majhna primes ionov Fe3+, rumenemu citrinu primesi železovih hidratov, najrazličnejši sivi do rjavi čadavci in črn morijon so obarvani zaradi radioaktivnega sevanja, rožnati roževec zaradi majhne primesi titana, mlečno beli mlekovec pa zaradi vključkov tekočine in plinov. Kremen z vključki azbesta se imenuje mačje oko, okremeneli krokidolit tigrovo oko, rutilov kremen vsebuje igličaste kristale rutila, turmalinov kremen podolgovate kristale turmalinov, avanturin vključke zelene sljude ali hematita, prazem pa vključke aktinolita.[3]
Uporablja se predvsem za proizvodnjo okenskega stekla, kuhinjske, embalažne in laboratorijske steklovine, penjenega betona, portlandskega cementa, keramike, optičnih vlaken, nakita in drugih proizvodov.
Remove ads
Kristalna struktura

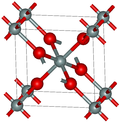
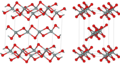
Velika večina silikatov je zgrajena iz tetraedrov [SiO4], ki so termodinamsko najbolj stabilna oblika SiO2. Silicijev atom je vgrajen v središču tetraedra, na njegovih ogliščih pa so štirje kisikovimi atomi. Osnovni tetraedri se lahko med seboj povezujejo v nitaste, ploskovne ali prostorske strukture.

V osnovni celici α-kremena na primer centralni tetraeder deli s sosedi vse svoje štiri kisikove atome, dva ploskovno centrirana tetraedra delita po dva svoja vogalna kisikova atoma, štirje robovno centrirani tetraedri pa samo po en kisikov atom. To pomeni, da ima osnovna celica α-kremena 12 od 24 skupnih oglišč 7 tetraedrov [SiO4].( glej 3-D prikaz osnovne celice ).
SiO2 ima poleg amorfne oblike tudi veliko različnih kristalnih oblik – polimorfov. Vsi polimorfi, razen stishovita in vlaknatega silicijevega dioksida, so zgrajeni iz tetraedrov [SiO4], ki so na različne načine povezavi preko vrhov tetraedra. Dolžina vezi silicij-kisik je odvisna od kristalne strukture: v α-kremenu meri 161 pm, v α-tridimitu pa od 154 do 171 pm. Spreminja se tudi kót O-Si-O: najmanjši je v α-tridimitu, v katerem meri 140°, največji pa v β-tridimitu, v katerem meri do 180°. V α-kremenu meri kot 144°.[5]
Vlaknati SiO2 ima podobno strukturo kot SiS2, v kateri se verige stikajo preko robov tetraedrov. Stishovit, ki je obstojen pri večjih tlakih, ima v nasprotju z njimi strukturo rutila, v kateri ima silicij koordinacijsko število 6. Gostota stishovita je 4,287 g/cm3 in je precej višja od gostote α-kremena (2,648 g/cm3), ki je najgostejša oblika SiO2, obstojna pri nizkih tlakih.[6] Razliko v gostoti se lahko pripiše povečanju koordonacijskega števila s 4 na 6, saj so dolžine vezi v stishovitu (štiri vezi Si-O merijo 161 pm, dve pa 181 pm) večje kot v α-kremenu (161 pm).[7] Sprememba koordinacijskega števila poveča tudi ionske lastnosti vezi Si-O.[8] Še bolj pomembna je ugotovitev, da vsako odstopanje od teh standardnih parametrov povzroči mikrostrukturne razlike oziroma spremembe, ki pomenijo premik k amorfni, steklasti ali stekleni trdnini.
Pri normalnih pogojih je edina stabilna oblika SiO2 α-kremen. Naravni SiO2 je pogosto onečiščen in zato različno obarvan.
Oba minerala, ki sta obstojna pri visokih temperaturah, kristobalit in tridimit, imata manjšo gostoto in lomni količnik kot kamena strela. Ker je kemijska sestava vseh polimorfov enaka, je razlika v gostoti lahko posledica samo povečanja razdalj med atomi v visokotemperaturnih mineralih. Pojav je pogost tudi v mnogih drugih snoveh, ker so atomi zaradi večjih vibracijskih energij pri višjih temperaturah bolj oddaljeni drug od drugega.
Visokotlačni minerali seifertit, stishovit in koezit na drugi strani imajo v primerjavi z α-kremenom višje gostote in lomne in količnike, kar je verjetno posledica večje zgoščenosti atomov oziroma kristalne strukture, do katere pride med njihovim nastajanjem.
Ena od oblik kristaliničnega SiO2 je faujazit, ki nastane z dealuminacijo ultra stabilnega zeolita Y z majhno vsebnostjo natrija s kombinirano kislinsko in termično obdelavo. Nastali produkt vsebuje preko 99% visoko kristaliničnega SiO2 in ima zelo veliko specifično površino (preko 800 m2/g). Faujazitski SiO2 ima zelo visoko kislinsko in termično obstojnost, saj obdrži visoko stopnjo kristaliničnosti celo pri kuhanju v koncentrirani klorovodikovi kislini.[9]
Talina SiO2 ima nekaj nenavadnih fizikalnih lastnosti, ki so podobne lastnostim tekoče vode: negativni temperaturni razteznostni koeficient, maksimum gostote in minimum specifične toplote.[10]
Če se molekularni silicijev monoksid (SiO) kondenzira v atmosferi argona in ohladi s helijem in kisikovimi atomi, ki nastajajo z mikrovalovno razelektritvijo, nastane molekularni SiO2 z linearno strukturo. V reakciji izoliranega dimernega silicijevega monoksida (Si2O2) s kisikom nastane dimerni (SiO2)2. V dimernem silicijevem dioksidu je eden od kisikovih atomov vgrajen med silicijeva atoma. Kót Si-O-Si meri 94°, dolžina vezi pa 164,6 pm. Dolžina vezi v končnem Si-O je 150,2 pm. Dolžina vez Si-O v skupini -SiO2 na drugi strani molekule je 148,3 pm, kar je nekaj manj kot v α–kremenu, kjer meri 161 pm. Energija vezi je ocenjena na 621,7 kJ/mol.[11]
Remove ads
Kremenčevo steklo

Če se talina silicijevega dioskida ohladi dovolj hitro, ne kristalizira, ampak se strdi kot steklo. Teperatura steklastega prehoda čistega SiO2 je okrog 1600 K (1330 °C). Lokalna atomska zgradba čistega kremenčevega stekla je enaka kot v večini drugih kristaliničnih polimorfov in ima obliko tetraedra. Razlika med steklom in kristali je v povezavi teh tetraedrskih enot. V kremenčevem steklu tetraedri ne tvorijo ponovljive mreže, vsi kisikovi atomi pa povezujejo samo po dva sosednja tetraedra. Čeprav struktura stekla na večjih razdaljah ni ponovljiva, je kljub temu značilno urejena na razdaljah, ki daleč presegajo dolžino vezi. Primer takšne ureditve je tvorjenje obročev, sesavljenih iz šestih tetraedrov [SiO4].[28]
Remove ads
Kemija


Silicijev dioksid nastaja v reakciji silicija s kisikom. Pri sobnih pogojih nastaja na zraku na površini silicija približno 1 nm debela plast tako imenovanega nativnega oksida. Pri višjih temperaturah in v drugih okoljih lahko nastane kontrolirano debel sloj silicijevega oksida. Pri temperaturah med 600 in 1200 °C na primer potekata tako imenovani suha ali mokra oksidacija s kisikom oziroma vodo.[29] Debelina silicija, ki se pretvori v oksid, je približno 44% debeline sloja nastalega oksida.[29]
Za nanašanje sloja silicijevega oksida obstajajo tudi druge metode, med njimi:[30]
- Nizkotemperaturna oksidacija silana:
- SiH4 + 2 O2 → SiO2 + 2 H2O.
- Razgradnja tetraetil ortosilikata (TEOS) pri 680–730 °C:
- Si(OC2H5)4 → SiO2 + 2 H2O + 4 C2H4.
- Naparevanje TEOS pri približno 400 °C s pomočjo plazme:
- Si(OC2H5)4 + 12 O2 → SiO2 + 10 H2O + 8 CO2
- Polimerizacija tetraetil ortosilikata pri temperaturi pod 100 °C z uporabo amino kislin kot katalizatorjev.[31]
Pirogeni silicijev dioksid ali "kremenčev dim" je zelo finozrnata oblika SiO2, ki se pripravlja z zgorevanjem SiCl4 v s kisikom bogatem plamenu ogljikovodika:[6]
- SiCl4 + 2 H2 + O2 → SiO2 + 4 HCl
Amorfni silicijev dioksid, silikagel, nastaja z nakisanjem raztopine natrijevega silikata, pri čemer nastane želatinasta oborina, ki se nato spere in dehidrira. Nastali produkt je brezbarven mikroporozen silicijev dioksid.[6]
Silicijev dioksid ima največjo topnost v vodi pri temperaturah okrog 340 °C.[32] To lastnost se izkorišča za rast monokristalov kremena v hidrotermalnem procesu, v katerem se naravni kremen raztopi v pregreti vodi v tlačni posodi, ki je na vrhu nekoliko hladnejša. Na ta način lahko v 1-2 mesecih zrastejo kristali z maso 1,5 – 1 kg.[5] Monokristali so vir zelo čistega silicijevega dioksida za elektronsko industrijo.[6]
V reakciji silicijevega dioksida s fluorom nastaneta SiF4 in O2. Drugi halogeni (Cl2, Br2, I2) so mnogo manj reaktivni:[6]
Silicijev dioksid reagira s fluorovodikovo kislino (HF), pri čemer nastaja heksaflourosilicijeva kislina:[5]
- SiO2 + 6 HF → H2SiF6 + 2 H2O
HF se uporablja za odstranjevanje ali jedkanje silicijevega dioksida v industriji polprevodnikov.
Silicijev dioksid se raztaplja v vročih koncentriranih alkalijah in talinah hidroksidov:[6]
- SiO2 + 2 NaOH → Na2SiO3 + H2O
Silicijev dioksid reagira z bazičnimi kovinskimi oksidi na primer z Na2O, K2O, PbO, ZnO ali zmesmi oksidov in tvori silikate in stekla.[5] V reakciji z Na2O na primer lahko nastanejo natrijev ortosilikat, natrijev silikat in stekla, odvisno od razmerja reaktantov:[6]
- 2 Na2O + SiO2 → Na4SiO4
- Na2O + SiO2 → Na2SiO3
- (0,25–0,8) Na2O + SiO2 → steklo
Gospodarsko pomembna so na primer natrijevo (okensko) steklo, borosilikatno steklo (ognjeodporna in laboratorijska posoda) in svinčevo steklo (brušeno in nebrušeno kristalno steklo).
V reakciji silicijevega dioksida s silicijem pri visokih remperaturah nastaja silicijev monoksid:
- SiO2 + Si → 2 SiO (plin)
Remove ads
Biološki silicijev dioksid
Silicijev dioksid je v biološkem svetu precej pogost. Pojavlja se v bakterijah, enoceličnih organizmih, rastlinah in živalih (nevretenčarjih in vretenčarjih). V teh okoljih ima mineral pogosto izjemne fizikalne lastnosti, na primer trdnost, trdoto in žilavost. V živih organizmih mineral kristalizira iz nenasičenih in nevtralnih raztopin pri nizkih temperaturah 0 – 40 °C. Nastajanje minerala poteka v celičnih stenah organizma ali izven njih v specifičnih kemijskih reakcijah, v katere so vključene maščobe, beljakovine in ogljikovi hidrati.
Remove ads
Vpliv na zdravje

Vdihavanje fino uprašenega kristaliničnega silicijevega dioksida tudi v zelo majhnih količinah (maksimalna dopustna koncentracija na delovnem mestu je 0,15 mg/m3 [33]) sčasoma povzroči silikozo, bronhitis ali raka, ker se prah odlaga v pljučih, jih stalno draži in zmanjšuje njihovo kapaciteto. Silicijev dioksid se v pljučih ne raztopi ali kako drugače izloči, zato pomeni potencialno nevarnost predvsem za rudarje, delavce v industriji šamota, stekla in cementa, livarstvu itd. Amorfnega silicijevega dioksida, na primer pirogenega, ne štejejo med povzročitelje silikoze,[34] čeprav lahko v nekaterih primerih tudi on povzroči neozdravljive poškodbe pljuč.[35] Zakonske omejitve izpostavljenosti kremenčevemu prahu glede silikoze ne delajo med kristaliničnim in amorfnim silicijevim dioksidom nobenih razlik.
Silicijev dioksid je v vseh drugih pogledih inerten in neškodljiv. Pri zaužitju ni strupen, ne sprošča nobenih škodljivih plinov, je netopen, neprebavljiv in nima nobene hranilne vrednosti.
Preučevanje vpliva povečane vsebnosti silicijevega dioksida v pitni vodi je po petnajstih letih pokazalo, da verjetno zmanjšuje nevarnost demence. Študija je odkrila, da se s povečanjem zaužitja silicijevega dioksida v pitni vodi za 10 mg/dan nevarnost demence zmanjša za 11%.[36]
Remove ads
Sklici
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads