Nitrometan
From Wikipedia, the free encyclopedia
Remove ads
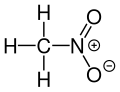
Nitrometan, ponekad skraćen jednostavno na „nitro”, je organsko jedinjenje sa hemijskom formulom CH
3NO
2, koje sadrži 1 atom ugljenika i ima molekulsku masu od 61,040 . To je najjednostavnije organsko nitro jedinjenje. To je polarna tečnost koja se obično koristi kao rastvarač u raznim industrijskim primenama kao što su ekstrakcije, kao reakcioni medijum i kao rastvarač za čišćenje. Kao intermedijer u organskoj sintezi, široko se koristi u proizvodnji pesticida, eksploziva, vlakana i premaza.[14] Nitrometan se koristi kao dodatak gorivu u raznim motosportovima i hobijima, na primer u Top Fuel drag trkama i minijaturnim motorima sa unutrašnjim sagorevanjem u radio-kontrolisanim, kontrolnim linijama i slobodnim letovima modela aviona.
Remove ads
Priprema
Nitrometan se industrijski proizvodi kombinovanjem propana i azotne kiseline u gasnoj fazi na 350—450 °C (662—842 °F; 623—723 K). Ova egzotermna reakcija proizvodi četiri industrijski značajna nitroalkana: nitrometan, nitroetan, 1-nitropropan i 2-nitropropan. Reakcija uključuje slobodne radikale, uključujući alkoksi radikale tipa CH3CH2CH2O, koji nastaju putem homolize odgovarajućeg nitritnog estera. Ovi alkoksi radikali su podložni reakcijama fragmentacije C—C veze, što objašnjava formiranje mešavine proizvoda.[14]
Laboratorijske metode
Može se pripremiti i drugim metodama koje su od instruktivne vrednosti. Reakcija natrijum-hloroacetata sa natrijum-nitritom u vodenom rastvoru proizvodi ovo jedinjenje:[15]
Remove ads
Osobine
Upotrebe
Dominantna upotreba nitrometana je kao prekursorskog reagensa. Glavni derivat je hloropikrin (CCl
3NO
2), široko korišćen pesticid. Kondenzuje se sa formaldehidom (Henrijeva reakcija) da bi na kraju dao tris(hidroksimetil)aminometan ("tris"), široko korišćen pufer i sastojak alkidnih smola.[14]
Rastvarač i stabilizator
Glavna primena je kao stabilizator u hlorisanim rastvaračima. Kao organski rastvarač, nitrometan ima neobičnu kombinaciju svojstava: visoko polaran (εr = 36 at 20 °C and μ = 3.5 Debye) ali aprotičan i slabo bazan. Ova kombinacija ga čini korisnim za rastvaranje pozitivno naelektrisanih, jako elektrofilnih vrsta. To je rastvarač za akrilatne monomere, kao što su cianoakrilati (poznatiji kao "super-lepkovi").[14]
Gorivo
Iako je manja primena u smislu obima,[14] nitrometan se takođe koristi kao gorivo ili dodatak gorivu za sport i hobije. Za neke primene, meša se sa metanolom u trkačkim automobilima, čamcima i modelima motora.
Nitrometan se koristi kao gorivo u moto trkama, posebno u drag trkama, kao i za radio-kontrolisane modele čamaca, automobila, aviona i helikoptera. U ovom kontekstu, nitrometan se obično naziva "nitro gorivo" ili jednostavno "nitro", i glavni je sastojak goriva koje se koristi u kategoriji "Top Fuel" drag trkanja.[19]
Sadržaj kiseonika u nitrometanu omogućava mu da sagoreva sa mnogo manje atmosferskog kiseonika nego konvencionalna goriva.[20] Tokom sagorevanja nitrometana, azotni oksid (NO) je jedan od glavnih produkata emisije zajedno sa CO2 i H2O.[21] Azotni oksid doprinosi zagađenju vazduha, kiselim kišama i iscrpljivanju ozonskog omotača. Nedavne (2020) studije [22] sugerišu da je ispravna stehiometrijska jednačina za sagorevanje nitrometana:
- 4 CH3NO2 + 5 O2 → 4 CO2 + 6 H2O + 4 NO
Količina vazduha potrebna za sagorevanje 1 kg (2,2 lb) benzina je 14,7 kg (32 lb), ali je potrebno samo 1,7 kg (3,7 lb) vazduha za 1 kg nitrometana. Pošto cilindar motora može da sadrži samo ograničenu količinu vazduha pri svakom taktu, može se sagoreti 8,6 puta više nitrometana nego benzina u jednom taktu. Međutim, nitrometan ima nižu specifičnu energiju: benzin obezbeđuje oko 42–44 MJ/kg, dok nitrometan obezbeđuje samo 11,3 MJ/kg. Ova analiza pokazuje da nitrometan generiše oko 2,3 puta više snage od benzina kada se kombinuje sa datom količinom kiseonika.
Nitrometan se takođe može koristiti kao monopropelant, tj. pogonsko gorivo koje se razlaže da bi oslobodilo energiju bez dodatog kiseonika. Prvi put je testiran kao raketni monopropelant 1930-ih od strane Luidži Krokoa iz Italijanskog raketnog društva.[23][24] Postoji obnovljeno interesovanje za nitrometan kao sigurniju zamenu za hidrazinski monopropelant.[25] Sledeća jednačina opisuje ovaj proces:
- 2 CH3NO2 → 2 CO + 2 H2O + H2 + N2
Nitrometan ima brzinu laminarne sagorevanja od približno 0,5 m/s, nešto višu od benzina, što ga čini pogodnim za motore velike brzine. Takođe ima nešto višu temperaturu plamena od oko 2.400 °C (4.350 °F; 2.670 K). Visoka toplota isparavanja od 0,56 MJ/kg zajedno sa visokim protokom goriva obezbeđuje značajno hlađenje ulaznog punjenja (oko dvostruko više od metanola), što rezultira relativno niskim temperaturama.
Nitrometan se obično koristi sa bogatim smešama vazduha i goriva jer obezbeđuje snagu čak i u odsustvu atmosferskog kiseonika. Kada se koriste bogate smeše vazduha i goriva, vodonik i ugljen-monoksid su dva od produkata sagorevanja. Ovi gasovi često sagorevaju, ponekad spektakularno, dok veoma bogate smeše još uvek gorućeg goriva izlaze iz izduvnih otvora. Veoma bogate smeše su neophodne da bi se smanjila temperatura vrelih delova komore za sagorevanje kako bi se kontrolisalo preuranjeno paljenje i naknadna detonacija. Operativni detalji zavise od konkretne smeše i karakteristika motora.
Mala količina hidrazina pomešana u nitrometanu može dodatno povećati izlaznu snagu. Sa nitrometanom, hidrazin formira eksplozivnu so koja je opet monopropelant. Ova nestabilna smeša predstavlja ozbiljnu bezbednosnu opasnost. Nacionalna asocijacija hot rod trka i Akademija modelarske aeronautike ne dozvoljavaju njenu upotrebu u takmičenjima.[26]
U gorivu za modele aviona i automobila sa žarnom svećicom, primarni sastojak je uglavnom metanol sa malo nitrometana (0% do 65%, ali retko preko 30%, i 10–20% lubrikanata (obično ricinusovo ulje i/ili sintetičko ulje)). Čak i umerene količine nitrometana imaju tendenciju da povećaju snagu koju stvara motor (jer je ograničavajući faktor često unos vazduha), što čini motor lakšim za podešavanje (prilagođavanje odgovarajućeg odnosa vazduha/goriva).
Ranije upotrebe
Ranije se koristio u industriji eksploziva kao komponenta u binarnoj eksplozivnoj formulaciji sa amonijum-nitratom i u kumulativnim punjenjima, a služio je i kao hemijski stabilizator za sprečavanje razgradnje raznih halogenisanih ugljovodonika.[27]
Ostalo
Može se koristiti kao eksploziv kada se želira sa nekoliko procenata sredstva za želiranje. Ova vrsta mešavine naziva se PLX. Druge mešavine uključuju ANNM i ANNMAl – eksplozivne mešavine amonijum-nitrata, nitrometana i aluminijumskog praha.
Remove ads
Reakcije
Kiselo-bazna svojstva
Nitrometan je relativno kisela ugljenična kiselina. Ima pKa vrednost od 17,2 u DMSO rastvoru. Ova vrednost ukazuje na vodenu pKa vrednost od oko 11.[28] Tako je kiseo jer anjon omogućava alternativnu, stabilizujuću rezonantnu strukturu:

Kiselina se deprotonuje samo polako. Protonacija konjugovane baze O2NCH2−, koja je skoro izosterična sa nitratom, inicijalno se dešava na kiseoniku.[29]
Organske reakcije
U organskoj sintezi nitrometan se koristi kao građevni blok sa jednim ugljenikom.[30][31] Njegova kiselost mu omogućava da se podvrgne deprotonaciji, omogućavajući kondenzacione reakcije analogne onima kod karbonilnih jedinjenja. Tako, pod baznom katalizom, nitrometan se dodaje aldehidima u 1,2-dodavanju u nitroaldolnoj reakciji. Neki važni derivati uključuju pesticide hloropikrin (Cl3CNO2), beta-nitrostiren i tris(hidroksimetil)nitrometan, ((HOCH2)3CNO2). Redukcijom potonjeg dobija se tris(hidroksimetil)aminometan, (HOCH2)3CNH2, poznatiji kao tris, široko korišćen pufer. U specijalizovanijoj organskoj sintezi, nitrometan služi kao Majklov donor, dodajući se na α,β-nenasićena karbonilna jedinjenja putem 1,4-dodavanja u Majklovoj reakciji.
Remove ads
Pročišćavanje
Nitrometan je popularan rastvarač u organskoj i elektroanalitičkoj hemiji. Može se pročistiti hlađenjem ispod tačke smrzavanja, pranjem čvrste supstance hladnim dietil-eterom, praćeno destilacijom.[32]
Bezbednost
Nitrometan ima skromnu akutnu toksičnost. LD50 (oralno, pacovi) je 1210±322 mg/kg.[14]
Nitrometan je "razumno očekivan kao ljudski kancerogen" prema izveštaju vlade SAD.[33]
Eksplozivna svojstva
Nitrometan nije bio poznat kao visoko eksplozivno sredstvo sve dok 1. juna 1958. nije eksplodirao železnički vagon-cisterna natovaren njime.[34] Nakon mnogo testiranja, shvatilo se da je nitrometan energičniji visoko eksplozivni materijal od TNT-a, iako TNT ima veću brzinu detonacije (VoD) i brizantnost. Oba ova eksploziva su siromašna kiseonikom, a određene prednosti se postižu mešanjem sa oksidansom, kao što je amonijum-nitrat. Čisti nitrometan je neosetljiv eksploziv sa VoD od približno 6.400 m/s (21.000 ft/s), ali čak i tada mogu se koristiti inhibitori za smanjenje opasnosti. Smatralo se da je eksplozija vagona-cisterne bila uzrokovana adijabatskom kompresijom, opasnošću zajedničkom za sve tečne eksplozive. To je kada se mali zarobljeni mehurići vazduha komprimuju i pregrevaju brzim porastom pritiska. Verovalo se da je operater brzo zatvorio ventil, stvarajući nagli porast pritiska poznat kao "hammer-lock".
Ako se pomeša sa amonijum-nitratom, koji se koristi kao oksidans, formira se eksplozivna mešavina poznata kao ANNM.
Nitrometan se koristi kao model eksploziva, zajedno sa TNT-om. Ima nekoliko prednosti kao model eksploziva u odnosu na TNT, naime njegovu uniformnu gustinu i nedostatak čvrstih vrsta nakon detonacije koje komplikuju određivanje jednačine stanja i daljih proračuna.
Nitrometan reaguje sa rastvorima natrijum-hidroksida ili metoksida u alkoholu da bi se proizvela netopiva so nitrometana. Ova supstanca je osetljivi eksploziv koji se vraća u nitrometan pod kiselim uslovima i razlaže se u vodi da bi formirala još jedno eksplozivno jedinjenje, natrijum-metazonat, koji ima crvenkasto-braon boju:
- 2 CH3NO2 + NaOH → HON=CHCH=NO2Na + 2 H2O
Reakcija nitrometana sa čvrstim natrijum-hidroksidom je hipergolična.
Remove ads
Mere predostrožnosti pri upotrebi
Čist ili u visokim koncentracijama, nitrometan je eksplozivan usled zagrevanja ili kompresije. Ako je kontaminiran aminima ili ugljovodonicima, može formirati eksplozivne jedinjenja osetljive na udarce (tečni eksploziv Picatinny Liquid Explosive - PLX se dobija upravo mešanjem 95% nitrometana i 5% etilendiamina).
Posebno je opasno mešati nitrometan sa hidrazinom, jer formiraju so koja može spontano eksplodirati čak i u odsustvu kiseonika.
Od 1. marta 2016. godine, evropski propisi zabranjuju prodaju nitrometana privatnim licima jer se smatra prekursorom eksploziva.[35]
Remove ads
Vidi još
- Top Fuel
- Adijabatska temperatura izgaranja, termodinamički proračun temperature plamena nitrometana.
- Dinitrometan
- Model motora
- Trinitrometan
- Tetranitrometan
- RE factor
Reference
Navedeni izvori
Literatura
Dodatna literatura
Spoljašnje veze
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads