காட்மியம் குளோரைடு
From Wikipedia, the free encyclopedia
Remove ads
காட்மியம் குளோரைடு (Cadmium chloride) என்பது காட்மியம் மற்றும் குளோரின் என்ற இரு தனிமங்கள் இணைந்து CdCl2 என்ற மூலக்கூற்று வாய்ப்பாடுடன் உருவாகும் ஒரு வேதிச் சேர்மமாகும். நீரையுறிஞ்சும் தன்மை கொண்ட இத்திடப்பொருள் நீரில் நன்றாகவும் ஆல்ககாலில் சிறிதளவும் கரைகிறது. இச்சேர்மம் ஒரு அயனிச் சேர்மமாகக் கருதப்பட்டாலும் கணிசமான அளவுக்கு சகப் பிணைப்புப் பண்புகளையும் பெற்றுள்ளது. காட்மியம் குளோரைடின் படிகவமைப்பு இருபரிமாண அயனி அடுக்குகளால் உருவாக்கப்பட்டுள்ளது. பிற படிகவமைப்புகளை விளக்குவதற்கு ஏற்ற சரியான முன்மாதிரியாகவும் இது அமைகிறது. CdCl2.H2O மற்றும் CdCl2.5H2O என்ற இருவேறு படிகவமைப்புகளிலும் காட்மியம் குளோரைடு காணப்படுகிறது[2].
Remove ads
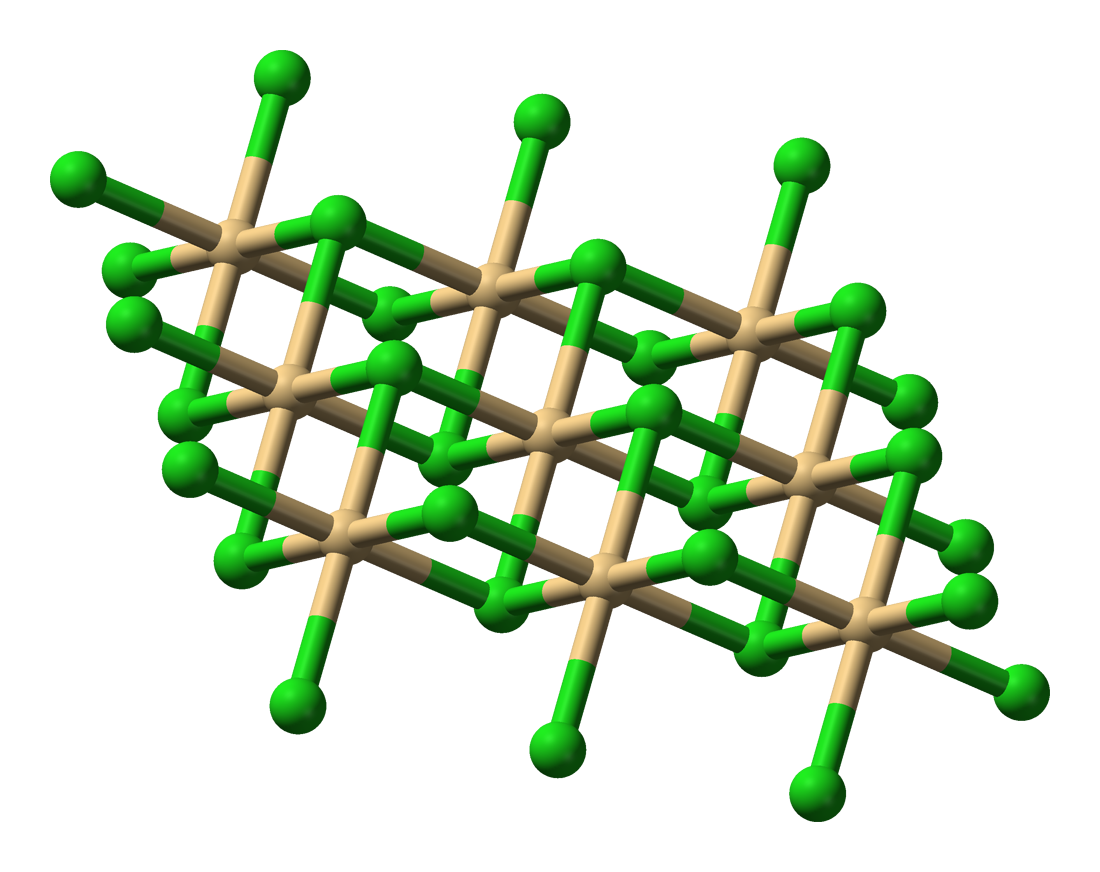
அமைப்பு
சாய்சதுரம் சார்ந்த சீரொழுங்கில் காட்மியம் குளோரைடு படிகங்களாக உருவாகிறது. காட்மியம் அயோடைடும் இதே சீரொழுங்கில் அமையப்பெற்ற படிகங்களாக உருவாகும் சேர்மமாகும். இரு சேர்மங்களிலும் உள்ள தனி அடுக்குகள் ஒரேமாதிரியாக அமைந்துள்ளன. ஆனால காட்மியம் குளோரைடில் உள்ள குளோரைடு அயனிகள் நெருக்கப் பொதிவு சமகோள அணிக்கோவைகளைக் கொண்டுள்ளன. ஆனால் காட்மியம் அயோடைடில் அயோடின் அயனிகள் அறுகோண நெருக்கப் பொதிவு அணிக்கோவைகளக அடுக்கப்பட்டுள்ளன[6][7].
Remove ads
வேதிப்பண்புகள்
தண்ணீர் மற்றும் முனைவுக் கரைப்பான்களில் காட்மியம் குளோரைடு நன்றாகக் கரைகிறது. தண்ணீரில் அவ்வாறு அதிகமாகக் கரையும் போது அணைவு அயனியான [CdCl4]2 அயனியும் உருவாகிறது. இத்தகையப் பண்பினால் காட்மியம் குளோரைடு ஒரு {[லூயி அமிலம்|மென் லூயி அமிலமாக]] உள்ளது[6]
- CdCl2 + 2 Cl− → [CdCl4]2− .
பெரிய நேர்மின் அயனிகளுடன் எனில், முக்கோண இரட்டைப்பட்டைக்கூம்பு [CdCl5]3− அயனியாகத் தனித்துப்பிரிக்க இயல்கிறது.
தயாரிப்பு
நீரற்ற குளோரின் அல்லது ஐதரசன் குளோரைடு வாயுவை காட்மியம் உலோகத்துடன் சேர்த்து சூடுபடுத்துவதன் மூலமாக நீரற்ற காட்மியம் குளோரைடைத் தயாரிக்க முடியும்.
- Cd + 2 HCl → CdCl2 + H2
நீரேற்று காட்மியம் குளோரைடைத் தயாரிக்க காட்மியத்துடன் அல்லது காட்மியம் ஆக்சைடுடன் அல்லது காட்மியம் கார்பனேட்டுடன் ஐதரோ குளோரிக் அமிலத்தைச் சேர்த்து வினைபுரியச் செய்து தயாரிக்கலாம்.
பயன்கள்
காட்மியம் சல்பைடு என்ற காட்மியம் மஞ்சள் நிறமியைத் தயாரிக்கக் காட்மியம் குளோரைடு பயன்படுகிறது. இந்நிறமி ஓர் அற்புதமான மஞ்சள் நிறத்திலான நிலையான கனிம் வேதியியல் நிறமியாகும்.
- CdCl
2 + H
2S → CdS + 2 HCl
ஆய்வகங்களில் கரிமக் காட்மியச் சேர்மங்கள் தயாரிப்பில் நீரற்ற காட்மியம் குளோரைடு பயன்படுகிறது. இவ்வகைச் சேர்மங்கள் R2Cd என்ற பொதுவமைப்பில் சேர்மங்களை உருவாக்குகின்றன. இங்கு R என்பது ஓர் அரைல் அல்லது ஒரு முதன்மை ஆல்க்கைல் குழுவாக இருக்கும். இவை அசைல் குளோரைடுகளில் இருந்து கீட்டோன்களைத் தொகுப்பு முறையில் தயாரிக்க முன்னர் பயன்படுத்தப்பட்டன.:[8]
- CdCl
2 + 2 RMgX → R
2Cd + MgCl
2 + MgX
2
- R
2Cd + R'COCl → R'COR + CdCl
2
இத்தகைய செயலிகள் பின்னர் இவற்றைவிடக் குறைவான நச்சுத்தன்மை கொண்ட கரிமச்செப்பு சேர்மங்களால் இடப்பெயர்ச்சி செய்யப்பட்டன. ஒளிநகல், சாயத்தொழில் மற்றும் மின்முலாம் பூச்சு போன்றவற்றுக்காகவும் காட்மியம் குளோரைடு பயன்படுத்தப்படுகிறது.
Remove ads
மேற்கோள்கள்
வெளி இணைப்புகள்
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads