Топ питань
Часова шкала
Чат
Перспективи
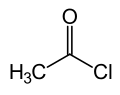
Ацетилхлорид
хімічна сполука З Вікіпедії, вільної енциклопедії
Remove ads
Ацети́лхлори́д — органічна сполука складу CH3COCl, хлороангідрид оцтової кислоти (етанової).
За звичайних умов є безбарвною рідиною, що димить на повітрі. Його присутність у повітрі при концентрації понад 0,5 мільйонних часток спричинює сльозотечу, поразнення дихальних шляхів. Вдихання випарів може спричинювати значні отруєння. Оскільки ацетилхлорид є надзвичайно реакційноздатним, він ацилює гідроксильні та аміногрупи ферментів, порушуючи їхнє нормальне функціонування. Також він є легкозаймистою речовиною (спалахує при 4 °C), що вимагає особливої обережності у його використанні та зберіганні.
Важливість ацетилхлориду вперше була описана у 1850 році. Він є ефективним агентом для ацетилювання спиртів та амінів для отримання естерів, амідів. Зокрема, його застосовують у реакції Фріделя—Крафтса при отриманні ацетофенону ацилюванням бензену. Ацетилхлорид є важливим реагентом у синтезі барвників, фармацевтичних препаратів (аспірину, парацетамолу, ацетаніліду), ацильованих полімерів.
Remove ads
Отримання
Узагальнити
Перспектива
Ацетилхлорид
Основним промисловим методом синтезу ацетилхлориду є реакція між оцтовим ангідридом та безводним хлороводнем:
В лабораторних умовах застосовуються реакції оцтової кислоти (або її солей) із сильними хлоруючими агентами на кшталт PCl3, PCl5, SOCl2:
У м'яких умовах відбувається синтез за участі трифенілфосфіну в тетрахлорометані:
Також пропонувалися методи каталітичного карбонілювання хлорометану на поверхні сполук родію, паладію, іридію. Вихід за подібними реакціями складає близько 56 %. Вони не знайшли широкого застосування.
До інших способів належать:
- реакція оцтової кислоти з хлоропохідними етилену у присутності FeCl2;
- реакція оцтової кислоти з бензилхлоридом (вихід 80 %);
- конверсія 1,1-дихлороетану (вихід 90 %);
- розкладання етилацетату під дією фосгену (не застосовується через високу вартість виробництва).
Remove ads
Хімічні властивості
Узагальнити
Перспектива
Ацетилхлорид є сильним електрофільним реагентом і проявляє сильні ацилювальні властивості.
Він легко гідролізується водою, ще легше — лугами:
Взаємодіє з різними нуклеофілами, зокрема, зі спиртами, амінами, солями карбонових кислот:
Ацетилхлорид широко застосовується при ацилюванні аренів за реакцією Фріделя—Крафтса, що веде до отримання кетонів:
Він активно відновлюється металоорганічнимим сполуками. При дії три(трет-бутоксі)алюмогідриду літію він відновлюється до етаналю:
Відоме також відновлення до альдегіду над платиновим каталізатором (реакція Розенмунда — Зайцева), однак вихід продукту є незадовільним.
З ацетилхлориду отримують й інші галогенпохідні, наприклад, ацетилфторид:
Remove ads
Див. також
Вікісховище має мультимедійні дані за темою: Ацетилхлорид
Примітки
Джерела
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads















![{\displaystyle \mathrm {CH_{3}COCl\xrightarrow {LiAl[OC(CH_{3})_{3}]_{3}} \ CH_{3}CHO} }](http://wikimedia.org/api/rest_v1/media/math/render/svg/f9ecf499c56985840f53443163f1ce8aac21b6a6)
