热门问题
时间线
聊天
视角
2019冠状病毒病疫苗
針對SARS-CoV-2新型冠狀病毒的疫苗 来自维基百科,自由的百科全书
Remove ads
2019冠状病毒病疫苗是旨在提供针对严重急性呼吸道综合征冠状病毒2型(SARS-CoV-2)的获得性免疫力的疫苗,该病毒是导致2019冠状病毒病(COVID-19)的病毒。
在COVID-19大流行之前,关于引起严重急性呼吸系统综合征(SARS)和中东呼吸系统综合征(MERS)等疾病的冠状病毒的结构和功能已经有了既定的知识体系。这些知识在2020年初加速了各种疫苗平台的开发。[1]SARS-CoV-2疫苗最初的重点是预防有症状的、往往是严重的疾病。[2]2020年1月,SARS-CoV-2基因序列数据通过GISAID共享,到2020年3月,全球制药业宣布了解决COVID-19的重大承诺。[3]2020年,第一批COVID-19疫苗被开发出来,并通过紧急授权[4]和有条件批准向公众提供。[5][6]最初,大多数COVID-19疫苗是两剂量的疫苗,唯一的例外是单剂量的强生2019冠状病毒病疫苗。[4]然而,人们发现疫苗的免疫力会随着时间的推移而减弱,需要人们接种加强剂量的疫苗以保持对COVID-19的免疫力。[4]
COVID-19疫苗在减少COVID-19的传播和降低COVID-19造成的严重程度和死亡方面的作用被广泛称赞。[4][7]根据2022年6月的一项研究,从2020年12月8日至2021年12月8日,COVID-19疫苗在185个国家和地区额外防止了1440万至1980万例死亡。[8][9]许多国家实施了分阶段分配计划,优先考虑并发症风险最高的人群,如老年人,以及暴露和传播风险高的人群,如医护人员。[10][11]
Remove ads
疫苗概况

针对数种动物的冠状病毒引发疾病的疫苗已经被研制,包括针对禽类传染性支气管炎病毒、犬冠状病毒和猫冠状病毒的疫苗[12]。
此前,针对可感染人类的冠状病毒的疫苗的研制工作,主要是针对严重急性呼吸道综合征冠状病毒(SARS)和中东呼吸综合征冠状病毒(MERS)的疫苗,也有过一定进展。SARS和MERS的疫苗已经完成了动物试验。[13][14]
截至2020年,还没有针对SARS的对人类安全有效的治疗性或保护性疫苗被研制出来[15][16]。根据2005年和2006年发表的论文,识别并研发治疗SARS的新疫苗和药物是当时世界各国政府和公共卫生机构的优先事项[17][18][19]。
同样,目前暂时没有针对MERS的经过试验的疫苗[20]。当MERS正在流行时,人们认为当时已有的对SARS的研究可能为研发针对MERS的疫苗和药物提供借鉴[15][21]。截至2020年3月,一种基于DNA的MERS疫苗已完成了人类的I期临床试验[22];另外三种基于病毒载体的MERS疫苗则正在进行临床试验,其中两种是腺病毒载体疫苗(ChAdOx1-MERS、BVRS-GamVac),另一种则是改良牛痘病毒载体疫苗(MVA-MERS-S)[23]。
截至2021年2月,66种SARS-CoV-2候选疫苗正在进行临床试验,其中17种Ⅰ期临床试验,23种Ⅰ–Ⅱ期临床试验,6种Ⅱ期临床试验和20种Ⅲ期临床试验[24]。在Ⅲ期临床试验中,几种COVID-19疫苗在预防症状性COVID-19感染的效力高达95%[25]。目前有至少18种疫苗获得至少一个政府医药监管机构的紧急批准:3种RNA疫苗(辉瑞-BioNTech疫苗、莫德纳疫苗以及沃森疫苗[26]),至少6种灭活疫苗(国药北京生物众爱可维、国药武汉生物众康可维、CoviVac、QazVac、巴拉特生物技术科瓦克辛(Covaxin)、科兴疫苗以及深圳康泰疫苗[27]),4种病毒载体疫苗(“卫星V”、牛津-阿斯利康疫苗、康希诺疫苗、强生疫苗),以及5种蛋白质亚基疫苗(安徽智飞疫苗、EpiVacCorona、阿布达拉、高端疫苗[28]、诺瓦瓦克斯疫苗[29])。截至2022年5月19日,世界卫生组织把11款疫苗列入紧急使用清单[30]:辉瑞-BioNTech疫苗、牛津-阿斯利康疫苗及该疫苗的印度版(COVISHIELD)、强生疫苗、莫德纳疫苗、众爱可维(国药北京生物)、科兴生物(CoronaVac)、科瓦克辛(Covaxin)、诺瓦瓦克斯疫苗及该疫苗的印度版科沃瓦克斯(Covovax)、克威莎疫苗。[31][32][33][34] 接种COVID-19疫苗可以大大降低SARS-CoV-2传播、感染和死亡风险。[35]
许多国家已经实施了分阶段的分配计划,优先考虑并发症风险最高的人群(例如老年人)和暴露、传播风险较高的人群(例如医护人员)[36]。根据国家卫生机构的官方报告,截至2021年1月8日,全球已施用1770万剂COVID-19疫苗[37]。国药集团估计在2021年将生产30亿剂疫苗[38],阿斯利康制药预测将生产30亿剂,辉瑞公司将生产20亿剂,而莫德纳公司计划将生产7-10亿剂[39]。印度估计在2021年能生产35亿剂新冠疫苗[40]。到2020年12月,各国已预订购了超过100亿剂疫苗[41];大约一半的疫苗由高收入国家购买,而这些国家人口仅占世界人口的14%[42]。目前,各国也在加速生产疫苗,推进群众大力接种疫苗,疫苗接种人次在逐步上升。为使疫苗在全球普及应用,世卫牵头的COVAX确保发展中国家及低收入国家都可获取基本的疫苗供应[43]。
Remove ads
背景与时间线
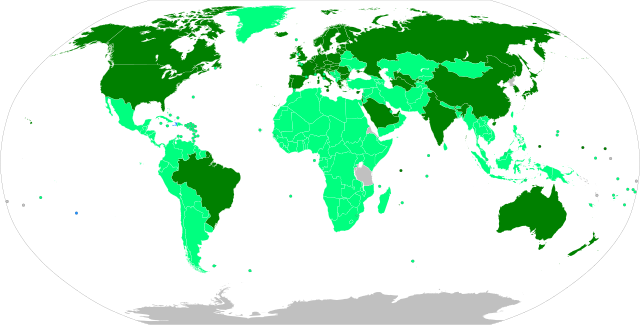
全面授权,正在进行大规模疫苗接种
紧急使用授权,正在进行大规模疫苗接种
紧急使用授权,有限的疫苗接种
全面授权,计划大规模疫苗接种
紧急使用授权,计划大规模疫苗接种
有待紧急使用授权
没有数据
2019年12月1日,由SARS-CoV-2引起的一种疾病在中华人民共和国湖北省武汉市发现,早期当局隐瞒、拖延、掩盖疫情一个月左右,并通过中国春运扩散到全中国,后于世界范围内首次被发现,随后通报国际社会,全球各国陆续检测发现此病传播已久,后来该疾病被命名为2019冠状病毒病[44]。2020年,该疾病导致的2019冠状病毒病疫情在世界各地蔓延,因应这场人类公共卫生史上百年一遇的大瘟疫,使得前所未有的大量资金和人力被用于研发针对该疾病的疫苗[45]。许多组织正在利用已经公开的基因序列研发SARS-CoV-2疫苗[46][47][48]。[何时?]大约有35家企业和学术机构参与到这一进程之中[49],其中3家,包括莫德纳[50]、Inovio Pharmaceuticals及昆士兰大学,得到了流行病防备创新联盟(CEPI)的支持[51]。根据2020年3月10日的一份报告,当时全世界有约300项正在进行的前期研究[52]。
2020年3月,美国政府、医疗行业和大学向研究人员提供了访问IBM的超级计算机以及亚马孙、微软和谷歌的云计算资源的权限。这些计算资源的提供者成立了2019冠状病毒病高性能计算联盟,其正被用于预测疾病传播、模拟可能的疫苗以及筛选数千种化合物以设计针对2019冠状病毒病的疫苗或治疗方案[53]。
2020年3月上旬,CEPI公布了20亿美元的筹资目标,以建立一个涵盖公共组织、私人组织、慈善组织和民间社会组织的全球合作伙伴关系,以加速2019冠状病毒病疫苗的研发。丹麦、芬兰、德国、挪威和英国政府承诺支持CEPI为研发2019冠状病毒病疫苗所做的努力[54]。
2020年5月18日,中华人民共和国领导人习近平应世界卫生组织总干事谭德塞邀请,在第73届世界卫生大会视频会议开幕式上发表《团结合作战胜疫情 共同构建人类卫生健康共同体》的致辞,其中提到“中国新冠疫苗研发完成并投入使用后,将作为全球公共产品”[55]。
2020年6月4日,中华人民共和国国务院总理李克强在全球疫苗峰会视像会议致辞,表示中国将继续支持世界卫生组织在统筹疫苗研发等方面发挥作用,亦愿意为全球疫苗免疫联盟提供捐助[56]。8月24日,李克强在湄公河合作第三次领导人会议上发言,称中国的疫苗研制完成并投入使用后,将优先向湄公河国家提供[57]。
2020年8月11日,俄罗斯总统普京宣布,俄罗斯完成全球第一款COVID-19疫苗[58]。但俄罗斯尚未公布候选疫苗的第Ⅰ期或第Ⅱ期临床试验结果,候选疫苗也尚未进入第Ⅲ期临床试验[59]。
2020年10月,世界卫生组织牵头实施COVAX项目,旨在于2021年底前购入20亿支COVID-19疫苗[60],并优先向发展中国家提供[61][62]。
2020年11月9日,澳大利亚开始生产由阿斯利康研发的2019冠状病毒病疫苗[63]。同日,辉瑞公司及其合作伙伴BioNTech SE(BNTX)宣布所开发的疫苗有效性超过90%[64]。11月11日,俄罗斯宣布该国研发的Sputnik V疫苗有效性达到92%[65]。11月16日,莫德纳宣布该公司研发的疫苗有效性达94.5%[66]。阿斯利康沃尔牛津大学宣布两家机构联合研发的AZD1222疫苗有效性可达90%[67]。
2020年11月,世界卫生组织表示,全球有213种COVID-19疫苗正在被研发,其中49种疫苗进入临床试验阶段[68]。
2020年12月2日,英国药品及保健品管理局批准紧急使用辉瑞制药与BioNTech合作研发的BNT162b2疫苗[69],并于12月9日展开全民接种计划[70]。日本参议院全体会议于12月2日一致表决通过修改后的《预防接种法》,内容包括由国家承担日本民众接种COVID-19疫苗的费用[71]。
12月7日,中华人民共和国澳门特别行政区应变协调中心强调,特区政府预计于年底引进首批疫苗。[72]同月,中华人民共和国四川已经针对12类高风险人员开展了COVID-19疫苗紧急接种。[73]同月,莫斯科70多个站点启动COVID-19疫苗接种工作,自愿申请接种的医护人员、教师等高风险感染人群将优先接种该疫苗,优先接种人群为医护人员、教师等高风险感染人群。[74]4日,芜湖开展冬春季COVID-19疫苗摸底,这次摸底是为统筹做好该市COVID-19疫苗、流感、肺炎链球菌肺炎等疫苗接种,建立落实多病共防机制的前期工作。[75]
2020年12月11日,美国食品药物管理局宣布批准紧急使用辉瑞制药与BioNTech合作研发的BNT162b2疫苗[76][77]。同月,世界卫生组织表示,虽然一些COVID-19疫苗已陆续推出并开始接种,但目前仍不清楚疫苗是否能防止人体感染SARS-CoV-2。[78]
2020年12月31日,世界卫生组织率先核准使用辉瑞制药与BioNTech合作研发的辉瑞-BioNTech 2019冠状病毒病疫苗[79]。同日,中华人民共和国国务院召开的疫情防控记者会上宣布,国药集团生物新冠灭活疫苗已获中华人民共和国国家药监局批准附条件上市[80]。
2021年1月11日,世卫组织宣布,已有40多个国家开始接种COVID-19疫苗。[81]
2021年1月30日,强生公司宣布研发的疫苗的单剂有效率为66%[82][83]。
2021年2月3日,中华人民共和国外交部发言人汪文斌宣布,中国正式加入COVAX计划,将提供1000万剂疫苗用于发展中国家急需[84]。
2021年2月5日,世界卫生组织总干事谭德塞表示,全球新冠疫苗接种数量已经超过了报告的感染病例总数[85]。
2021年2月15日,世界卫生组织批准紧急使用阿斯特捷利康与牛津大学共同研发的牛津-阿斯利康2019冠状病毒病疫苗[86][87]。
2021年2月24日,由印度血清研究所生产的60万剂阿斯利康疫苗运抵加纳首都阿克拉,加纳因而成为世界卫生组织疫苗分配计划(COVAX)的首个受益国[88]。
2021年3月8日,芬兰研究人员研发出一款鼻喷式2019冠状病毒病疫苗,计划几个月内开展临床试验[89]。
2021年3月12日,强生公司研发的强生2019冠状病毒病疫苗获得欧盟和世卫组织发出紧急使用许可[90]。这是世卫组织和欧盟首次批准使用单次接种的新冠疫苗[91]。
2021年3月31日,俄罗斯注册了全球首个用于动物的新冠疫苗[92]。
2021年4月30日,美国莫德纳公司研发的莫德纳疫苗获得世界卫生组织核准紧急使用授权,是世卫组织第五种列入紧急使用清单的新型冠状病毒疫苗[93]。
2021年5月5日,美国政府宣布总统拜登同意临时豁免新型冠状病毒疫苗的专利保护,以促进疫苗的全球供应,世卫组织发言人赞扬是“里程碑时刻”,世卫组织总干事谭德塞在推特称美国的行动是“应对全球卫生挑战的强有力的领导范例”[94]。
2021年5月7日,中国国药集团研发生产的BBIBP-CorV获得世界卫生组织核准紧急使用授权,是世界卫生组织第六种列入紧急使用清单的新型冠状病毒疫苗。[95][96]
2021年5月14日,深圳康泰生物宣布公司研发的新型冠状病毒灭活疫苗已获批在中国紧急使用,已启动开展疫苗III期临床试验相关工作。[97]
2021年6月1日,中国科兴生物研发生产的克尔来福疫苗获得世界卫生组织核准紧急使用授权,是世界卫生组织第七种列入紧急使用清单的新型冠状病毒疫苗。[98][99]
2021年6月28日,辉瑞旗下动物药厂硕腾捐赠第一批试验性质动物用COVID-19疫苗给美国加州奥克兰动物园,老虎、熊、美洲狮和雪貂为第一批接种对象,该园之后也会为灵长类、果蝠和猪等动物注射疫苗[100]。
2021年7月26日,由中国工程院院士、军事科学院军事医学研究院研究员陈薇领衔团队所研发的雾化吸入用重组新冠疫苗(腺病毒载体)在《柳叶刀·传染病》发表I期临床研究数据。这是全球首个发表的新冠疫苗黏膜免疫临床试验结果[101]。
2021年10月11日,世卫组织疫苗顾问小组表示完成注射两剂中国科兴克尔来福或国药众爱可维疫苗的60岁或以上长者、中度至严重免疫力低下的族群,仍然有很高的受感染及演变为重症的风险,建议为这类族群在完成接种第二剂科兴或国药疫苗后的一至三个月,再追加多一剂世卫组织列入紧急使用的疫苗作为加强针,这是世卫组织首次建议打第三针疫苗[102]。
截至2021年10月末,全球已接种了超过70亿剂疫苗,其中阿联酋及中国的接种率已超过八成,智利及柬埔寨的接种也接近八成水平。非洲国家均在20%以下,其中南非的接种率最高,为19%,坦桑尼亚、尼日利亚及埃塞俄比亚只有1%的人口接种疫苗。[103]
2021年11月3日,印度研发的科瓦克辛疫苗获世卫组织批核紧急使用授权,在完成两剂接种两个月后的有效率为78%[104]。
2021年11月12日,康希诺研发的全球首款吸入式腺病毒载体新冠疫苗克威莎亮相第五届海南国际健康产业博览会[105]。
2021年12月17日,由美国诺瓦瓦克斯医药开发后授权印度血清研究所生产的科沃瓦克斯获世卫组织发出紧急使用授权[106]。
2021年12月21日,世卫组织向美国诺瓦瓦克斯医药原厂发出诺瓦瓦克斯2019冠状病毒病疫苗的紧急使用授权[107]。
2022年1月25日,辉瑞和德国生物新技术公司宣布正式启动针对变异新冠病毒奥密克戎毒株的疫苗临床试验。[108]
2022年4月3日,国药集团中国生物二代重组蛋白新冠疫苗获得国家药品监督管理局颁发的临床试验批准文件。[109]
2022年5月20日,世界卫生组织对中国制造商康希诺生物研发的单剂型COVID-19疫苗克威莎核发紧急使用授权。
2022年6月30日,台湾高端生物制剂表示旗下高端新冠肺炎疫苗正参与世界卫生组织主导的团结实验[110],并将在结果公布后向世卫组织申请核发紧急使用授权[111]。
2022年9月4日,康希诺发布公告,表示自己研发的全球首个吸入用新冠疫苗克威莎雾优在中国获批紧急使用[112][113]。
2022年9月初,多国相继批准针对奥密克戎BA.1或BA.4/5的新冠二价疫苗。[114]
2023年1月,康希诺开始试生产一款尚处于临床试验阶段的疫苗,这款疫苗也是中国使用mRNA技术研发的首批疫苗之一[115]。
2023年1月19日,国药集团中国生物复诺健生物科技针对奥密克戎变异株研发的新冠mRNA疫苗获得国家药品监督管理局临床试验批件。[116]
2024年1月10日,北京科兴中维生物技术公司确认,科兴生物“克尔来福”疫苗已经停产,病毒学家常荣山曾经建议不要打灭活疫苗,并说病毒流行株的抗原性变化较大,最好打mRNA疫苗、重组蛋白疫苗[117]。中国生物制药在2024年1月15日透露,通过投资科兴中维,从中收到接近60亿元人民币的分红,当时疫苗存货仍有大约4亿支[118]。
Remove ads
疫苗列表

- 科兴生物研发了一种名为克尔来福的灭活疫苗,并对743名志愿者进行了Ⅰ/Ⅱ期临床试验,结果显示没有严重的不良反应。2020年7月,科兴生物在巴西启动了一项Ⅲ期临床试验,随后于8月在印度尼西亚和9月在土耳其开启Ⅲ期临床试验[119][120]。12月25日,土耳其的研究人员宣布该疫苗的有效率为91.25%。 尽管有7371名志愿者参与了土耳其的试验,有效率数据仅基于752名接受了疫苗的志愿者和570名接受了安慰剂的志愿者[121]。2021年1月12日,圣保罗布坦坦研究所宣布该疫苗在巴西Ⅲ期临床试验的有效率为50.38%[122]。4月11日,布坦坦研究所公布了该疫苗在巴西的Ⅲ期临床试验的最终结果,并将该疫苗的有效率修正为50.7%。[123]
- 巴拉特生技的灭活疫苗BBV152(又称Covaxin)于2020年6月开始临床试验,成为首款进入临床试验的印度研制新冠候选疫苗[124]。10月23日,巴拉特生技宣布开启Ⅲ期临床试验,将在印度25个地点招募26,000名志愿者参与[125]。2021年1月3日,印度政府授予BBV152紧急使用授权[126]。巴拉特生技于3月3日宣布Ⅲ期临床试验中期分析结果显示该疫苗的有效率为81%[127],并于4月21日宣布第二次中期分析结果,将该疫苗的有效率从81%修正为78%[128]。
- 哈萨克斯坦生物安全问题研究所研发的灭活疫苗QazVac于2020年9月开启Ⅰ期临床试验,有44名志愿者参与[129]。12月,Ⅲ期临床试验在哈萨克斯坦国内开始,3000名志愿者参与[130]。哈萨克斯坦于2021年4月下旬开始向公众接种疫苗[131]。
- 中国人民解放军军事科学院军事医学研究院陈薇院士领衔与天津疫苗公司康希诺生物联合研发的一种基于重组腺病毒疫苗的,名为Ad5-nCoV的候选疫苗的I期临床试验于2020年3月开始在武汉招募108名健康成年人,而试验数据的收集工作则计划持续到2020年底[132][133][134]。2021年2月21日,康希诺生物向中国国家药监局提交附条件上市申请[135],2月25日获国家药监局附条件批准注册申请[136]。康希诺生物表示其一剂疫苗在接种后28天的有效率为65.28%[137]。
- 俄罗斯加马列亚流行病与微生物学国家研究中心研发的一种基于5型、26型腺病毒名为Gam-Covid-Vac的新冠疫苗。研究人员于2020年6月开启临床试验。8月11日,总统普京宣布俄罗斯监管机构已批准该疫苗,并将其商品名命名为“卫星V”[138]。2021年2月2日,研究人员在《柳叶刀》上发表了Ⅲ期临床试验数据,显示疫苗的效力为91.6%[139]。
- 美国强生公司的26型腺病毒载体疫苗Ad26.COV2.S于2020年7月开启Ⅰ/Ⅱ期临床试验。9月,强生公司开始Ⅲ期临床试验,但因一名志愿者出现不良反应,试验于10月12日暂停。试验在11天后恢复[140]。2021年2月24日,美国食品药品监督管理局发表了对试验的分析,总结该疫苗在美国的有效性为72%,在南非为64%,在拉丁美洲为61%[141]。
- 安徽智飞龙科马生物制药与中国科学院微生物研究所合作研发了一种蛋白质亚基疫苗。Ⅱ期临床试验于2020年7月启动。12月,Ⅲ期临床试验启动,该项试验将招募29000名志愿者[142]。
- 古巴芬莱疫苗研究所开发了一种名为“主权2号”的三剂疫苗。芬莱研究人员于2020年10月开始Ⅰ期临床试验,随后于12月进行了Ⅱ期临床试验。2021年3月3日,芬莱疫苗研究所注册了“主权2号”的Ⅲ期临床试验[143]。6月19日,古巴生技制药表示,该疫苗接种第二剂后的有效率为62%[144]。
- 美国国家过敏和传染病研究所(NIAID)与莫德纳合作开发了一种RNA疫苗,该疫苗产生的蛋白质与冠状病毒表面的突触相匹配,因此该疫苗不含有冠状病毒或者其他类别的病毒[46]。NIAID登记了这种名为mRNA-1273的候选疫苗的一项Ⅰ期临床试验,其志愿者为来自西雅图的45名健康成年人[145],而其招募工作则于2020年3月19日完成[146]。位于佐治亚州亚特兰大市的埃默里大学则于4月启动另一项Ⅰ期临床试验[147]。Ⅲ期临床试验于7月27日开始,这项试验将在美国约89个地点招募30,000名志愿者[148]。11月16日,莫德纳宣布了该试验的第一批初步数据,试验志愿者中一共有196例COVID-19病例,其中185例为接受了安慰剂的志愿者,11例为接受了疫苗的志愿者。研究人员估计该疫苗的效力为94.5%,远高于疫苗测试开始时专家的预测[149]。2021年4月13日,莫德纳宣布Ⅲ期临床试验的最新数据显示该疫苗的有效率为>90%和重症病例的有效率为>95%[150]。
Remove ads
此章节需要扩充。 |
- 国药集团中国生物研究院重组新冠病毒疫苗于2021年4月9日获得国家药品监督管理局临床试验批件[343]。
Remove ads
- 澳大利亚昆士兰大学和杰特公司联合研发的蛋白质亚基COVID-19疫苗于2020年7月启动,但部分受试者在第I期临床试验中出现艾滋病病毒检测假阳性结果[392]。12月11日,澳大利亚总理斯科特·莫里森宣布放弃研制该款疫苗[393]。
- 美国默克公司于2020年6月收购奥地利公司Themis Bioscience以研发其疫苗TMV-083。该疫苗最初由巴斯德研究院研发,它使用了一种携带新冠病毒刺突蛋白基因的弱化麻疹病毒。研究人员于8月在法国和比利时启动了Ⅰ期临床试验[394]。2021年1月25日,默克公司宣布放弃研发TMV-083,因为该疫苗引起的免疫反应比自然感染弱[395]。
- 默克公司与IAVI合作开发了第二种病毒载体疫苗V590。该疫苗水使用疱性口炎病毒载体,与默克公司生产的埃博拉疫苗的方法相同。默克公司和IAVI于2020年9月30日注册位于美国的Ⅰ期临床试验[396]。但因该疫苗未能触发与新冠病毒自然感染相似的免疫反应,2021年1月25日,默克公司宣布放弃研发V590[395]。
- 伦敦帝国学院于2021年1月26日宣布放弃对其RNA候选疫苗进行大规模临床试验的计划。研究团队将专注于研发新冠病毒变体的候选疫苗[397]。
- 美国马里兰州生物制药公司Altimmune研发了一种基于5型腺病毒,名为AdCOVID的鼻喷雾疫苗。2020年12月22日,Altimmune注册了其疫苗的Ⅰ期临床试验[398]。但Altimmune于2021年6月29日宣布将放弃研发该疫苗。Ⅰ期临床试验数据表明接受疫苗的80名志愿者产生的免疫反应比预期低[399]。
- 台湾浩鼎生技股份有限公司董事会于2023年12月20日宣布,停止开发BCVax产品研发专案。[400]
Remove ads
正在研发的疫苗可能不安全或无效[401]。一项研究表明,在2006年至2015年之间,疫苗等生物制剂连续获得I期至III期临床试验批准的成功率为11.5%[402]。
2020年9月8日,阿斯利康表示,由于英国一项研究中的一名对象出现贯穿性脊髓炎,该公司暂停了COVID-19疫苗的临床试验[395]。阿斯利康在一周内已恢复了全球的临床试验,美国在10月23日恢复试验[403][404]。
2020年10月21日,巴西卫生部门表示,有一名巴西志愿者在接种阿斯利康研发的疫苗后死亡[405]。10月29日,由圣保罗布坦坦研究所与中国大陆科兴生物技术公司共同研发的COVID-19疫苗在巴西再度出现“严重副作用”。11月9日,圣保罗布坦坦研究所与科兴生物技术公司共同研发的COVID-19疫苗暂停临床试验[406]。不过11月10日,巴西卫生部门表示志愿者死亡原因为自杀,故于11月11日恢复科兴生物科技的疫苗试验[407]。
2020年12月11日,秘鲁通报一名接受中国国药疫苗的受试者接种疫苗后出现神经问题,秘鲁当局决定暂停中国国药疫苗的实验[408]。12月16日,实验恢复[409]。
Remove ads
疫苗效力
虽然目前的科学共识是2019冠状病毒病疫苗可以有效的保护接种者免于患病、患重症或死亡[421],惟一项于2021年10月下旬发表在《柳叶刀》上的研究指出,接种了两针新冠疫苗的人依然会感染新冠病毒并将病毒传染给共同居住的人,且打过两针疫苗的人传染性和没打过疫苗的人一样强[422][423][424]。
Remove ads
接种计划
随着疫苗研发的进展,中国大陆、美国和欧洲多国等计划2020年10月至2021年1月期间开始允许分发和接种疫苗。[425]

2020年6月24日,国务院批准《新冠病毒疫苗紧急使用(试用)方案》,7月22日正式启动新冠疫苗的紧急使用。[426]
2021年1月9日,国务院联防联控机制新闻发布会中,国家卫健委副主任曾益新明确,疫苗和接种服务的全部费用将由医保基金和财政共同负担,居民个人不负担费用[427]。
2021年3月29日,国家卫健委发布了《新冠病毒疫苗接种技术指南(第一版)》。[428]
截至2021年6月24日,中国大陆共有7款疫苗批准附条件上市或紧急使用[429][97],累计报告接种新冠病毒疫苗超过11亿剂次[430]。
2024年7月15日起,新冠疫苗免费接种将调整为自费接种,医保基金将停止支付新冠疫苗及接种费用,各级财政机构也不再提供相关补助[431]。
2020年12月23日,香港特区政府刊宪,订立《预防及控制疾病(使用疫苗)规例》(第599K章)(《规例》),在公共卫生紧急状态下提供法律框架,引入符合安全、效能及质素要求的2019冠状病毒病疫苗作紧急使用,《规例》的有效期至2021年12月23日。[432]
2021年2月22日,林郑月娥联同多名司局长在设于香港中央图书馆展览馆的社区疫苗接种中心接种科兴疫苗[433]。2月26日,香港正式启动疫苗接种计划[434]。至2021年6月2日为止,共有两款疫苗在香港获得紧急使用批核(EUA),分别是克尔来福及复必泰疫苗,于2021年2月中旬起先后交付并投入使用;约有141万名香港居民已接受至少一剂疫苗和约有104万名香港居民已接受第二剂疫苗[435]。
香港至2021年4月中下旬施打了130万剂疫苗,当中20多人在注射疫苗后死亡[436]。截至2021年5月23日有68人在接种疫苗后于医院病房或急诊室死亡,另有19名孕妇接种疫苗后流产[437]。新冠疫苗临床事件评估专家委员会目前认为没有死亡个案与疫苗有因果关系[438]。香港特区政府从6月1日起不再公布注射疫苗后的死亡事故,改为每隔两星期在网上简报,并且排除官方认为不相关的个案[439]。
2020年12月7日,澳门正就订购COVID-19疫苗积极与供应商联系,未来澳门市民接种疫苗属自愿性质,且为免费接种,接种计划位将会让高危人群或有特别需要的人士优先接种。[72]14日,澳门特区政府公布COVID-19疫苗的接种安排,将以自愿为原则,为高暴露人群或有特别需要的人士等三类人员优先接种。[440]
2021年2月1日,澳门政府宣布,第一批由国药集团生产的10万剂灭活疫苗,将于2月5日运抵澳门,预计将在农历新年前后优先安排包括医护人员、各口岸前线人员、赌场庄荷、教学人员、司机或急需往外地的人士接种。而复星医药同德国BioNTech合资的10万剂疫苗,则预计在2月26日前运抵澳门。而阿斯利康的疫苗则预计最快2021年第3季才会抵达澳门[441]。2月6日,首批由国药集团生产的10万剂灭活疫苗运抵澳门,于9日早上安排接种仪式,澳门行政长官贺一诚率领大部分主要官员在接种仪式上即时接种疫苗[442][443]。
2021年2月8日,澳门新型冠状病毒感染应变协调中心表示,第一阶段优先接种疫苗的人群,包括前线抗疫人员、高职业暴露人群及需要前往流行地区的人士,即日可开始预约,并于2月9日9时开始接种;第二阶段开放予其他居民接种,2月9日中午12时起可以预约,于2月22日后接种,有需要协助预约人士,可到社工局辖下8个站点由工作人员提供协助[444]。为了向新冠病毒疫苗接种人士提供额外的保障,政府已选出一家保险公司就接种疫苗的不良反应或副作用而出现不良后果之情况,提供投保年期为1年的团体保险服务;被保人为任何按卫生局指引接种疫苗的人士,年龄由16至85岁(不论性别和健康状况)[445]。

2020年12月30日,中央流行疫情指挥中心公布台湾疫苗获得进展。指挥中心已洽购疫苗总计近2,000万剂,包含COVAX采购平台约476万剂、阿斯特捷利康1,000万剂及另一家洽谈中约500万剂疫苗。指挥中心指挥官暨卫生福利部部长陈时中表示,上述疫苗最快2021年3月可供货,到第3季以前近八成可进口到台湾[446]。另外,有台湾民间人士表示,建议由民间单位引进中国大陆的疫苗,但指挥中心指挥官多次表示不会引进和使用中国大陆疫苗。对此,中国大陆国台办发言人朱凤莲表示,此问题存在障碍,主要是政治障碍。陈时中表示,依据《台湾地区与大陆地区贸易许可办法》及经济部国贸局公告之《大陆物品不准许输入项目汇总表》,台湾一直没有开放中国大陆生产的血清、血液制剂和疫苗进口,并不是因为此次疫情,而是长期以来对中国大陆的制程有疑虑,加上中国大陆过去有许多疫苗曾出现问题,因此一直没有开放中国大陆疫苗进口[447][448]。
2021年2月3日,有网络传出流行疫情指挥中心另与强生、默克、诺瓦瓦克斯接洽疫苗采购事宜。指挥官陈时中证实,进入二、三期临床试验疫苗厂,指挥中心陆续都有去接洽,除采购外也谈相关研究合作,盼谋得双方利益[449]。
2021年2月10日,莫德纳宣布已和政府签署疫苗供应协议,将提供500万剂疫苗[450]。5月28日,首批莫德纳疫苗由中华航空货机从卢森堡启运,中停迪拜后抵达台湾[451]。
2021年3月3日,首批AZ疫苗从韩国以大韩航空班机运抵台湾,经检验与封缄后于同月22日起分配到全台57家医院开打,行政院院长苏贞昌及陈时中带头接种,上午7时40分在台大医院施打疫苗[452]。
2021年6月4日,日本宣布向台湾提供124万剂英国阿斯利康公司AZ疫苗,当天这批疫苗送抵台湾。[453]6月19日,美国无偿捐赠台湾250万剂美国生产的莫德纳疫苗[454],这250万剂疫苗于6月20日下午运抵台湾[455]。除了美日两国,立陶宛、捷克、斯洛伐克及波兰也陆续捐赠疫苗给台湾。
2021年7月11日,上海复星宣布旗下子公司复星实业与鸿海精密、永龄基金会、台积电及裕利医药签订销售协议,将销售1000万剂BNT疫苗[456][457]。鸿海精密与台积电于隔日(12日)在台湾证券交易所发布重大讯息证实[458][459]。7月21日,慈济基金会宣布与复星实业完成500万剂BNT疫苗采购及捐赠合约签订[460]。同年9月2日,第一批93.2万剂BNT疫苗由卢森堡国际货运航空的CV7962班次货机运抵台湾桃园国际机场[461],将会先供12岁至17岁的学生及18岁至22岁的青年施打[462]。
2022年4月17日,卫生福利部食品药物管理署召开专家会议,因应新型冠状病毒疾病疫情(COVID-19)防疫需求,核准莫德纳疫苗用于6至11岁儿童接种[463]。莫德纳疫苗作为儿童疫苗用法用量为施打两剂,每剂0.25毫升(含50微克的mRNA,为成人剂量的一半)[464]。两剂施打间隔12周[465]。预计2022年5月2日开始施打[466]。
2022年4月28日,卫生福利部食品药物管理署召开专家会议,通过辉瑞BNT儿童疫苗于5岁至11岁儿童使用,2剂至少间隔21天,但预计以上次ACIP专家建议的12周为实际接种间隔的原则。也宣布将采购220万剂辉瑞BNT儿童疫苗,预计5月中旬前会到货。剂量为0.2毫升、含有10微克mRNA,完整接种为2剂、至少间隔21天;针对严重免疫功能不全儿童至少间隔28天,且可以接种第3剂[467]。目前有次世代疫苗,是针对BA.5,但是高端报废率高,所以这次不订高端疫苗。”

2020年11月20日,辉瑞和BioNTech向美国食品药品监督管理局(FDA)提交了其COVID-19候选疫苗BNT162b2的紧急使用授权(EUA)申请,而BNT162b2于12月11日获得FDA紧急使用授权。[468][469]12月14日,医护人员和长期护理机构居住者开始接种该疫苗。[470]当选总统乔·拜登于12月21日在电视直播中接种了他的第一剂辉瑞疫苗。[471]
11月30日,莫德纳向FDA申请候选疫苗mRNA-1273的紧急使用授权。[395]莫德纳疫苗于12月18日获得FDA紧急使用授权,并于12月21日开始接种。[472][473]美国疾病预防控制中心表示,自2020年12月21日至2021年1月10日期间,美国共完成400多万剂莫德纳疫苗的注射,其中只有10人出现严重过敏反应[474]。
2021年2月4日,强生公司向FDA申请其COVID-19候选疫苗的紧急使用授权。[475]FDA于2月27日批准该授权的申请。强生公司已承诺在6月底前向美国提供1亿剂疫苗。[476]
特朗普政府的目标是在2021年12月底前至少让2000万人接种第一剂疫苗,但截止12月31日,美国只有280万人接种第一剂辉瑞或莫德纳疫苗。[477]12月,当选总统拜登承诺在上任后100天时完成1亿剂新冠疫苗的注射。[478]2021年1月25日,拜登政府宣布每日完成150万剂疫苗注射的目标。[479]3月9日,阿拉斯加州成为美国首个向16岁或以上人群开放COVID-19疫苗接种的州[480]。3月11日,拜登总统表示他将指示各州、原住民保留地和领地在5月1日之前向所有美国成年人开放COVID-19疫苗接种[481]。截至4月19日,美国一半成年国民已经至少接种了一剂新冠疫苗[482]。
2020年12月2日,英国批准使用辉瑞疫苗[483]。12月8日,英国开始大规模接种疫苗,成为全球首个大规模接种2019冠状病毒病疫苗的国家。[484][485]不过在疫苗接种第一天,有两人报告出现不良反应。英国药品监管机构建议有严重过敏史的人不要接种疫苗[486]。12月31日,英国批准了由牛津大学和阿斯利康联合研发的COVID-19疫苗紧急使用[487]。2021年1月8日,英国允许莫德纳研发的COVID-19疫苗在英国使用[488]。1月9日,英国女王伊丽莎白二世与丈夫菲利普亲王完成疫苗接种[489]。截至2月14日,英国有约22%的人口注射了第一剂疫苗[490]。截至3月24日,英国民众已接种1800万剂阿斯利康新冠疫苗,当中30人出现血栓症状,有7人死亡[491]。
2020年8月,俄罗斯卫星V(Sputnik V)注册,为全球首款注册的COVID-19疫苗[492]。12月5日,俄罗斯莫斯科启动COVID-19疫苗接种工作,教师等高风险人群优先接种。[74]12月27日,克里姆林宫发言人称俄国总统普京将接种卫星V疫苗[493]。至2021年1月2日的统计,俄罗斯已有80万人接种卫星V疫苗[494]。
2021年5月6日,单剂2019冠状病毒病疫苗“卫星-Light”在俄罗斯批准[495]。
2021年11月初,俄罗斯圣彼得堡当局强制60岁以上和慢性病患者接种2019冠状病毒病疫苗。[496]截至当时,俄罗斯全国有4成人左右接种疫苗。[497]
印度于2021年1月16日推出第一阶段疫苗接种计划,计划对象为国内一千万名医护人员和二千万名前线人员(警察、市政人员等)接种疫苗[498],接种者无法选择接种的疫苗种类[499]。3月1日开始第二阶接种计划,对象扩大到60岁以上及45岁以上患有心脏病、糖尿病等长期病患人士,覆盖全国2.7亿人[499]。疫苗在公立医院免费提供,全国一万家私立医院发售,价格固定为250卢布。这个阶段六百六万医护人员注射第一剂疫苗,二百四十万人注射了两剂疫苗,前线人员只有五百一十万接种了疫苗[500]。第二阶接种计划开始,申请接种疫苗的人需要在网站CoWIN上注册[501]。3月24日,印度卫生部记录显示全国有超过五千万人接种了疫苗[498]。5月1日开始第三阶接种计划,对象扩大到18岁到45岁人士。印度部分邦因为疫苗供应不足等问题,无法实施计划[502]。计划展开一周,疫苗接种数量下降到八周以来最低。除了疫苗生产和运输问题,疫苗接种登记网站CoWIN的设计问题被认为是原因之一。印度电信管理局数据显示印度只有58%人口能使用网络,CoWIN目前只能提供英文,而印度只有10%的人口懂得说英文[503]。6月21日起,印度成年人可以免费接种疫苗[504]。截至10月21日,印度累计接种新冠疫苗10亿剂次。[505]
2020年10月底,阿联酋和巴林批准对中国国药的两款COVID-19疫苗进行紧急使用[506]。12月4日,巴林批准使用辉瑞的COVID-19疫苗[507]。12月9日,阿联酋正式批准中国国药的COVID-19疫苗上市[508]。
2020年12月,哈萨克斯坦卫生部表示,俄制“卫星V”疫苗预计将在明年2月11日前在哈萨克斯坦完成注册。[509]
2021年1月3日,印度药品管理总局批准紧急使用两种COVID-19疫苗的授权申请[510]。
2021年1月3日,泰国政府已与中国大陆科兴控股生物技术有限公司签署COVID-19疫苗订购协议,采购200万剂COVID-19疫苗。[511]2021年1月6日,泰国总理巴育·占奥差在个人社交媒体上宣布,年内为全国至少半数民众免费接种疫苗[512]。
2021年1月11日,韩国总统文在寅表示自2月起,韩国公民可免费接种疫苗[513]。2月26日,韩国开启疫苗接种[514]。
2021年1月4日,日本首相菅义伟4日在记者会上宣布,将在2月下旬之前启动COVID-19疫苗接种。他表示自己有意率先接种。[515]2月17日,日本启动新冠疫苗接种工作[516]。
2021年1月13日,约旦启动接种国药集团研发的COVID-19疫苗计划[194];印尼总统佐科·维多多通过电视直播接种科兴生物研发的疫苗[517];土耳其紧急批准科兴生物研发的疫苗[518];阿塞拜疆的民众开始大规模接种科兴公司生产的COVID-19疫苗[519]。
2021年1月19日,新加坡的民众开始进行大规模冠状病毒疫苗接种工作[520]。
2021年2月1日,巴基斯坦正式接受中国政府首批对外援助的新冠疫苗。2月3日,巴基斯坦全国范围内的疫苗接种开始进行。[521]2021年4月9日,巴基斯坦授权紧急使用中国科兴新冠疫苗。[522]据印度亚洲国际新闻社(ANI)报道,在中国康希诺生物公司的帮助下,巴基斯坦国立卫生研究院(NIH)成功在本土生产新冠疫苗,并将于5月底上市。[523]
2021年2月21日,以色列政府表示,该国已有近半人口接种新冠疫苗[524]。2021年7月底,由于原本注射两针的疫苗对德尔塔变异毒株效果不佳,以色列开始为60岁以上人群接种新冠疫苗第三针加强针[525]。
2021年11月16日,菲律宾批准中国科兴公司生产的新冠疫苗作为加强针在菲律宾接种。[526]
2021年11月26日,阿联酋卫生部表示,该国已经施打逾2180万剂新冠疫苗,100%的目标人口已接种至少一剂疫苗,而完成全程接种的人口比例达到90.18%。[527]12月27日,该国又批准紧急使用中国国药新型重组蛋白疫苗作为加强针[528]。
2022年1月5日,越南政府常务副总理范平明表示越南成为新冠疫苗接种率最高的6个国家之一。[529]
2022年1月10日起,印度开始为医护人员、一线工作者和有基础病的60岁以上人群接种新冠疫苗加强针。[530]
2022年2月底,韩国开始为高风险人群施打第四剂冠病疫苗。[531]

2020年12月,据希腊媒体报道,已激活电子处方服务的希腊公民将在疫苗接种工作开始后收到带有预约信息的短信或电子邮件。[532]
2020年12月24日,法国高级卫生管理局发布公告,对德国生物新技术公司与美国辉瑞公司联合开发的COVID-19疫苗的有效性表示认可,并批准在年龄为16岁及以上的人群中接种。[533]2021年1月8日,法国批准使用莫德纳疫苗[534]。
2021年1月29日,匈牙利成为首个批准使用中国疫苗的欧盟国家。[535]匈牙利现已采购的疫苗包括俄罗斯“卫星-V”疫苗、美德合作研发的辉瑞-BioNTech疫苗、英国牛津-阿斯利康疫苗、美国莫德纳疫苗、中国国药集团疫苗、中国康希诺新冠疫苗和印度Covishield疫苗。[536]同日,欧盟委员会批准阿斯利康与牛津大学联合研发的疫苗附条件上市[537]。
2021年3月7日,奥地利卫生监管机构宣布,由于该国出现两名护士接种疫苗后分别病亡和发生肺栓塞,奥地利暂停一个批次的阿斯利康新冠疫苗的接种[538]。
2021年5月17日,德国联邦卫生部宣布6月7日起取消新冠疫苗接种排序规定,16岁以上人士可以接种疫苗[539]。
2021年9月起,德国为老年人及免疫力低下者接种新冠疫苗加强针[540]。
截至2021年9月14日,意大利各大区疫苗接种率达到74.28%[541]。
截至2021年10月18日,德国国内人口总数65.8%的人完全接种新冠疫苗。[542]
法国自2021年11月27日新冠疫苗加强针接种范围扩大至18岁以上人群[543]。2021年12月15日起,65岁以上人群必须接种加强针才能继续持有健康通行证;同时加强针接种范围将扩大至50岁至64岁人群[544]。
2021年11月16日,爱尔兰将加强针接种范围从60岁以上人群和医务工作者扩大到50岁至59岁的人群和16岁至59岁有基础疾病的人群。[545]
2021年12月10日,德国联邦议院和联邦参议院通过了医护人员义务接种新冠疫苗的法律[546]。
2022年2月1日起,奥地利全国强制接种疫苗。[547]
2022年7月21日,西班牙决定对80岁以上年龄段的民众接种第四针新冠疫苗加强针。[548]

2021年3月24日,古巴开始为国内一线医护人员接种主权2号疫苗,将有十五万医护人员接种疫苗[549]。5月12日,古巴本地开始展开大规模接种计划[550]。
2021年1月18日,巴西国家卫生监督局宣布,批准中国大陆和英国两款COVID-19疫苗在该国紧急使用。[551]
2021年4月7日,智利公共卫生研究院专家委员会给予中国康希诺新冠疫苗在智利紧急使用许可[552]。9月6日,智利公共卫生研究院专家委员会给予中国科兴公司新冠疫苗在6岁至17岁人群中的紧急使用许可[553]。11月25日,智利公共卫生研究院允许中国科兴疫苗可在3至6岁人群中使用[554]。
2021年10月1日。阿根廷政府批准中国医药集团有限公司研发的新冠疫苗在该国3至11岁儿童中紧急使用[555]。
2021年11月起,古巴开始为民众接种新冠疫苗加强针。[556]
2021年1月25日,埃及开始为医护人员接种中国国药集团生产的新冠疫苗[557]。
2021年7月23日,澳大利亚临时批准辉瑞新冠疫苗用于12岁至15岁人群接种。[558]
2022年1月10日起,澳大利亚允许5岁至11岁儿童提供辉瑞疫苗接种。[559]同年4月起,澳大利亚为脆弱人群打第二针加强针。[560]
疫苗安全、供应及相关议题
接种新冠疫苗后通常伴有发烧、恶心等由免疫反应导致的副作用[561],虽然对健康人不会有持续影响,但可能因此令体弱多病的病患注射疫苗后引起并发症,甚至死亡。尽管有些人在接种疫苗后不久会因年龄或潜在疾病而引起不适,但目前尚未有明确证据表明注射疫苗后的死亡事件与疫苗本身有直接的关系[561][562]。
各国接种计划大规模展开后,接种人群中所产生的一些症状与疫苗的关系,有待进一步研究、调查。[563][564]
2025年10月一项研究显示,针对SARS-CoV-2的mRNA疫苗能提高肿瘤对免疫检查点抑制剂(ICI)的敏感性[565]。
2020年12月,因为辉瑞疫苗在第三期临床试验中出现被称为贝尔氏麻痹症的“面瘫”个案,此症因而被认为是该疫苗的罕见副作用之一[566]。
2021年7月15日,香港特区政府根据疫苗专家委员会分析多宗接种中国科兴克尔来福疫苗后发生的多宗不良反应案例后[567],正式将又称“面瘫”的贝尔氏麻痹症列为中国科兴克尔来福疫苗的副作用之一[568]。
接种后贝尔氏麻痹症症状一般不严重、可自愈,所以接种疫苗益处仍远大于弊。[569]
2021年2月,奥地利两名女子接种阿斯利康疫苗后,发生凝血障碍,其中一人死亡,另一人因肺栓塞住院治疗,2021年3月3日,奥地利暂停使用有关批次的疫苗[4]。尽管尚未确定血栓与接种疫苗的联系[570],但丹麦、挪威、冰岛、罗马尼亚、保加利亚、爱尔兰、西班牙、德国、瑞典等十几个国家也暂停了该疫苗的使用,同时等待欧洲药品管理局完成安全审查。[571]3月18日,欧洲药品管理局继续推荐接种阿斯利康疫苗,欧洲药监局认为阿斯利康疫苗与接种者血栓风险上升没有联系,也没有证据证明某批次或者某厂生产的疫苗存在问题[572]。多国开始恢复接种疫苗[573]。不过4月7日,欧洲联盟药物监管机构又认为,应把异常且有潜在生命危险的血栓列为牛津-阿斯利康新冠病毒疫苗的罕见副作用[574];欧洲药品管理局4月13日发布信息更新,称阿斯利康疫苗与血栓形成之间“有可能存在因果关系”[575]。根据8例六十岁以下接种者血栓与低血小板病例,欧洲药品管理局4月20日称强生疫苗与罕见血栓形成之间也有“可能的联系”,但总体而言接种益处仍然大于风险。[576]
挪威、德国等国学者发现,因接种牛津-阿斯利康新冠病毒疫苗而产生血栓的患者体内均出现了PF4-polyanion抗体阳性及高水平的肝素,而提出了该腺病毒疫苗导致血栓及血小板减少罕见不良事件的一种可能机制。[577][578][579]因接种监测过程中发现6起罕见血栓事件,4月13日美国疾病控制与预防中心与美国食品药品监督管理局联合建议暂停强生2019冠状病毒病疫苗接种,以待进一步调查、分析、决定。[579][580][581]上述两家美国监管机构经研究于4月23日撤回了暂停强生疫苗接种的决定,但其专家委员会建议五十岁以下女性接种者应充分了解出现罕见血栓的可能风险。[582]
鉴于两种不同腺病毒疫苗大规模接种过程中出现类似的血栓形成与血小板减少罕见事件,腺病毒载体本身作为一种疫苗开发平台是否存在内在隐患,引起关注。[583][584]另外两种腺病毒载体类型新冠疫苗开发机构加马列亚研究中心及康希诺生物则表示,在近来大规模接种其疫苗过程中均未发现类似血栓事件。[585][586]
截至2021年4月22日,英国已有168人在接种阿斯利康&牛津大学疫苗后出现血栓症状,其中32人死亡[587]。4月27日,加拿大出现首起接种阿斯利康-牛津疫苗后出现血栓并导致死亡的案例[588]。
因可能的血栓风险,美国食品药品监督管理局2022年5月5日宣布除少数有特殊情况或需求的成年人之外,应停止强生2019冠状病毒病疫苗的接种。[589]
根据以色列卫生部的说法,在一小群16-30岁的男性中,第二剂辉瑞疫苗与轻度心肌炎之间可能存在着关系。在2020年12月至2021年5月期间,在500万名接种者中出现了275例心肌炎,其中95%被归类为轻度心肌炎。[590]类似现象也在美国mRNA疫苗(辉瑞或莫德纳疫苗)接种者当中被观察到。[591]6月23日,美国疾病管制与预防中心(CDC)专家委员会讨论了相关接种数据,认为mRNA疫苗接种与青少年及年轻人的罕见心脏炎症(心肌炎或心包炎)“存在可能的关联”。[592]
欧洲药品管理局7月9日证实,接种mRNA疫苗之后存在心肌炎或心包炎的稀有案例,主要发生于接种14天之内(多为第二剂)的年轻男子。该管理局建议将心肌炎及心包炎列为辉瑞及莫德纳疫苗可能的副作用。[593]
据美国食品药品监督管理局数据,强生2019冠状病毒病疫苗在极罕见情况下可能触发格林-巴利综合征。[594] 之前欧洲药品管理局也建议对于阿斯利康疫苗触发该症状的可能性提出警示。[595][596][597]
欧洲药品管理局分别于2021年10月及2022年1月建议将贯穿性脊髓炎列为强生及阿斯利康疫苗的可能副作用。监管机构未有公布出现此症状的人数。[598]
由于疫苗供不应求,2021年1月22日,阿斯利康宣布2021年第一季度仅能向欧盟供应少量疫苗,引发欧盟不满[599]。欧盟呼吁阿斯利康的英国工厂提高产量[600]。
而为缓解疫苗紧张,欧盟又决定对在欧盟内生产的疫苗实行出口管控措施。此举又招致世卫组织批评。世卫组织总干事谭德塞表示,疫苗民族主义无助于缓解疫情[601]。2021年4月27日,欧盟不满阿斯利康延迟交付宣布起诉阿斯利康[602]。2021年6月中旬,比利时布鲁塞尔一审法庭裁定阿斯利康必须于9月27日前交货8020万剂疫苗[603],否则每剂罚款10欧元。欧盟原本希望法庭判处阿斯利康须在6月底前交付1.2亿剂疫苗,9月底前完整交货3亿剂,及对延迟运交的疫苗每剂每天罚款10欧元,但法庭裁决的交付量及每剂的延期罚款明显少过欧盟要求的数字,而阿斯利康已经在法庭宣判前交付了近7000万剂疫苗,亦即只需在9月27日前交付多约1000万剂便能达到裁决要求,不过法庭也表示阿斯利康仍是要尽力完成3亿剂的总交货量[604]。
2020年3月18日,中华人民共和国清华大学清华长庚医院急危重症部部长陈旭岩就美国COVID-19疫苗已开始人体临床试验表示,“美国这一针打在人体身上的疫苗,从推断上来说实在是太快了。疫苗的研发,有一系列国际标准的法规和技术标准,必须不能跳步的东西就不能跳步,除非很早就开始进行试验,更早的拿到了病毒株[605]。”
2020年8月,俄罗斯成为率先批准新冠病毒疫苗的国家,该国生产的“Sputnik V”将于10月起大规模接种,然而由于疫苗在三期临床试验之前取得许可,如此匆促的决定也引起全球的关注。[606]
英国伦敦帝国理工学院传染病专家特里戈宁(John Tregoning)说:“这种疫苗采用现有的技术。它已经达到很高的标准,使用我们知道可以安全用于人的东西,并且将对那些参与试验者进行非常严格的管控……是的,进行的十分之快,但这是一场与病毒的竞赛,而不是科学家之间的竞争,而且这样做是为了人类的利益。”英国广播公司报导指,该次实验的“mRNA-1273”疫苗并非由引起2019冠状病毒病的病毒制成。取而代之的是,是从科学家已经能够在实验室制造的病毒复制而来的基因编码研发出来,希望能激发人体自身的免疫系统抵抗感染[607]。
美国宾夕法尼亚大学医学院副教授张洪涛认为,腺病毒载体疫苗的技术路线是可行的,也可以表达抗原,但存在一定的安全风险,因为该疫苗“同时引入了作为载体的腺病毒,而腺病毒本身也是一种病毒”,虽然在疫苗设计中会考虑到病毒复制的风险,但“整个技术路线的安全性尚未经历过大规模使用的验证”[134]。
辉瑞疫苗在进行44000人临床试验时有6人死亡,其中两人是在注射疫苗后死亡。[608]美国FDA随后澄清死亡案例与疫苗无关,并解释“所有死亡案例都代表发生在其所在年龄段的一般人群中的事件,发生率相似”。[609]
2021年1月,挪威开始疫苗接种后,短期内有23名80岁以上老人在注射疫苗后死亡,有怀疑认为疫苗的轻微副作用也可能对年老体弱者有较高风险。[610][611]截至1月18日,挪威公共卫生学院已调查了23例死亡病例中的13例,调查人员尚未得出疫苗导致死亡病例的结论。[612]
彼得·多西(Peter Doshi)在《英国医学杂志》所办博客BMJ Opinion上计算称,辉瑞疫苗有效率其实只有29%。有文章对其中算法的问题予以反驳,同时批评多西是美国“反疫苗运动”的成员,平日主要批评政府对疫苗接种的推广行为。[613]
2021年1月,印度首都新德里超4000名接种者中,有多达51名医护人员在接种疫苗后出现不良反应,其中一人被送入了医院的重症监护室(ICU)。[614]
2021年1月,美国加利福尼亚州一个社区中心有不到10人在接种莫德纳疫苗后24小时内几乎所有人出现严重的过敏反应。加州一家机构报告称,出现不良反应的人接种的41L20A批次的莫德纳疫苗的潜在过敏反应数量高于正常水平。1月17日,加州公共卫生部(California Department of Public Health)建议当地医疗机构暂停41L20A批次的莫德纳COVID-19疫苗的接种工作[615]。
2021年1月,据以色列卫生部表示,在以色列民众接种辉瑞/BioNtech疫苗疫苗后,超过12400人SARS-CoV-2检测呈阳性,而其中有69人已接受第二剂接种[616]。
2021年2月,菲律宾食品与药物管理局局长多明戈称不建议经常暴露在疫情风险中的医护人员接种中国科兴生物疫苗,原因是它对抗冠病的效能仅为50.4%[617]。
截至2021年3月16日,香港2019冠状病毒病疫苗接种计划展开只有两周多,在已接种最少一剂疫苗的16.6万人之中,便有七人在接种中国科兴疫苗后身亡,即每2.4万人接种疫苗后便有一人死亡,香港的死亡率比英美等国的全民接种计划高出最少一倍,死者年龄中位数62岁,亦低于英美[618],惟香港特区政府不认为该等接种人士的死亡与接种疫苗有关[619]。
2025年9月,美国疾病管制与预防中心预防接种咨询委员会(ACIP)公开质疑新冠疫苗的功效与安全,且拒绝明确建议民众接种。该咨询委员会表示,关于是否接种新冠病毒疫苗,应在咨询专业医护人员后作出个人选择。委员会并建议疾控中心敦促医护人员“更明确地提醒疫苗潜在的风险”。[620]
2020年4月底,阿斯利康与牛津大学达成合作后,便开始向参加大规模临床试验的英国志愿者注射AZD1222疫苗。该试验的原计划是为英国的试验参与者注射2剂全剂量的疫苗,但是在注射第1剂后,研究人员注意到一些人出现的副作用比预期的要轻,随后他们回头检查发现第1剂疫苗浓度为标识浓度的一半,因此一些志愿者相当于只注射了半剂量的疫苗。牛津大学决定改变实验计划,将部分志愿者试验剂量改为1.5剂,并称他们与监管机构讨论了这一问题。然而,2020年11月两家机构发声明公布其疫苗有效性为90%时,并未披露这一关键错误。根据阿斯利康说法,只有约2741人接种1.5剂疫苗,约8895人接种2剂疫苗。查塔姆研究所卫生研究员索尔兹伯里称低剂量组的人数少,因此很难确定该组试验数据(90%有效性)是否真实有效,或者只是纯属统计巧合,另外低剂量组中的志愿者没有一人超过55岁,人群年龄偏小也意味着感染COVID-19的风险更小。因此,这很难确定低剂量组有效性达90%,是否受到剂量影响、还是年龄影响。佛罗里达大学生物统计学家迪安(Natalie Dean)则称在披露候选疫苗试验结果的透明度与严谨度上,阿斯利康与牛津大学做得很烂(poor grade)。对此,阿斯利康生物医药研发部执行副总裁潘加洛斯称,“该错误其实无关紧要。”“即使你只相信全剂量、全剂量数据……我们疫苗的有效性也达标了,疫苗获得批准的门槛是疫苗有效性超过60%。”[621][622]
社交媒体上的部分帖子宣扬一种阴谋论,称2019冠状病毒病及其病原体已经为人所知,而且已经有了疫苗。这些社交媒体帖子并引用了一些涉及其他冠状病毒毒株(如SARS冠状病毒)的基因序列和疫苗的专利[623][624]。
研究发现在16个国家中,打足完整疫苗剂量的覆盖率和delta variant病毒序列突变的频率(mutation frequency)有高度的对数负相关(R-square= 0.878)。这个结果指出完整疫苗接种可能可以有效的压抑病毒突变的发生。[625]
2020年10月印度和南非向世界贸易组织建议在2019冠状病毒大流行这个“特殊情况”下豁免《与贸易有关的知识产权协定》某些规定,有助扩大疫苗产能,缓解疫苗供应问题。提案马上遭到美国,欧盟,英国,挪威,瑞士,日本,加拿大,澳大利亚和巴西的反对,之后11月和12月的会议,再次遭到反对。相反有100多个国家支持这个提案。美国贸易代表处表示保护专利才是迅速交付疫苗和有助研究治疗的方法,欧盟表示没有证据表明专利问题对2019冠状病毒病的疫苗和治疗研究造成障碍。《华尔街日报》摘文表示提案是“专利盗窃”[626]。
2021年5月5日美国总统拜登表示支持新冠疫苗专利豁免,欧盟也随后表示认同,立场和之前相反。制药商表示反对,认为提议让他们失去部分收入。德国持反对意见,德国政府发言人称“保护知识产权是创新的源泉,未来也必须加以保持”。《路透社》报导法国总统马克龙表示非常支持豁免专利,虽然有法国官员评论事件“我要提醒你们的是,连一剂疫苗都没向其他国家出口过的美国,现在却在讨论放弃专利”,但报导亦指出美国已向墨西哥和加拿大借出数百万剂阿斯利康疫苗[627]。辉瑞公司透露他和美国白宫签署协议在3月31日之前禁止将美国生产疫苗运输到国外,在4月份才开始向墨西哥出口在美国工厂生产的辉瑞疫苗[628]。除德国外,英国、美国的盟友及美国商界皆反对豁免,全球创新政策中心表示“没有证据”表明豁免知识产权能够提升疫苗产量[629]。世卫组织称美国此举是全球抗疫的“不朽时刻”[630],世卫总干事谭德塞称美国的决定展现出智慧和道德领导力[94][627]。路透社引述一名美国高层官员的消息,指拜登政府的建议引发不少官员及公司担忧,他们担心开放疫苗专利将令中国、俄罗斯等国取得美国生物制药的尖端技术。[631]世界贸易组织总干事恩戈齐·奥孔约-伊卫拉在5月11日表示乐意见到这一议题的进展,世贸将于5月底开会讨论,并就豁免专利、技术转让及让发展中国家更易取得疫苗等议题进行协商,期望可在12月达成框架协议[632]。5月17日,中国外交部发言人赵立坚回应关于疫苗专利豁免问题时,表示中国“完全理解并支持”[633]。
2022年当地时间6月12日至17日,经世界贸易组织第12届部长级会议的多日讨论,宣布达成了包括新冠疫苗知识产权豁免协议在内的诸多协议,而该豁免协议会使南非等发展中国家的公司更容易在有限的情况下生产和出口已获专利的新冠疫苗,如果得到本国政府批准,则无需征得专利持有人的同意[634]。南非、印度、美国、中国等国的贸易代表均对该协议持赞成态度[635]。就此事,美国媒体《华尔街时报》发布名为“拜登送给北京的专利礼物”的评论文章,表示世界贸易组织成为打击美国创新的工具,协议损害美国的知识产权,对美国国家利益造成损害,并表示该协议允许中国等发展中国家窃取新冠疫苗知识产权[636]。美国商会亦发表声明,表示该协议开了个坏头,既阻碍创新、削弱创新公司能力,又不会解决任何阻碍疫苗接种的实际问题[637]。
2021年8月30日中国国药采用新冠灭活疫苗免疫后血浆制备的新冠肺炎特异性治疗药物COVID-19人免疫球蛋白(pH4),被批准开展临床试验。[638]
参考文献
外部链接
参见
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
