热门问题
时间线
聊天
视角
炭疽桿菌
细菌的种类,隶属于芽孢杆菌属,炭疽病的病原体 来自维基百科,自由的百科全书
Remove ads
炭疽芽孢桿菌[1](學名:Bacillus anthracis)簡稱炭疽桿菌、炭疽菌,是一種革蘭氏陽性細菌,呈杆棒狀,是導致炭疽病的病原體,對牲畜尤為致命,有時也會感染人類並對其造成傷亡,為人畜共患病。該菌屬於芽孢桿菌屬。[2] 1876年,德國醫生羅伯特·科赫發現了這種細菌,並成為第一個經實驗證實為病原體的細菌。這一發現也是細菌致病理論的第一個科學證據。[3]

炭疽桿菌長約3至5微米,寬約1至1.2微米。基因組由一個5,227,419 bp的環狀染色體和兩個染色體外脫氧核糖核酸(DNA)質粒組成,pXO1和pXO2分別長約181,677 bp和94,830 bp,[4]其亦是導致致病性的因素。該菌會形成一層為內生孢子的保護層,使其能夠保持多年不活躍狀態,並在合適的環境條件下突然變得具有感染力,例如內生孢子在土壤中,會進入休眠狀態,一旦由牲畜攝入,菌芽孢便開始在動物體內大量複製,最後造成死亡,隨後於屍體中仍能繼續繁殖,而當細菌將宿主養分用盡,又將重回芽孢並進入睡眠態。由於內孢子的韌性,該菌被用於生物武器。細菌的蛋白質莢膜(聚-D-γ-穀氨酸)是逃避免疫反應的關鍵。它利用兩種分泌性鐵載體/鐵結合物蛋白IsdX1和IsdX2,以血液蛋白血紅蛋白中的血紅素為食。

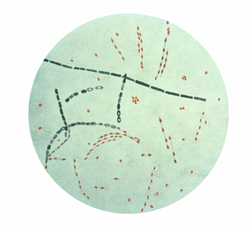
未經治療的炭疽桿菌感染通常是致命的。感染表現為炎症、黑色、壞死性病變(焦痂)。潰瘍通常出現在面部、頸部、手臂或手部。致命症狀包括流感樣發燒、胸部不適、出汗過多和身體疼痛。第一種動物炭疽疫苗是由法國化學家路易·巴斯德於1881年研製的。目前已有多種動物和人類疫苗可用。該感染可用常見抗生素治療,例如青黴素、喹諾酮類和四環素類抗生素。
Remove ads
描述

炭疽桿菌是一種桿狀細菌,長約3至5微米,寬約1至1.2微米。[5] 當在培養中生長時,它們往往會形成長鏈細菌。在瓊脂平板上,它們形成幾毫米寬的大菌落,通常呈白色或奶油色。[5] 大多數炭疽桿菌菌株都會產生莢膜,使菌落呈現粘稠的粘液狀外觀。[5]
它是已知的少數幾種能夠合成弱免疫原性和抗吞噬性蛋白質莢膜(聚-D-γ-穀氨酸)的細菌之一,這種蛋白質莢膜可以將營養細菌隱藏在宿主免疫系統的視野中。[6] 大多數其他細菌物種的莢膜由多糖莢膜包裹,而非聚-γ-D-穀氨酸,這為炭疽芽孢桿菌提供了進化優勢。多糖與中性粒細胞分泌的防禦素粘附有關,這些防禦素可滅活並降解細菌。由於莢膜中不含有這種大分子,炭疽芽孢桿菌可以逃避中性粒細胞的攻擊並繼續傳播感染。莢膜成分的差異也很重要,因為據推測聚-γ-D-穀氨酸會產生負電荷,從而保護細菌的營養期免受宿主巨噬細胞的吞噬。[7] 莢膜降解為較低的分子量並從細菌細胞表面釋放出來,作為誘餌保護細菌免受宿主補體系統攻擊。[8]
與百日咳博德特氏菌 (Bordetella pertussis) 類似,它會形成一種依賴鈣調蛋白的腺苷酸環化酶外毒素,即炭疽水腫因子(炭疽毒素)以及炭疽致死因子內肽酶。它在基因型和表型上與蠟樣芽孢桿菌和蘇雲金芽孢桿菌非常相似。這三個物種具有相同的細胞尺寸和形態。它們均在位於未腫脹的孢子囊中央形成橢圓形孢子。炭疽桿菌的內孢子具有很強的適應能力,能夠在極端溫度、低營養環境和嚴酷化學處理下存活數十年甚至數百年。
內生孢子是一種脫水細胞,具有厚壁和細胞膜內形成的附加層。它可以保持多年不活動狀態,但如果遇到適宜的環境,就會再次開始生長。它最初在桿狀結構內發育。內生孢子在桿狀結構內的位置、大小和形狀,以及是否會導致桿狀結構壁凸出,是某些芽孢桿菌屬物種的特徵。根據物種不同,內生孢子的形狀有圓形、橢圓形,有時也有圓柱形。它們具有高度折射性,並含有皮考啉二酸(吡啶-2,6-二羧酸)。電子顯微切片顯示,它們具有較薄的內孢子外殼、較厚的孢子皮層和包裹內孢子內容物的內部孢子膜。內孢子耐熱、耐乾燥,並耐多種消毒劑(包括95%乙醇)。[9] 由於這些特性,炭疽桿菌內孢子非常適合用作(以粉末和氣霧劑形式)生物武器。過去至少有五個國家的生物武器項目實現了此類武器化,分別是:英國、日本、美國、俄羅斯和伊拉克,並且其他幾個國家也曾嘗試過。[10]
Remove ads
基因組結構
炭疽桿菌具有一條染色體,該染色體是一個環狀DNA分子,由5,227,293個鹼基對組成。[11] 它還包含兩個環狀、染色體外雙鏈DNA質粒:pXO1和pXO2。pXO1和pXO2質粒均為其該菌毒力所必需的,代表了兩個不同的質粒家族。[12]
Remove ads
pXO1質粒(182 kb)包含編碼炭疽毒素成分的基因:pag(保護性抗原,protective antigen,縮寫:PA)、lef(致死因子,lethal factor,縮寫:LF)和cya(水腫因子,edema factor,縮寫:EF)。這些因子位於質粒上一個44.8 kb的致病島/毒力島(pathogenicity island,縮寫PAI)內。致死因子毒素是PA和LF的組合,而水腫因子毒素是PA和EF的組合。PAI還包含編碼轉錄激活因子AtxA和阻遏蛋白PagR的基因,這兩個基因均調控炭疽毒素基因的表達。[12]
pXO2編碼一個由五個基因組成的操縱子 (capBCADE),該操縱子負責合成聚-γ-D-穀氨酸(聚穀氨酸鹽)莢膜。該莢膜使炭疽桿菌能夠通過保護自身免受吞噬作用而逃避宿主免疫系統的攻擊。莢膜操縱子的表達由位於pXO2致病島(35 kb)上的轉錄調控因子AcpA和AcpB激活。pXO1中的AtxA控制AcpA和AcpB的表達。[12]
菌株
已知的89種炭疽桿菌菌株包括:
- 斯特恩菌株(Sterne strain) (34F2;又名「韋布里奇菌株」〔Weybridge strain〕),馬克斯·斯特恩(Max Sterne)在1930年代研發的疫苗中使用過
- 沃勒姆/沃倫菌株,曾被美國、英國和伊拉克武器化;1935年從英國牛津郡的一頭牛身上分離出來
- 沃勒姆M-36,英國研究用的強毒株;在獼猴體內傳播了36次
- 沃勒姆1B,美國和英國在20世紀40年代至60年代將其武器化
- 沃勒姆-14578,用於1942年英國生物武器試驗,嚴重污染了格林亞德島
- V770-NP1-R,用於生物炭疽(BioThrax)疫苗的無毒無莢膜菌株
- 炭疽836(Anthrax 836)是一種劇毒菌株,被蘇聯武器化;1953年在基洛夫州基洛夫發現
- 1981年從德克薩斯州一頭牛身上分離出來的Ames strain;因在2001年美國炭疽信件攻擊中被使用而出名。
- 祖先埃姆斯菌(Ames Ancestor)
- 佛羅里達埃姆斯菌(Ames Florida)
- H9401,從韓國人患者中分離出來;用於研究炭疽疫苗[13]
Remove ads
進化
全基因組測序使得炭疽桿菌系統發育的重建極其重要和準確。促成重建的一個因素是炭疽桿菌的單態性,這意味着其遺傳多樣性較低,包括自其作為一個物種衍生以來缺乏任何可測量的DNA橫向轉移。多樣性的缺乏是由於其進化史較短,導致單核苷酸多態性突變飽和度較低。[14]
進化時間短並不一定意味着時間順序短。DNA複製時會發生錯誤,從而導致基因突變。這些突變隨着時間的推移不斷積累,最終導致物種進化。在炭疽桿菌的生命周期中,它會在土壤孢子庫階段度過相當長的時間,而此時DNA複製不會發生。這些漫長的休眠期大大降低了生物體的進化速度。[14]
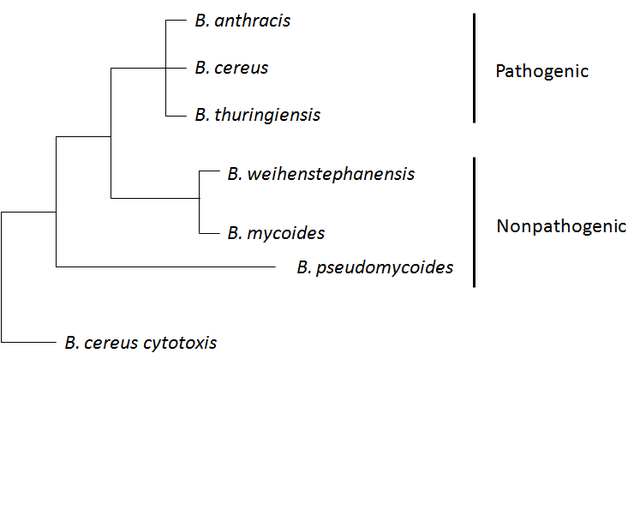
炭疽芽孢桿菌屬於蠟樣芽孢桿菌組,該組包含以下菌株:蠟樣芽孢桿菌、炭疽芽孢桿菌、蘇雲金芽孢桿菌、韋施泰凡芽孢桿菌、蕈狀芽孢桿菌和假蕈狀芽孢桿菌。前三種菌株對昆蟲或哺乳動物具有致病性或機會性,而後三種菌株不被認為具有致病性。該組的菌株在遺傳和表型上總體上存在異質性,但其中一些菌株的親緣關係更密切,並且在染色體水平上存在系統發育混合。蠟樣芽孢桿菌組通常具有複雜的基因組,並且大多數菌株攜帶不同數量的質粒。[12]
蠟狀芽孢桿菌是一種土壤細菌,可以作為共生體在無脊椎動物的腸道中定殖[15] 該菌也是食物中毒的常見原因。[16] 它會產生催吐毒素、腸毒素和其他毒力因子。[17] 腸毒素和毒力因子編碼在染色體上,而催吐毒素編碼在270 kb質粒pCER270上。[12]
蘇雲金芽孢桿菌是一種微生物病原體,其特徵是產生殺蟲毒素Cry和Cyt的伴孢體/伴孢晶體。[18] 編碼這些蛋白質的基因通常位於質粒上,而這些質粒可能會從生物體中丟失,從而使其與蠟樣芽孢桿菌難以區分。[12]
蠟樣芽孢桿菌進化枝的系統基因組學分析結合平均核苷酸同一性(average nucleotide identity,縮寫:ANI)分析表明,炭疽芽孢桿菌物種還包括標註為蠟樣和蘇雲金芽孢桿菌的菌株。[19]
Remove ads
PlcR是一個全局轉錄調控因子,控制着蠟樣芽孢桿菌和蘇雲金芽孢桿菌中大部分分泌的毒力因子。它由染色體編碼,遍布整個細胞。[20] 然而,在炭疽芽孢桿菌中,plcR基因在640位發生了一個鹼基變化,這是一個無義突變,導致蛋白質功能失調。雖然1%的蠟狀芽孢桿菌攜帶失活的plcR基因,但它們中沒有一個攜帶僅在炭疽芽孢桿菌中發現的特定突變。[21]
plcR基因與papR基因共同構成一個雙基因操縱子。[22][23] papR基因編碼一種小蛋白質,該蛋白質從細胞中分泌出來,然後作為加工過的七肽重新導入,形成群體感應系統。[23][24] 炭疽芽孢桿菌缺乏PlcR蛋白,這是其區別於蠟樣芽孢桿菌屬其他成員的一個主要特徵。蠟樣芽孢桿菌和蘇雲金芽孢桿菌依賴plcR基因表達其毒力因子,而炭疽芽孢桿菌則依賴pXO1和pXO2質粒發揮其毒力。[12] 蠟樣芽孢桿菌炭疽生物型變種,即具有兩個質粒的蠟樣芽孢桿菌,也能引起炭疽病。
Remove ads
臨床方面
炭疽桿菌擁有抗吞噬莢膜,這對於其強毒性至關重要。該菌還產生三種質粒編碼的外毒素:水腫因子,一種鈣調蛋白依賴的腺苷酸環化酶,可導致細胞內環腺苷酸(cAMP)升高,並導致炭疽桿菌感染中常見的嚴重水腫;致死毒素,可導致組織壞死;以及保護性抗原,因其用於生產保護性炭疽疫苗而得名,它介導水腫因子和致死毒素進入細胞。
炭疽病的症狀取決於感染類型,發病時間從1天到2個月以上不等。所有類型的炭疽病,如果不及時治療,都有可能擴散至全身,導致嚴重疾病,甚至死亡。[25]
根據炭疽病的入侵門戶,可將其分為四種類型。
- 皮膚型是最常見的類型(95%),會導致局部炎症性、黑色壞死性病變(焦痂)。潰瘍通常出現在面部、頸部、手臂或手部。感染後1—7天內可能出現。
- 吸入型是一種罕見但極其致命的疾病,其特徵是類似流感的症狀、胸部不適、出汗和身體疼痛。[25] 通常發生在暴露一周後顯現,但最多可能需要兩個月的時間。
- 胃腸道型是一種罕見但致命的感染類型(導致25%的死亡),由攝入孢子引起。症狀包括:發燒和發冷、頸部腫脹、吞咽疼痛、聲音嘶啞、噁心和嘔吐(尤其是嘔血)、腹瀉、眼睛潮紅以及腹部腫脹。[25] 症狀可能在1—7天內出現
- 注射性炭疽病的症狀與皮膚炭疽病相似,但注射性炭疽病可以更快地擴散到全身,並且與皮膚炭疽病相比更難識別和治療。[25] 症狀包括發燒、發冷、病原體注射部位出現一團可能發癢的小腫塊或水疱。水疱或腫塊後出現中心呈黑色的無痛性潰瘍。潰瘍周圍腫脹。病原體注射部位的皮下或肌肉深處出現膿腫。美國從未發現過此類病例。
Remove ads
目前已研發出多種用於預防牲畜和人類感染的炭疽疫苗。吸附炭疽疫苗可預防皮膚炭疽和吸入炭疽。然而,該疫苗僅適用於接觸炭疽病前的高危成年人,尚未獲准在接觸炭疽病後使用。[26] 炭疽桿菌感染可用β-內酰胺抗生素如青黴素和其它對抗革蘭氏陽性菌有效的藥物治療。[27] 耐青黴素的炭疽桿菌可用氟喹諾酮類藥物(如環丙沙星)或四環素類抗生素(如多西環素)治療。
實驗室研究
茶中的成分,例如茶中的多酚,能夠顯著抑制炭疽桿菌及其毒素的活性;然而,孢子卻不受影響。在茶中加入牛奶會完全抑制其對抗炭疽的抗菌活性。 [28] 在實驗室中針對炭疽桿菌的活動並不能證明喝茶會影響感染過程,因為尚不清楚這些多酚如何在體內吸收和分布。炭疽桿菌可以在PLET瓊脂上培養,這是一種專門用於選擇炭疽桿菌的選擇性鑑別培養基。
基因分型方法的進步使得對變異和關聯性的遺傳分析更加完善。這些方法包括多位點可變數目串聯重複序列分析 (Multiple loci VNTR analysis,縮寫:MLVA) 和基於典型單核苷酸多態性的分型系統。埃姆斯祖先菌染色體於2003年測序[11] 並有助於識別與炭疽桿菌毒力有關的基因。近期,韓國一名患有胃腸道炭疽病的患者體內分離出一株炭疽桿菌分離株H9401。韓國的目標是利用該菌株作為攻毒菌株,研發針對炭疽病的重組疫苗。 [13]
使用454 GS-FLX技術對韓國分離的H9401菌株進行測序,並使用多種生物信息學工具進行分析,以比對、注釋和比較H9401與其他炭疽桿菌菌株。測序覆蓋度表明,pXO1:pXO2:染色體的分子比為3:2:1,與埃姆斯佛羅里達菌株和埃姆斯祖先菌株相同。H9401與埃姆斯祖先的序列同源性為99.679%,氨基酸序列同源性為99.870%。H9401具有環狀染色體(5,218,947 bp,預測5,480個 開放閱讀框(ORF)),pXO1質粒(181,700 bp,預測202個ORF)和pXO2質粒(94,824 bp,預測110 個ORF)。[13] 與上述埃姆斯祖先染色體相比,H9401染色體約短8.5 kb。由於H9401具有較高的致病性,且與埃姆斯祖先染色體序列相似,韓國將以H9401作為參考,用於測試候選炭疽疫苗的有效性。[13]
自從炭疽桿菌基因組測序以來,人們一直在探索對抗這種疾病的替代方法。細菌已經發展出多種策略來逃避免疫系統的識別。所有細菌都採用的主要逃避檢測機制是分子偽裝。外層細胞的細微修飾使細菌幾乎無法被溶菌酶識別。[29] 其中三種修飾已被鑑定和表徵。它們包括:(1) N-乙酰胞壁酸的N-糖基化,(2)N-乙酰胞壁酸的O-乙酰化,以及(3)N-乙酰葡萄糖胺的N-脫乙酰化。近年來的研究重點是抑制此類修飾。[30] 因此,人們正在研究多糖脫乙酰酶的酶促機制,該酶可催化從肽聚糖層的成分N-乙酰葡萄糖胺和N-乙酰胞壁酸中去除乙酰基。
宿主相互作用
與大多數其他致病細菌一樣,炭疽桿菌必須獲取鐵才能在其宿主環境中生長繁殖。對於致病細菌來說,最容易獲得的鐵來源是宿主用於運輸氧氣的血紅素基團。為了從宿主的血紅蛋白和肌紅蛋白中清除血紅素,炭疽桿菌使用兩種分泌性鐵載體蛋白,IsdX1和IsdX2。這些蛋白可以將血紅素從血紅蛋白中分離出來,從而使炭疽桿菌的表面蛋白能夠將其運送到細胞內。[31]
炭疽桿菌必須逃避免疫系統才能成功感染。炭疽桿菌孢子一旦進入宿主就會立即被巨噬細胞和樹突狀細胞吞噬。樹突狀細胞可以通過有效的細胞內消除來控制感染,但是巨噬細胞可以通過穿過一層薄薄的上皮細胞或內皮細胞將細菌直接運送到宿主體內,到達循環系統。[32]通常情況下,在吞噬過程中,病原體被巨噬細胞內化後會被消化。然而,炭疽芽孢並沒有被降解,而是劫持了巨噬細胞的功能,逃避宿主免疫系統的識別。當吞噬細胞細胞外膜上的跨膜受體與孢子表面的分子相互作用時,炭疽桿菌孢子的吞噬作用就開始了。CD14是一種嵌入宿主膜的細胞外蛋白,它與炭疽芽孢桿菌外孢壁的糖蛋白BclA的鼠李糖 殘基結合,從而促進整合素Mac-1由內向外的激活,增強巨噬細胞對孢子的內化。這種級聯反應導致吞噬細胞激活並引發炎症反應。[33]
採樣
可以通過在無孔表面採集的樣本來確定炭疽桿菌的存在。
-
如何在無孔表面用纖維素海綿取樣
-
如何使用大泡沫拭子(棉簽)在無孔表面取樣
歷史背景

法國醫生卡西米爾·達韋納證明炭疽病的症狀總是伴隨着微生物炭疽桿菌。[34] 德國醫生阿洛伊斯·波倫德因發現炭疽桿菌而受到讚譽。1876年,羅伯特·科赫證實炭疽桿菌是第一個能夠致病的細菌。[35] 細菌的種加詞「anthracis」來自希臘語「anthrax」(ἄνθραξ),意思是「煤」,指該疾病最常見的形式——皮膚型炭疽病,會形成大片黑色的皮膚病變。在整個19世紀,炭疽病是一種與醫學發展密切相關的傳染病。第一種含活菌的疫苗是路易·巴斯德發明的獸用炭疽疫苗。[36]
參閱
參考文獻
延伸閱讀
外部連結
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads