热门问题
时间线
聊天
视角
Β-連環蛋白
来自维基百科,自由的百科全书
Remove ads
β-連環蛋白(β-catenin),也叫連環蛋白β-1(Catenin beta-1),是一種雙重功能蛋白質,參與細胞-細胞黏附和基因轉錄的調節和協調。在人類中,β-連環蛋白由CTNNB1基因編碼。[6][7]在果蠅中,同源蛋白稱為犰狳(armadillo)。β-連環蛋白是鈣黏素蛋白錯合物的一個亞基,在Wnt信號通路中充當細胞內訊息傳遞子。[8][9][10]它是連環蛋白家族的成員,與γ-連環蛋白(也稱為斑珠蛋白)同源。 β-連環蛋白在許多組織中廣泛表現。在心肌中,β-連環蛋白定位於閏盤結構中的黏著連接處,這對於相鄰心肌細胞之間的電和機械耦合至關重要。
β-連環蛋白的突變和過表現與許多癌症有關,包括肝細胞癌、結直腸癌、肺癌、惡性乳腺腫瘤、卵巢癌和子宮內膜癌。[11]β-連環蛋白的定位和表現水平的改變與各種形式的心臟病有關,包括擴張型心肌病。β-連環蛋白由β-連環蛋白破壞錯合物調節和破壞,特別是由腫瘤抑制APC基因編碼的腺瘤性結腸息肉(APC)蛋白調節和破壞。因此,APC基因的基因突變也與癌症密切相關,特別是由家族性腺瘤性息肉病(FAP)引起的結直腸癌。
Remove ads
發現
β-連環蛋白最初是在1990年代初期作為哺乳動物細胞黏附錯合物的一種成分被發現的:一種負責細胞質錨定鈣黏素的蛋白質。[12]但很快,人們意識到果蠅蛋白犰狳——參與介導Wingless/Wnt的形態發生效應——不僅在結構上與哺乳動物β-連環蛋白同源,而且在功能上也是同源。[13]因此,β-連環蛋白成為最早的兼職蛋白例子之一:一種執行不止一種完全不同的細胞功能的蛋白質。
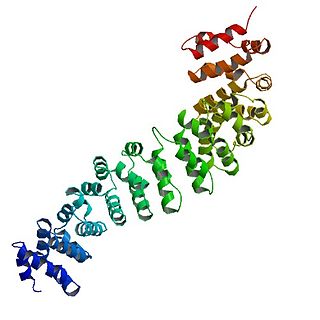
結構
β-連環蛋白的核心由幾個非常有特徵的重複序列組成,每個重複序列大約40個胺基酸長。稱為犰狳重複序列,所有這些元素摺疊在一起形成一個具有細長形狀的單一剛性蛋白質結構域,稱為犰狳(ARM)結構域。一個平均的犰狳重複由三個α螺旋組成。β-連環蛋白的第一個重複(靠近N端)與其他的略有不同——因為它有一個帶有扭結的細長螺旋,由螺旋1和2融合形成。[14]由於單個重複的形狀複雜,整個ARM域不是直杆:它具有輕微的曲率,因此形成了外(凸)和內(凹)表面。該內表面用作ARM結構域的各種相互作用夥伴的配位基結合位點。

ARM域的N端和遠C端段本身在解中不採用任何結構。然而,這些本質上無序的區域在β-連環蛋白功能中起著至關重要的作用。N端天然無序區域包含一個保守的短線性基序,負責結合TrCP1(也稱為β-TrCP)E3泛素連接酶,但僅在它被磷酸化時。因此,β-連環蛋白的降解是由這個N末端片段介導的。另一方面,當C末端區域被招募到DNA上時,它是一個強大的反式活化因子。這個片段不是完全無序的:C末端延伸的一部分形成了一個穩定的螺旋,它與ARM結構域相結合,但也可能與單獨的結合夥伴結合。[15]這個小的結構元件(HelixC)覆蓋了ARM結構域的C末端,遮蔽了它的疏水殘基。β-連環蛋白不需要HelixC在細胞間黏附中發揮作用,但Wnt信號需要它:可能招募各種共活化因子,例如14-3-3zeta。[16]然而,它在一般轉錄錯合物中的確切夥伴仍不完全清楚,它們可能涉及組織特異性參與者。[17]值得注意的是,如果人工融合到LEF1轉錄因子的DNA結合域,β-連環蛋白的C端片段可以模擬整個Wnt信號通路的作用。[18]
斑珠蛋白(也稱為γ-連環蛋白)具有與β-連環蛋白驚人相似的結構。不僅它們的ARM結構域在結構和配位基結合能力方面彼此相似,而且N端β-TrCP結合基序在斑珠蛋白中也是保守的,這意味著共同的祖先和與β-連環蛋白的共同調控。[19]然而,當與DNA結合時,斑珠蛋白是一種非常弱的反式活化因子——這可能是由於它們的C末端序列的分歧造成的(斑珠蛋白似乎缺乏反式活化因子基序,因此抑制Wnt通路靶基因而不是活化它們)。[20]

如上所示,β-連環蛋白的ARM結構域充當特定線性基序可能結合的平台。位於結構多樣的夥伴中,β-連環蛋白結合基序通常本身是無序的,並且通常在ARM結構域接合時採用剛性結構——如短線性基序所見。然而,β-連環蛋白相互作用的基序也具有許多獨特的特徵。首先,它們的長度可能達到甚至超過30個胺基酸的長度,並在過大的表面積上與ARM結構域接觸。這些基序的另一個不同尋常的特徵是它們經常高度磷酸化。此類Ser/Thr磷酸化事件極大地增強了許多β-連環蛋白相關基序與ARM結構域的結合。[21]
β-連環蛋白在錯合物中的結構與轉錄反式活化夥伴TCF的連環蛋白結合域提供了有多少β-連環蛋白的結合夥伴可能形成相互作用的初始結構路線圖。[22]這種結構證明了TCF原本無序的N末端如何適應看似剛性的構象,結合基序跨越許多β-連環蛋白重複。定義了相對強的帶電相互作用「熱點」(預測並隨後驗證,對於β-連環蛋白/E-鈣黏蛋白相互作用是保守的),以及被認為在整體結合模式中重要的疏水區域和潛在的治療小分子抑制劑針對某些癌症形式。此外,以下研究證明了另一個獨特的特徵,即TCF的N末端與β-連環蛋白結合的可塑性。[23][24]
同樣,我們發現了熟悉的E-鈣黏蛋白,其細胞質尾部以相同的規範方式與ARM結構域接觸。[25]支架蛋白質軸蛋白(兩個密切相關的旁系同源物軸蛋白1和軸蛋白2)在其長而無序的中間部分包含類似的相互作用基序。[26]儘管一個軸蛋白分子僅包含一個β-連環蛋白募集基序,但其家族性腺瘤性息肉病(FAP)蛋白每個原體含有11個串聯排列的此類基序,因此能夠同時與多個β-連環蛋白分子相互作用。[27]由於ARM結構域的表面在任何給定時間通常只能容納一個肽基序,因此所有這些蛋白質都競爭相同的β-連環蛋白分子細胞池。這個比賽是了解Wnt信號通路如何工作的關鍵。
然而,ARM結構域β-連環蛋白上的這個「主要」結合位點絕不是唯一的。ARM結構域的第一個螺旋形成了一個額外的、特殊的蛋白質-蛋白質相互作用口袋:這可以容納在共活化因子BCL9(或密切相關的BCL9L)中發現的螺旋形成線性基序,一種參與Wnt信號傳導的重要蛋白質。[28]雖然精確的細節不太清楚,但當β-連環蛋白定位於黏附連接時,α-連環蛋白似乎使用了相同的位點。[29]因為這個口袋不同於ARM結構域的「主要」結合位點,α-連環蛋白和E-鈣黏蛋白之間或TCF1和BCL9之間分別沒有競爭。[30]另一方面,BCL9和BCL9L必須與α-連環蛋白競爭以獲取β-連環蛋白分子。[31]
Remove ads
功能
β-連環蛋白的細胞水平主要受其泛素化和蛋白酶體降解的控制。 E3泛素連接酶TrCP1(也稱為β-TrCP)可以通過無序N末端上的短線性基序將β-連環蛋白識別為其受質。然而,β-連環蛋白的這個基序(Asp-Ser-Gly-Ile-His-Ser)需要在兩個絲胺酸上被磷酸化才能結合β-TrCP。基序的磷酸化由肝糖合酶激酶3α和β(GSK-3α和GSK-3β)進行。GSK-3是組成型活性酶,涉及幾個重要的調節過程。不過,有一個要求:GSK-3的受質需要在實際靶位點下游(C端)的四個胺基酸進行預磷酸化。因此,它的活性還需要「啟動激酶」。在β-連環蛋白的情況下,最重要的啟動激酶是酪蛋白激酶1。一旦「引發」了富含絲胺酸-蘇胺酸的受質,GSK-3就可以從C端到N端方向「穿過」它,連續磷酸化每4個絲胺酸或蘇胺酸殘基。該過程也將導致上述β-TrCP識別基序的雙重磷酸化。
GSK-3要成為受質上的高效激酶,預磷酸化是不夠的。還有一個額外的要求:與絲裂原活化蛋白激酶(MAPK)類似,受質需要通過高親和力對接基序與這種酶結合。β-連環蛋白不包含這樣的基序,但一種特殊的蛋白質包含:軸蛋白。更重要的是,它的GSK3對接基序與β-連環蛋白結合基序直接相鄰。[26]通過這種方式,軸蛋白充當了真正的支架蛋白質,將酶(GSK-3)與其受質(β-連環蛋白)結合在一起,在物理上非常接近。

但即使軸蛋白也不會單獨行動。通過其G蛋白信號調節因子(RGS)結構域的N端調節劑,它招募結腸腺瘤性息肉病(APC)蛋白。APC就像一棵巨大的「聖誕樹」:擁有眾多的β-連環蛋白結合基序(一個APC分子單獨擁有11個這樣的基序[27]),它可以收集儘可能多的β-連環蛋白分子。[32]APC可以同時與多個軸蛋白分子相互作用,因為它具有三個SAMP基序(Ser-Ala-Met-Pro)以結合軸蛋白中的RGS結構域。此外,軸蛋白還具有通過其C端DIX結構域寡聚化的潛力。結果是一個巨大的、多聚體的蛋白質體裝體,專門用於β-連環蛋白磷酸化。這種錯合物通常稱為β-連環蛋白破壞錯合物,儘管它與實際負責β-連環蛋白降解的蛋白酶體機制不同。[33]它僅標記β-連環蛋白分子以進行後續破壞。
Remove ads
在靜息細胞中,軸蛋白分子通過它們的C端DIX結構域相互寡聚化,DIX結構域具有兩個結合界面。因此,它們可以在細胞質內構建線性低聚物甚至聚合物。DIX結構域是獨特的:已知具有DIX結構域的唯一其他蛋白質是散亂蛋白和DIXDC1(果蠅的單個散亂蛋白對應於哺乳動物中的三個旁系同源基因Dvl1、Dvl2和Dvl3)。散亂蛋白與捲曲受體的細胞質區域及其PDZ和DEP結構域相關聯。當Wnt分子與捲曲受體結合時,它會引發一連串鮮為人知的事件,從而導致散亂蛋白的DIX結構域暴露,並為軸蛋白創建一個完美的結合位點。然後通過Dsh將軸蛋白從其寡聚組裝體(β-連環蛋白破壞錯合物)中滴定出來。[34]一旦與受體錯合物結合,軸蛋白將無法結合β-連環蛋白和GSK-3活性。重要的是,捲曲蛋白相關的LRP5和LRP6蛋白的細胞質片段包含GSK-3假受質序列(Pro-Pro-Pro-Ser-Pro-x-Ser),由酪蛋白激酶1適當地「引發」(預磷酸化),好像它是GSK-3的真正受質。這些錯誤的目標位點以競爭方式極大地抑制了GSK-3的活性。[35]通過這種方式,受體結合軸蛋白將消除介導β-連環蛋白的磷酸化。由於β-連環蛋白不再被標記為破壞,而是繼續產生,其濃度將增加。一旦β-連環蛋白水平升高到足以使細胞質中的所有結合位點飽和,它也會轉移到細胞核中。在與轉錄因子LEF1、TCF1、TCF2或TCF3結合後,β-連環蛋白會迫使它們脫離之前的夥伴:Groucho蛋白。與招募轉錄抑制子(例如組織蛋白-離胺酸甲基轉移酶)的Groucho不同,β-連環蛋白將結合轉錄活化因子,開啟靶基因。
Remove ads

細胞-細胞黏附錯合物對於複雜動物組織的形成至關重要。 β-連環蛋白是形成黏附連接的蛋白質複合體的一部分。[36]這些細胞-細胞黏附錯合物對於上皮細胞層和屏障的產生和維持是必需的。作為錯合物的組成部分,β-連環蛋白可以調節細胞生長和細胞間的黏附。它還可能負責傳遞接觸抑制信號,一旦上皮層完成,就會導致細胞停止分裂。[37]E-鈣黏蛋白-β-連環蛋白-α-連環蛋白錯合物與肌動蛋白絲弱相關。黏附連接需要顯著的蛋白質動力學才能連接到肌動蛋白血球骨架,[36]從而實現機械力轉導。[38][39]
黏附連接的一個重要組成部分是鈣黏蛋白。鈣黏蛋白形成稱為黏附連接的細胞-細胞連接結構以及橋粒。鈣黏蛋白能夠通過其細胞外鈣黏蛋白重複結構域以Ca2+依賴性方式進行同源性相互作用;這可以將相鄰的上皮細胞保持在一起。在黏附連接處,鈣黏蛋白將β-連環蛋白分子募集到其細胞內區域。[需要解釋]反過來,β-連環蛋白與另一種高度動態的蛋白質α-連環蛋白結合,後者直接與肌動蛋白絲結合。[40]這是可能的,因為α-連環蛋白和鈣黏蛋白在不同的位點與β-連環蛋白結合。[41]因此,β-連環蛋白-α-連環蛋白錯合物可以在鈣黏蛋白和肌動蛋白血球骨架之間形成物理橋梁。[42]鈣黏蛋白-連環蛋白錯合物的組織還通過其成分的磷酸化和胞吞作用進行調節。[來源請求]
β-連環蛋白在指導幾個發育過程中起著核心作用,因為它可以直接結合轉錄因子並受可擴散的細胞外物質Wnt的調節。它作用於早期胚胎以誘導整個身體區域以及發育後期的單個細胞。它還調節生理再生過程。
Wnt信號和β-連環蛋白依賴性基因表現在早期胚胎不同身體區域的形成過程中起關鍵作用。不表現這種蛋白質的實驗性改良胚胎將無法發育中胚層並啟動原腸胚形成。[43]在囊胚和原腸胚階段,Wnt以及骨塑型蛋白和纖維母細胞生長因子通路將誘導前後軸形成,調節原始條紋的精確位置(原腸胚形成和中胚層形成)以及神經形成過程(中樞神經系統發育)。[44]
在爪蟾卵母細胞中,β-連環蛋白最初同樣定位於卵子的所有區域,但它被 β-連環蛋白破壞錯合物靶向泛素化和降解。卵子的受精導致外皮層旋轉,將捲曲蛋白和散亂蛋白簇移動到更靠近赤道區域的位置。在Wnt信號通路的影響下,β-連環蛋白會在繼承這部分細胞質的細胞中局部富集。它最終會轉移到細胞核以結合TCF3以活化幾個誘導背側細胞特徵的基因。[45]這種信號傳導導致了一個被稱為灰色新月體的細胞區域,它是胚胎發育的經典組織者。如果通過手術從胚胎中移除該區域,則根本不會發生原腸胚形成。 β-連環蛋白在胚孔唇的誘導中也起著至關重要的作用,這反過來又會引發原腸胚形成。[46]通過注射反義mRNA抑制GSK-3轉譯可能會導致形成第二個胚孔和多餘的體軸。 β-連環蛋白的過表現也會產生類似的效果。[47]
Remove ads
β-連環蛋白還涉及通過模式生物秀麗隱杆線蟲中的不對稱細胞分裂調節細胞命運。與爪蟾卵母細胞類似,這本質上是母細胞細胞質中散亂蛋白、捲曲受體、軸蛋白和APC分布不均的結果。[48]
Wnt信號傳導和某些細胞類型中β-連環蛋白水平升高的最重要結果之一是維持多潛能性。[44]在其他細胞類型和發育階段,β-連環蛋白可能促進分化,尤其是向中胚層細胞譜系分化。
β-連環蛋白還在胚胎發育的後期充當形態發生素。與TGF-β一起,β-連環蛋白的一個重要作用是誘導上皮細胞的形態發生變化。它促使它們放棄緊密的黏附,並呈現出更具流動性和鬆散關聯的間充質表型。在此過程中,上皮細胞會失去E-鈣黏素、緊密連接蛋白1(ZO-1)和細胞角蛋白等蛋白質的表現。同時,它們開啟波形蛋白、α平滑肌肌動蛋白(ACTA2)和纖維母細胞特異性蛋白1 (FSP1) 的表現。它們還產生細胞外基質成分,例如I型膠原蛋白和纖連蛋白。Wnt通路的異常活化與纖維化和癌症等病理過程有關。[49]在心肌發育中,β-連環蛋白發揮雙相作用。最初,Wnt/β-連環蛋白的活化對於間充質細胞進入心臟譜系至關重要。然而,在發育的後期階段,β-連環蛋白的下調是必需的。[50][51][43]
在心肌中,β-連環蛋白與N-鈣黏蛋白在閏盤結構內的黏附連接處形成錯合物,負責相鄰心肌細胞的電氣和機械耦合。對成年大鼠心室心肌細胞模型的研究表明,β-連環蛋白的出現和分布在培養中這些細胞的再分化過程中受到時空調節。具體來說,β-連環蛋白是具有N-鈣黏蛋白和α-連環蛋白的獨特錯合物的一部分,在心肌細胞分離後的早期階段,它在黏附連接處豐富,以重建細胞-細胞接觸。[52]已經表明,β-連環蛋白在閏盤內的黏附連接處的心肌細胞中與艾默里蛋白形成錯合物。這種相互作用取決於β-連環蛋白上GSK-3β磷酸化位點的存在。敲除埃默里蛋白顯著改變了β-連環蛋白定位和整體閏盤結構,類似於擴張型心肌病表型。[53]
在心臟病的動物模型中,β-連環蛋白的功能已被揭示。在主動脈瓣狹窄和左心室肥大的豚鼠模型中,儘管β-連環蛋白的整體細胞豐度沒有變化,但β-連環蛋白被證明可以改變從閏盤到胞質溶膠的亞細胞定位。紐蛋白顯示出類似的變化情況。N-鈣黏蛋白沒有變化,在沒有β-連環蛋白的情況下,閏盤處的斑珠蛋白沒有代償性上調。[54]在心肌病和心力衰竭的倉鼠模型中,細胞-細胞黏附不規則且雜亂無章,黏附連接/閏盤和β-連環蛋白的細胞核池的表現水平降低。[55]這些資料表明,β-連環蛋白的丟失可能在與心肌肥大和心力衰竭相關的患病閏盤中起作用。在心肌梗塞的大鼠模型中,非磷酸化的組成型活性β-連環蛋白的腺病毒基因轉移降低了心肌梗塞的大小,活化了細胞週期,並減少了心肌細胞和心肌纖維母細胞的凋亡量。這一發現與促存活蛋白、生存素和Bcl-2以及血管內皮生長因子的表現增強相一致,同時促進了心臟纖維母細胞向肌纖維母細胞的分化。這些發現表明,β-連環蛋白可以促進心肌梗塞後的再生和癒合過程。[56]在自發性高血壓心力衰竭大鼠模型中,研究人員檢測到β-連環蛋白從閏盤/肌膜穿梭到細胞核,這可以通過膜蛋白部分中β-連環蛋白表現的減少和核部分的增加來證明。此外,他們發現GSK-3β和β-連環蛋白之間的關聯減弱,這可能表明蛋白質穩定性發生了改變。總體而言,結果表明增強的β-連環蛋白核定位可能在心臟肥大的進展中很重要。[57]
關於β-連環蛋白在心臟肥大中的機製作用,基因轉移小鼠研究表明,關於β-連環蛋白上調是有益還是有害的結果有些矛盾。[58][59][60]最近一項使用條件性敲除小鼠的研究,要麼完全缺乏β-連環蛋白,要麼在心肌細胞中表現不可降解形式的β-連環蛋白,從而調和了這些差異的潛在原因。這似乎對β-連環蛋白在心肌中的亞細胞定位有嚴格的控制。缺乏β-連環蛋白的小鼠在左心室心肌中沒有明顯的表型;然而,攜帶穩定形式的β-連環蛋白的小鼠發展為擴張型心肌病,這表明通過蛋白質降解機制對β-連環蛋白的時間調節對於心臟細胞中β-連環蛋白的正常功能至關重要。[61]在一個小鼠模型中,敲除與致心律不整性右心室心肌病有關的橋粒蛋白、斑珠蛋白,β-連環蛋白的穩定性也得到了增強,可能是為了彌補其斑珠蛋白同系物的損失。這些變化與Akt活化和GSK-3β抑制相協調,再次表明β-連環蛋白的異常穩定可能與心肌病的發展有關。[62]對斑珠蛋白和β-連環蛋白進行雙重敲除的進一步研究表明,雙重敲除會導致心肌病、纖維化和心律不整,從而導致心源性猝死。閏盤結構嚴重受損,連接蛋白43駐留間隙連接明顯減少。心電圖測量在雙基因轉移動物中捕獲了自發性致死性室性心律不整,這表明兩種連環蛋白——β-連環蛋白和斑珠蛋白對於心肌細胞中的機械電耦合至關重要且必不可少。[63]
臨床意義
根據西奈山伊坎醫學院於2014年11月12日發表在《自然》雜誌上的一項研究,一個特定個體的大腦是否能夠有效地應對壓力以及他們對抑鬱症的易感性,取決於每個人大腦中的β-連環蛋白。[64]較高的β-連環蛋白信號會增加行為靈活性,而有缺陷的β-連環蛋白信號會導致抑鬱和壓力管理減少。[64]
β-連環蛋白中改變的表現譜與人類擴張型心肌病有關。通常在擴張型心肌病患者中觀察β-連環蛋白表現上調。[65]在一項特定的研究中,終末期擴張型心肌病患者的雌激素受體α(ER-α)mRNA和蛋白質水平幾乎翻了一番,並且ER-α/β-連環蛋白相互作用,存在於對照、非患病人類的閏盤上心臟丟失,表明閏盤處這種相互作用的喪失可能在心力衰竭的進展中起作用。[66]與BCL9和PYGO蛋白一起,β-連環蛋白協調聽覺發育的不同方面,模型生物(如小鼠和斑馬魚)中Bcl9或Pygo的突變導致與人類先天性心臟病非常相似的表型。[67]

β-連環蛋白是一種原癌基因。該基因的突變常見於多種癌症中:原發性肝細胞癌、大腸癌、卵巢癌、乳癌、肺癌和膠質母細胞瘤。據估計,從所有癌症中定序的所有組織樣本中約有10%顯示CTNNB1基因突變。[68]大多數這些突變聚集在β-連環蛋白N末端片段的一小塊區域:β-TrCP結合基序。該基序的功能喪失突變基本上使β-連環蛋白的泛素化和降解成為不可能。它將導致β-連環蛋白在沒有任何外部刺激的情況下易位至細胞核並持續驅動其靶基因的轉錄。在基底細胞癌、[69]頭頸部鱗狀細胞癌、前列腺癌、[70]毛母質瘤[71]和髓母細胞瘤[72]中也注意到細胞核β-連環蛋白水平升高。這些觀察結果可能或不暗示β-連環蛋白基因的突變:其他Wnt通路成分也可能有缺陷。
在APC的β-連環蛋白募集基序中也經常看到類似的突變。APC的遺傳性功能喪失突變導致稱為家族性腺瘤性息肉病的病症。受影響的個體在其大腸中長出數百個息肉。這些息肉多數本質上是良性的,但隨著時間的推移,它們有可能轉變為致命的癌症。大腸癌中APC的體細胞突變也並不少見。[73]β-連環蛋白和APC是參與大腸癌發展的關鍵基因(連同其他基因,如K-Ras和SMAD4)。β-連環蛋白將受影響細胞的先前上皮表型改變為侵襲性間充質樣類型的潛力極大地促進了轉移的形成。
由於其參與癌症發展,β-連環蛋白的抑制作用繼續受到極大關注。但是,由於其廣泛且相對平坦的表面,在其犰狳結構域上定位結合位點並不是最簡單的任務。然而,與該表面的較小「熱點」結合就足夠有效抑制它了。這樣一來,源自LEF1中發現的天然β-連環蛋白結合基序的「釘合」螺旋肽足以完全抑制β-連環蛋白依賴性轉錄。最近,幾種小分子化合物被研發來靶向ARM結構域的相同的高正電荷區域(CGP049090、PKF118-310、PKF115-584 和 ZTM000990)。此外,β-連環蛋白水平也可以通過靶向Wnt通路的上游組分以及β-連環蛋白破壞錯合物來影響。[74]額外的N端結合口袋對於Wnt靶基因活化(BCL9募集所需)也很重要。例如,ARM結構域的這個位點可以被鼠尾草酸作為藥理學目標。[75]該「輔助」站點是藥物開發的另一個有吸引力的目標。[76]儘管進行了深入的臨床前研究,但尚無β-連環蛋白抑制劑可用作治療劑。然而,它的功能可以通過基於獨立驗證的siRNA敲低來進一步檢查。[77]另一種減少β-連環蛋白核積累的治療方法是通過抑制半乳糖凝集素3。[78]半乳糖凝集素3抑制劑GR-MD-02目前正在與FDA批准的伊匹木單抗劑量聯合用於晚期黑色素瘤患者的臨床試驗。[79]蛋白質BCL9和BCL9L已被提議作為呈現過度活化的Wnt信號傳導的結腸直腸癌的治療靶標,因為它們的缺失不會干擾正常的體內平衡,但會強烈影響遠端轉移行為。[80]
乙醇引起的β-連環蛋白不穩定是兩種已知途徑之一,酒精暴露會導致胎兒酒精譜系障礙(另一種是乙醇誘導的葉酸缺乏症)。乙醇通過G蛋白依賴性途徑導致β-連環蛋白失穩,其中活化的磷脂酶Cβ將4,5-二磷酸磷脂醯肌醇水解為二酸甘油酯和1,4,5-三磷酸肌醇。可溶性1,4,5-三磷酸肌醇觸發鈣從內質網釋放。這種細胞質鈣的突然增加會活化鈣離子/鈣調素依賴性蛋白激酶 (CaMK)。活化的CaMK通過一個表徵不佳的機制使β-連環蛋白不穩定,但這可能涉及CaMK對β-連環蛋白的磷酸化。 β-連環蛋白轉錄程式(正常神經皺褶細胞發育所需)因此被抑制,導致神經皺褶細胞過早凋亡(細胞死亡)。[81]
相互作用
β-連環蛋白已被證明能與以下物質相互作用:
- APC[82][83][84][85][86][87][88][89]
- AXIN1[90][91]
- CBY1[92]
- CDH1[25][83][93][94][95][96][97][98][99][100][101][102][103][104][105][106][107][108][109][110][111][112][113]
- CDH2[52][114][115]
- CDH3[112][116]
- CDH5[117][118]
- CDK5R1[119]
- CHUK[120]
- CTNND1[83][98]
- CTNNA1[94][103][121][122][123]
- EGFR[98][107][124]
- ESR1[66]
- FHL2[125]
- GSK3B[85][126]
- HER2/neu[99][124][127]
- HNF4A[128]
- IKK2[120]
- LEF1[129][130][131][132]包括基因轉移的[133]
- MAGI1[108]
- MUC1[100][134][135][136][137][138][139]
- NR5A1[140][141]
- PCAF[142]
- PHF17[143]
- PTPN14[144]
- PTPRF[99][145]
- PTPRK[146]
- PTPRT[147]
- PTPRU[148][149][150]
- PSEN1[151][152][153]
- PTK7[154]
- RUVBL1[155]
- SMAD7[129]
- SMARCA4[156]
- SLC9A3R1[102]
- USP9X[157]
- XIRP1[158]
- 雄激素受體[159][160][161][162][128][163]
- 埃默里蛋白[164][165]
- 斑珠蛋白[83][98]
參見
- 連環蛋白
參考文獻
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads