热门问题
时间线
聊天
视角
手性助剂
来自维基百科,自由的百科全书
Remove ads
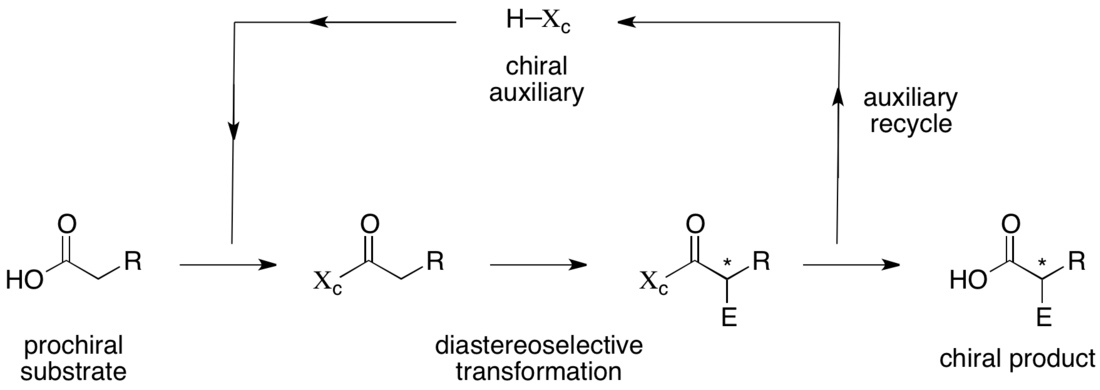
手性助劑是一種在有機合成中為了控制的合成產物立體構型而暫時引入的化合物或結構單元。[1][2]手性助劑的手性結構會影響一個或多個後續反應的立體選擇性。而且引入的手性助劑通常可通過脫除來回收利用。

手性助劑於不對稱合成中的反應通式
大部分的生物分子和標靶藥物為兩種可能的鏡像異構體(又稱對映異構)中一種,因此這類天然產物和藥物的合成通常以得到單一手性產物為目標,即純度為對映純或光學純(enantiomerically pure,enantiopure)[3]。為了達到這一目標,採用手性助劑就是一種常用的合成方法[4]。
1975年艾里亞斯·詹姆斯·科里用手8-苯基薄荷醇(chiral 8-phenylmenthol)為例首次向人們介紹何謂手性助劑,而後1980年巴里·特羅斯特也以手性扁桃酸來介紹之。由於薄荷醇製備困難,所以在1985年J. K. Whitesell以反-2-苯基環己醇為例來介紹手性助劑。
Remove ads
非對稱合成
為了控制化合物立體中心的絕對構型,手性助劑會在合成路線中引入。在眾多使用手性助劑的合成實例中。大衛·A·伊凡斯發明的大環內酯類抗生素胞變菌素的不對稱合成被認為是一個經典例子。當中採用了噁唑烷酮手性輔助劑參與了1個不對稱烷基化反應和4個不對稱羥醛縮合反應,得到了含有9個手性中心的絕對構型胞變菌素[5]。

大衛·A·伊凡斯於1990年合成出的胞變菌素。藍色及紅色部分表示噁唑烷酮手性助劑產生的手性中心
一個採用手性助劑進行非對稱合成的典型反應有三個步驟:第一,手性助劑與反應底物進行共價結合;其次結合產物會經歷至少一個立體選擇性反應;最後手性助劑在不引起產物外消旋化的情況下被移除[4]。雖然用到的對應化學計量的手性助劑成本較高,以及需額外步驟對手性助劑進行引入和脫除使得這種合成方法看起來效率很低很不划算,但對於許多化合物的合成來說,唯一可以產生立體選擇性的方法必須用到手性助劑。此外,採用手性助劑的合成反應適用範圍很廣,且研究得較為透徹,可以最省時地獲得對映體純的產物[2]。
Remove ads
8-苯基薄荷醇
在早期使用手性助劑進行不對稱合成的範例中,艾里亞斯·詹姆斯·科里等人介紹了一種由(-)-8-苯基薄荷醇丙烯酸酯與5-苄氧甲基環戊二烯之間的不對稱狄爾斯-阿爾德環加成反應[7]。反應產物經過一系列後續反應得到一種碘代內酯化合物,這種碘代內酯是Corey法合成前列腺素的經典中間體。在反應中,因為丙烯酸酯的背面被手性助劑阻擋,所以[狄爾斯-阿爾德加成只能發生在烯烴的前方。

使用手性助劑(-)-8-苯基薄荷醇來合成前列腺素的非鏡像選擇性雙烯環加成反應。
(-)-8-苯基薄荷醇可以從任一長葉薄荷酮的對映體製備[8],即使沒有一個途徑更高效率。基於8-苯基薄荷醇在不對稱合成中的廣泛使用,例如反式-2-苯基環己醇[9]和反式-2-(1-苯基-1-甲基乙基)環己醇[10]等更易合成的替代品被開發出來。
1,1'-聯-2-萘酚(BINOL)
1,1'-聯-2-萘酚(BINOL)自1983年起一直被用作不對稱合成的手性助劑[11][12]。

山本尚首次利用(R)-BINOL作為手性助劑,對環狀單萜烯進行不對稱合成。以(R)-BINOL作為手性助劑,通過單矽化和烷基化反應製備出(R)-BINOL 單萜醚。隨後用有機鋁試劑還原,合成出產率較低(產率29%)且對映體過剩率適中(最高64% ee)的檸檬烯[12]。

京都大學化學研究所的富士薫以軸手性BINOL作為手性助劑,通過手性甘氨酸衍生物的烷基化,可以製備多種對映體純的自然界罕見的R-氨基酸。根據不同的親電試劑,對映體過剩率從69%到86%不等[13]。

用(R)-BINOL保護醛基,芳基乙二醛與格氏試劑進行非立體選擇性反應,得到保護的阻轉乳醛結構,具有中等至優異的非對映體過量和高產率[14]。

在金屬催化C-P鍵不對稱耦合得到手性磷化合物中,也用到了BINOL手性助劑。Mondal等人發現軸向手性BINOL基亞磷酰胺與芳基鹵或三氟甲磺酸芳酯的Pd催化C-P交叉偶聯反應中,由於BINOL存在於P反應中心附近,使得反應具有出色的立體選擇性[15]。
反式-2-苯基環己醇

1985年,James K. Whitesell等人發明了一種基於反式-2-苯基環己醇結構單元的手性助劑,並在烯反應中採用了其乙醛酸酯作為手性助劑[16]。

天然產物(−)-heptemerone B和(−)-guanacastepene E的全合成中,就用到了反式-2-苯基環己醇手性助劑。乙醛酸反式-2-苯基環己醇酯與2,4-二甲基-2-戊烯在四氯化錫作用下得到以反式加成為主的產物(反式:順式=10:1)[17]。

為了更好地控制構型,將苯基換成三苯甲基可得到反式-2-三苯甲基環己醇(TTC)。2015年,Browm研究組發表了一種高效的手性高錳酸鹽介導的環氧化反應,其中就使用了TTC[18]。

噁唑烷酮
噁唑烷酮類手性助劑由大衛·A·伊凡斯推廣,現如今已被應用到許多立體選擇性合成上,包括羥醛縮合反應[19]、烷基化反應,[20]和狄爾斯 - 阿爾德反應[21][22]等。這類助劑中,噁唑烷酮的4和5號位被取代基取代,並透過空間位阻引導了各種基團取代的方向。而噁唑烷酮助劑可透過水解等方式進行脫除。
噁唑烷酮類助劑可以從胺基酸或從容易取得的氨基醇中製備得到。而且量大的噁唑烷酮類助劑也均有市售,包括以下四種:
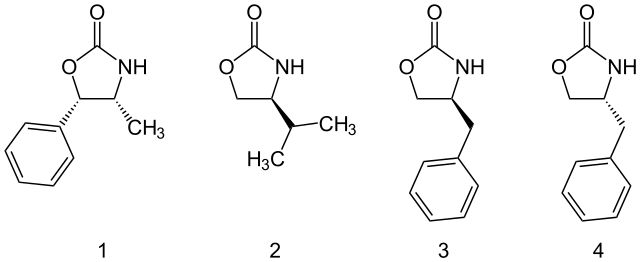
一些可購買的噁唑烷酮手性助劑。

手性噁唑烷酮採用丙酰氯進行酰化。
使用二異丙基氨基鋰等強鹼對噁唑烷酮酰亞胺的α-碳進行去質子化能選擇性地產生(Z)-烯醇鹽,其可以進行立體選擇性烷基化反應。

噁唑烷酮酰亞胺用芐基溴的烷基化反應。
不對稱羥醛縮合最常用的手性助劑就是噁唑烷酮類助劑。
採用路易斯酸三氟甲磺酸二丁硼(Bu2BOTf)和二異丙基乙胺(i-Pr2NEt)作為鹼對噁唑烷酮類助劑進行軟烯醇化,得到相應的(Z)-烯醇產物。而此化合物可與醛進行非對稱羥醛縮合產生連個相鄰的手性中心。

立體選擇性的伊凡斯羥醛縮合反應。
其反應機理可用羥醛縮合Zimmerman-Traxler過渡態模型解釋,如下圖所示,甲基和仲醇在Zimmerman-Traxler六元環過渡態中處於順位(syn)關係,烯醇氧原子和醛基氧原子同時與硼原子相連。醛發生取向使得氫處於准-軸向位(pseudo-axial),以最大限度地減少1,3-二軸相互作用。兩個立體中心的絕對立體構型由手性助劑分子的手性控制。在過渡態結構中,手性助劑的羰基遠離烯醇氧,以使分子的淨偶極最小化;烯醇的一個面被手性助劑分子上的取代基阻擋,產生立體選擇性。

伊凡斯不對稱羥醛縮合的Zimmerman-Traxler過渡態模型
Remove ads
噁唑烷酮助劑有多種脫除方法,進而可以產生不同的官能基。

噁唑烷酮酰亞胺通過多種脫除方式產生不同的官能基。
樟腦磺內酰胺
樟腦磺內酰胺也是一種經典的手性助劑。

大阪市立大學的大船泰史研究組在不對稱全合成大環脂肽抗生素manzacidin B中,就用到了樟腦磺內酰胺作為手性助劑得到manzacidin B中核心噁唑啉結構。相比於噁唑烷酮助劑,樟腦磺內酰胺有更高的(2S,3R)構型選擇性[23]。

樟腦磺內酰胺在不對稱米高加成中也有運用。在有機鋰強鹼的作用下,硫醇與N-甲基丙烯酰樟腦磺酰胺發生立體選擇性米高加成,得到較高的非立體選擇性加成產物[24]。

樟腦磺內酰胺也可用在不對稱克萊森重排反應中。以2,6-二叔丁基對甲酚作為自由基淬滅劑,香葉醇與樟腦磺內酰胺的甲苯溶液裝入密封管中以140°C加熱,以72%的產率生成主要重排產物 (2R,3S)異構體,產生包括兩個相鄰季碳立體中心[25]。

Remove ads
偽麻黃鹼和偽麻黃酰胺
(R,R)-和(S,S)-偽麻黃鹼皆可作為手性助劑。[26]偽麻黃鹼與羧酸、酸酐和酰氯反應形成偽麻黃酰胺(pseudoephedrine amide)。
羰基的α-氫原子很容易被非親核鹼移除產生烯醇化物。加成化合物(例如烷基鹵化物)的構型由甲基決定。因此,任何加成產物都將與甲基呈順式(syn),與羥基呈反式(anti)。之後可通過使用適當的親核試劑裂解酰胺鍵來脫除偽麻黃鹼手性助劑。
偽麻黃鹼的兩種對映體皆有市售。因為偽麻黃鹼可以用於製備非法物質甲基苯丙胺,所以無論是學術用途還是工業用途,購買偽麻黃鹼都收到嚴厲的監管。為了克服這一點,Myers等人開發利用偽麻黃酰胺作為烷基化手性助劑的替代方法[27]。即使沒有市售的偽麻黃酰胺,但其可由二苯基乙二酮進行簡單合成得到,而且不能用於合成甲基苯丙胺。

偽麻黃鹼和偽麻黃酰胺手性助劑。

(S,S)-偽麻黃鹼使用酸酐酰化得到對應的偽麻黃酰胺
偽麻黃酰胺藉由二異丙基胺基鋰(LDA)等強鹼進行去質子反應而得到相應的(Z)-烯醇鋰鹽。採用這些烯醇鋰鹽進行烷基化擁有很高的反應面選擇性。

偽麻黃酰胺的立體選擇性烷基化。
偽麻黃酰胺的這種反應面選擇性常被認為是其結構所致,因為烯醇鋰的其中一個面被烷基仲醇鋰以及溶劑化鋰離子阻擋,烷基化反應傾向於在另一面進行。根據這一理論,產物立體選擇性與氯化鋰和溶劑四氫呋喃用量高度相關。通常,4至6摩爾當量的氯化鋰足以在反應濃度下使THF中的烯醇鹽溶液飽和。

偽麻黃酰胺烯醇的面選擇性烷基化圖例。
偽麻黃鹼酰胺不對稱烷基化的主要優勢之一是酰胺烯醇鹽通常具有足夠的親核性,可在 -78 °C 至 0 °C 的溫度下與伯鹵甚至叔鹵化物發生反應。通過α-支鏈酰胺烯醇鹽的烷基化構建季碳手性中心也是可能的,但對於反應性較低的親電試劑,必須添加DMPU[29]。
目前已經發展出將偽麻黃酰胺轉化成不同類型對映體化合物的脫除方法,如羧酸、醇、醛和酮類。

將偽麻黃酰胺通過不同脫除方法產生不同類型化合物。
反應完成後,被脫除的偽麻黃酰胺可以重新利用。
叔丁基亞磺酰胺
喬納森·埃爾曼(Jonathan Ellman)研究組已經廣泛研究出利用手性亞磺酰胺(sulfonamide)衍生物作為手性助劑的方法。[30]

叔丁基亞磺酰胺的兩個對映異構體。
任一叔丁基亞磺酰胺的對映異構體可藉由叔丁基二硫經兩步合成得到:催化不對稱氧化反應以高產率和對映體選擇性生成二硫鍵氧化產物硫代亞磺酸酯。接着以在氨基鋰的氨溶液中處鋰該化合物,即可得到光學純的逆產物。

由常見易得的叔丁基二硫合成的叔丁基亞磺酰胺方法。
以醛或酮來進行叔丁基亞磺酰胺的縮合反應,會以高產率和高對映體過剩率地得到(E)-異構體的N-亞磺酰醛亞胺或N-亞磺酰酮亞胺。

叔丁基亞磺酰胺與醛或酮的縮合得到對應的N-亞磺酰亞胺。
將格氏試劑加成到叔丁烷亞磺酰基醛亞胺或酮亞胺中,可發生不對稱加成生成支鏈亞磺酰胺。該現象可以用六元環過渡態模型進行合理解釋,其中亞磺酰亞胺的氧與氮皆會與鎂配位。

叔丁基亞磺酰胺與格氏試劑的加成反應。

亞磺酰胺輔助劑的酸解。
SAMP與RAMP
手性體(S)-1-氨基-2-(甲氧基甲基)吡咯(SAMP)和(R)-1-氨基-2-(甲氧基甲基)吡咯(RAMP)的腙烷基化反應,是由迪特·恩德斯和艾里亞斯·詹姆斯·科里研發。[31][32]
SAMP可藉由(S)-脯胺酸經六步反應製備,而RAMP則可藉由(R)-谷胺酸經六步反應製備。

用市售試劑製備SAMP與RAMP。
SAMP或RAMP經與醛或酮縮合反應會得到相應(E)-肼類化合物,隨後利用強鹼LDA去質子化以及鹵代烷加成就得到相應烷基化產物。手性助劑可由臭氧化反應或水解進行脫除。

SAMP或RAMP手性助劑的縮合、烷基化與脫除。
工業中的手性助劑
手性助劑通常可靠且用途廣泛,能夠以省時的方式合成大量對映體純化合物。因此手性助劑通常是藥物開發早期階段的首選方法[2]。
HIV蛋白酶抑制劑替拉那韋是一種已上市的治療HIV感染藥物。替拉那韋的首個立體選擇性合成路線涉及有機銅酸鹽與手性米高受體進行米高共軛加成[33]。米高受體中的手性惡唑烷酮結構控制替拉那韋分子中兩個手性中心當中一個的立體構型。然而替拉那韋的最終商業化合成路線沒有用到手性助劑;這個手性中心反而是利用不對稱加氫反應得到的[34]。

替拉那韋形成關鍵立體中心的最初以及最終合成策略。
阿托伐他汀的鈣鹽在市場上的商品名為立普妥(Lipitor),是一種降血中膽固醇的藥物。阿托伐他汀的首個立體選擇性藥物合成路線依賴於手性酯的非立體選擇性醇醛縮合反應來控制兩個醇立體中心其中一個立體構型[35]。在阿托伐他汀的商業合成路線中,這一手性中心構型則是從常用的食品添加劑異抗壞血酸的手性繼承得到[36]。

阿托伐他汀的關鍵立體中心的最初以及商業合成策略。
另請參見
- 反式-2-苯基-1-環己醇作為手性助劑的合成範例:尾島內酯
- 纈胺酸在Schöllkopf方法中擔任手性助劑。
參考
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads