Аміяк
хімічнае злучэнне From Wikipedia, the free encyclopedia
Remove ads
Аміяк, (нітрыд вадароду, гідрыд азоту, хімічная формула — NH3) — бінарнае хімічнае злучэнне аднаго атама азоту з трыма атамамі вадароду.
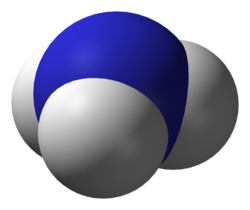
Пры нармальных умовах бясколерны газ з рэзкім характэрным пахам (пах нашатырнага спірту), амаль удвая лягчэйшы за паветра, таксічны. Растваральнасць NH3 у вадзе надзвычай вялікая — каля 1200 аб’ёмаў (пры 0 °C) або 700 аб’ёмаў (пры 20 °C) у аб’ёме вады. Малекула аміяку мае форму трыганальнай піраміды з атамам азоту ў вяршыні. Хімічныя сувязі N-H — кавалентныя палярныя (D=1,48μ); на атаме азоту знаходзіцца непадзеленая электронная пара, то бок малекула аміяку палярная. Менавіта з гэтай прычыны аміяк добра раствараецца ў вадзе.
Remove ads
Хімічныя ўласцівасці
Водныя растворы аміяку праяўляюць слабыя асноўныя ўласцівасці (канстанта гідролізу Kг.=1,8*10-5).
- .
Наяўнасць непадзеленай электроннай пары абумоўлівае выскоія донарныя уласцівасці малекулы аміяку, то бок здольнасць рэагіраваць з мінеральнымі кіслотамі,
- .
А таксама ўтвараць комплексныя злучэнні.
- .
З шчолачнымі металамі аміяк утварае аміды, іншыя ж металы ў рэакцыі з аміяком даюць нітрыды. Узаемадзеянне з галагенамі ідзе па-рознаму: у атмасферы фтору аміяк імгненна акісляецца да фтарыду азоту, хлор паступова замяшчае атамы вадароду, а ёд пры ўзаемадзеянні з водным растворам аміяку ўтварае чорны выбухованебяспечны асадак складу (NI3*NH3)n.
Remove ads
Атрыманне
У прамысловасці аміяк атрымліваюць па метадзе Габера-Боша узаемадзеяннем азоту з вадародам.
- .
Сумесь двух рэчываў прапускаецца пад ціскам праз каталізатар, ролю якога ў дадзеным працэсе грае губкаватае жалеза. Ціск зрушвае раўнавагу ў рэакцыі ўправа, а пастаянная тэмпература ў 450—500 °C павялічвае хуткасць рэакцыі[1]. У лабараторыі аміяк можна атрымаць награваннем сумесі цвёрдых хларыду амонію і гашанай вапны.
- .
Або дадаючы да цвёрдага хларыду амонію па кроплям шчолачы.
- .
Remove ads
Выкарыстанне
Аміяк выкарыстоўваецца ў вытворчасці азотнай кіслаты, соды, мачавіны, сінільнай кіслаты, мінеральных угнаенняў і інш. У халадзільнай тэхніцы носіць назву R717, дзе R — Refrigerant (холадагент), 7 — тып холадагенту (неарганічнае злучэнне), 17 — малекулярная маса.
У медыцыне 10%-ны раствор аміяку (нашатырны спірт) выкарыстоўваецца для пабуджэння дыхання пры страчванні прытомнасці, для стымуляцыі ванітаў. Аміяк мае і вонкавае прымяненне: пры ўкусах насякомых, для апрацоўвання рук падчас хірургічных аперацый і інш. Пры няправільным выкарыстанні аміяк можа выклікаць пухіры страўніка і стрававода, рэфлекторнае спыненне дыхання (пры высокіх канцэнтрацыях).
Зноскі
- Неорганическая химия : в 3 т. / Ю. Д. Третьяков [и др.]. — М. : Академия, 2004—2007. — Т. 2 : Химия непереходных элементов / А. А. Дроздов, М. Е. Тамм, Ю. Д. Третьяков [и др.]. — 2004. — 368 с.
Літаратура
Спасылкі
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads


![{\displaystyle {\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{3}}{}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}\mathrel {\longrightarrow } {}\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{4}}{\vphantom {A}}^{+}{}+{}\mathrm {OH} {\vphantom {A}}^{-}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/4d95b324fc6a6499ef45dfea29f71effb7899741)
![{\displaystyle {\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{3}}{}+{}\mathrm {HBr} {}\mathrel {\longrightarrow } {}\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{4}}\mathrm {Br} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/aeb3739755e9333737d2729948be13da10d9556f)
![{\displaystyle {\mathrm {AgNO} {\vphantom {A}}_{\smash[{t}]{3}}{}+{}3\,\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{3}}{}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}\mathrel {\longrightarrow } {}[\mathrm {Ag} (\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{3}}){\vphantom {A}}_{\smash[{t}]{2}}]\mathrm {OH} {}+{}\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{4}}\mathrm {NO} {\vphantom {A}}_{\smash[{t}]{3}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/aa1e8ada2f747d60270fe537e9e041eafa1d84b8)
![{\displaystyle {\mathrm {N} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}3\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}{}\mathrel {\longrightarrow } {}2\,\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{3}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/44d6ed102215b1a399da5e875d4c63035a93020a)
![{\displaystyle {2\,\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{4}}\mathrm {Cl} {}+{}\mathrm {Ca} (\mathrm {OH} ){\vphantom {A}}_{\smash[{t}]{2}}{}\mathrel {\longrightarrow } {}\mathrm {CaCl} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}2\,\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{3}}\uparrow {}{}+{}2\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/1e5e92e1288f3dc11ad6c053a1ddc5271b6ebfd8)
![{\displaystyle {\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{4}}\mathrm {Cl} {}+{}\mathrm {NaOH} {}\mathrel {\longrightarrow } {}\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{3}}\uparrow {}{}+{}\mathrm {NaCl} {}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/8c2a835e3277e61b81573f3a6957bec4b00d73d5)