Elektrofilní aromatická substituce
chemická reakce, která váže elektrofil na aromatický kruh From Wikipedia, the free encyclopedia
Remove ads
Elektrofilní aromatická substituce je typickou chemickou reakcí arenů a jiných sloučenin s aromatickým charakterem. Mezi nejdůležitější elektrofilní aromatické substituce patří aromatická nitrace, aromatická halogenace, aromatická sulfonace a alkylační a acylační Friedel-Craftsova reakce.[1]
Mechanismus
Substituční reakce probíhá v několika stupních. Prvním krokem je vznik elektrofilního činidla.
Aδ+―Bδ– → A(+) (elektrofil) + B(–) (báze)
Elektrofil interaguje s π-elektrony aromatického jádra za vzniku π-komplexu (1). Ten pomalu přechází na σ-komplex (2). Aromaticita jádra je narušena. (σ-komplex není přechodný stav, ale skutečný meziprodukt reakce, který byl v některých případech dokonce izolován.) Posledním krokem je odtržení protonu bází (3).
Remove ads
Přehled elektrofilních substitucí
Nitrace
K nitraci se používá kyselina dusičná nebo nitrační směs (HNO3 + H2SO4). Reakcí obou kyselin vzniká elektrofil NO +
2 .
HNO3 + H2SO4 → H2N(+)O3 + HSO4(–) (báze)
H2N(+)O3 → H2O + NO2(+) (elektrofil)
Halogenace
Halogenace se provádí halogeny za katalýzy příslušného halogenidu hlinitého či železitého (Lewisovy kyseliny).
Xδ+―Xδ–…AlX3 → X(+) (elektrofil) + [AlX4](–) (báze)
Sulfonace
Sulfonace se provádí kyselinou sírovou nebo oleem. Má poněkud jiný charakter, činidlem je oxid sírový a jedná se o reakci vratnou.
Friedelova-Craftsova alkylace
Na alkylaci se může použít více činidel
- alkylhalogenid katalyzovaný Lewisovou kyselinou
Rδ+―Xδ–…AlX3 → R(+) (elektrofil) + [AlX4](–) (báze) - alken katalyzovaný silnou (anorganickou) kyselinou
R―CH=CH2 + H2SO4 → R―C(+)H―CH3 (elektrofil) + HSO4(–) (báze) - alken v přítomnosti halogenvodíku a Lewisovy kyseliny
R―CH=CH2 + Hδ+―Xδ–…AlX3 → R―C(+)H―CH3 (elektrofil) + [AlX4](–) (báze)
Stabilita vzniklých karbokationtů klesá v řadě terciární > sekundární > primární. Méně stabilní karbokationty se přesmykují na stabilnější. Alkylací 1-chlorpropanem tedy vznikne především isopropylbenzen (kumen), nikoliv propylbenzen.
Friedelova-Craftsova acylace
Při acylaci se působí acylhalogenidem, anhydridem nebo karboxylovou kyselinou v přítomnosti Lewisovy kyseliny. Jedná se o vratnou reakci.
Remove ads
Poloha druhého substituentu na benzenu
První substituent způsobí nerovnoměrné rozdělení elektronové hustoty na benzenovém jádře, a tím zvýhodní nebo naopak znevýhodní některé polohy. Zároveň může jádro buď aktivovat (zvyšuje elektronovou hustotu v jádře), nebo deaktivovat (snižuje elektronovou hustotu v jádře).
Stoprocentně určují polohu pouze substituenty se silným dirigujícím účinkem. V ostatních případech vzniká nepatrné množství nepreferovaných produktů, které lze ovšem většinou zanedbat.
Substituenty první třídy
Usměrňují substituci do poloh ortho (2) a para (4). Zároveň jádro vůči dalším elektrofilním substitucím aktivují. Výjimkou jsou halogeny, které díky svému výraznému -I efektu jádro trochu deaktivují. Poměr ortho a para izomerů ovlivňují především sterické faktory.
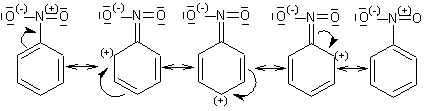
Mezomerní struktury znázorňují zvýhodnění poloh orto a para oproti poloze meta.
Substituenty I. třídy podle klesajícího dirigujícího účinku: NR2 > NHR > NH2 > NHCOR > OH > OR > SH > SR > alkyl > fenyl > halogen > N=O (nitrososkupina)
Substituenty druhé třídy
Usměrňují substituci do polohy meta (3). Zároveň jádro deaktivují a znesnadňují tak další substituci.
Mezomerní struktury znázorňují znevýhodnění poloh ortho a para oproti poloze meta.
Substituenty II. třídy podle klesajícího dirigujícího účinku: R3N(+) > R2S(+) > NO2 > CN > HC=O > SO2R > SO3(-) > COOR > CONH2
Poloha dalších substituentů
V momentě, kdy jsou na jádře navázány již dva substituenty, je obtížnější určit polohu další substituce. Obecně platí, že dirigující účinek substituentu I. třídy převáží nad účinkem substituentu II. třídy. Jinak postupujeme podle seřazení dle dirigujícího účinku (viz výše). Vliv mohou hrát též sterické faktory (objemnost substituentů).
Elektrofilní substituce naftalenu
Naftalen se ve srovnání s benzenem substituuje lépe. Například bromace probíhá i bez přítomnosti Lewisovy kyseliny.
Největší elektronová hustota se v případě naftalenu nachází v polohách α, tedy 1,4,5 a 8. Snadněji tedy probíhá substituce do α-poloh. Nitrace a halogenace probíhají výlučně do polohy 1 (α). U sulfonace a Friedelovy-Craftsovy acylace lze získat produkt podle reakčních podmínek. Obě reakce jsou vratné, i když s jistým omezením. Při nižší teplotě 60 °C nebo kratší reakční době vzniká α‑produkt (kinetický produkt, tedy reagující do polohy 1). Při vyšší teplotě (160 °C nebo při delší reakční době vzniká stálejší β‑produkt (termodynamický produkt, poloha 2).
Poloha druhého substituentu na naftalenu
- Substituent I. třídy v poloze 1 diriguje vstup do polohy 4, případně. 2.
- Substituent I. třídy v poloze 2 diriguje vstup do polohy 1.
- Substituent II. třídy deaktivuje jádro, na kterém je navázán, a substituce probíhá na druhém jádře – poloha 5 a 8.
Remove ads
Odkazy
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads