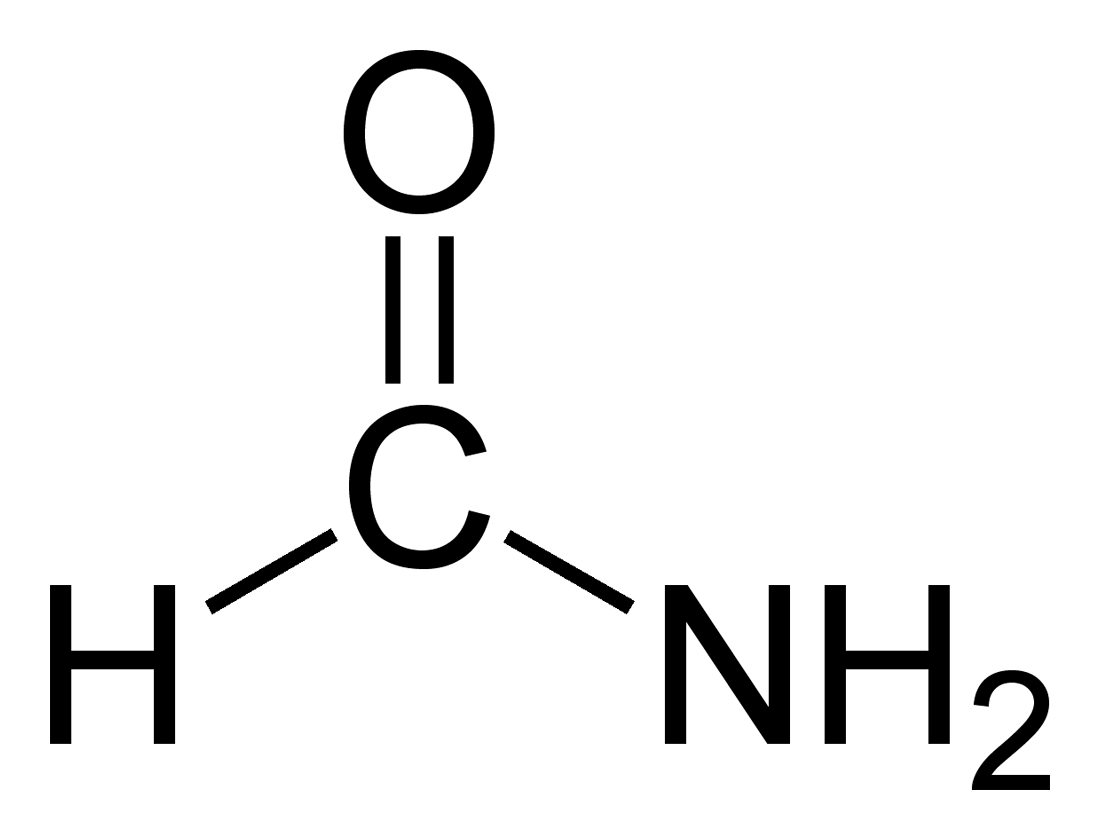
Formamid
chemická sloučenina From Wikipedia, the free encyclopedia
Remove ads
Formamid nebo methanamid je amid odvozený od kyseliny mravenčí, lze jej také považovat za aldehyd kyseliny karbamové. Je to čirá kapalina mísitelná s vodou, se zápachem podobným jako u amoniaku. Je výchozí surovinou ve výrobě sulfonamidů a ostatních léčiv, pesticidů a kyseliny kyanovodíkové. Používá se ke změkčování papíru. Rozpouští mnoho iontových sloučenin, pryskyřic a plastifikátorů.[3]
Formamid se při teplotě 180 °C částečně rozkládá na oxid uhelnatý a amoniak, přičemž také vznikají malá množství kyanovodíku a vody. Za přítomnosti kyseliny v pevném skupenství jako katalyzátoru vzniká více HCN:
- nízká teplota: HC(O)NH2 → CO + NH3
- vysoká teplota, katalyzováno kyselinou: HC(O)NH2 → HCN + H2O
Remove ads
Výroba
V minulosti
Dříve se formamid vyráběl reakcí kyseliny mravenčí s amoniakem, čímž vznikal mravenčan amonný, který se poté zahřátím přeměnil na formamid[4]:
- HCOOH + NH3 → HCOONH4
- HCOONH4 → HCONH2 + H2O
Moderní výroba
Současná průmyslová výroba formamidu se skládá z jediné reakce, karbonylace amoniaku[3]:
- CO + NH3 → HCONH2
Formamid může být vyroben rovněž dvoustupňovým procesem zahrnujícím amonolýzu mravenčanu methylnatého, který se získá z oxidu uhelnatého a methanolu:
- CO + CH3OH → HCOOCH3
- HCO2CH3 + NH3 → HC(O)NH2 + CH3OH
Ostatní
Formamid lze též získat aminolýzou mravenčanu ethylnatého[5]:
- HCOOCH2CH3 + NH3 → HCONH2 + CH3CH2OH
Remove ads
Použití
Formamid se používá na výrobu kyanovodíku a jako rozpouštědlo při zpracovávání nejrůznějších polymerů jako je například polyakrylonitril.
Laboratorní a ostatní využití
Formamid je složkou ochranných směsí používaných při kryokonzervaci tkání a orgánů.
Tato látka se také používá jako stabilizér RNA v gelové elektroforéze, kde má za úkol deionizovat RNA. V kapilární elektroforéze se používá ke stabilizaci (jednotlivých) vláken denaturované DNA.
Další využití nachází jako přísada v sol-gelových roztocích, kde zabraňuje prasknutí během spékání.
Čistý formamid se používá jako alternativní rozpouštědlo pro elektrostatické samouspořádávání polymertových nanofilmů.[6]
Formamid je rovněž používán na přímou přípravu primárních aminů z ketonů přes jejich N-formylderiváty Leuckartovou reakcí.
Remove ads
Vznik života
Bylo zjištěno, že formamid zahřátý na 130 °C se v přítomnosti ultrafialového záření přeměňuje na guanin.[7] S formamidem jako základním stavebním kamenem počítají některé hypotézy vzniku života.[8]
Bezpečnost
Formamid je mírně dráždivý pro oči, kůži a sliznice.[9] Vdechnutí většího množství par této látky vyžaduje lékařské ošetření.[10][11] Má také teratogenní účinky.[12] U formamidu byla prokázána hematotoxicita pro zvířata, tato látka je nebezpečná při delší expozici vdechnutím, pozřením a absorpcí skrz kůži.[13] Nikdy by s ním nemělo být manipulováno bez odpovídajících ochranných pomůcek jako jsou rukavice a ochranné brýle.
Remove ads
Reference
Externí odkazy
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads