Hydrid sodný
chemická sloučenina From Wikipedia, the free encyclopedia
Remove ads
Hydrid sodný je anorganická sloučenina vodíku a sodíku s empirickým vzorcem NaH. Používá se především jako silná zásada v organické syntéze. NaH patří mezi solné (iontové) hydridy, je složen z iontů Na+ a H−; mezi molekulárnější hydridy patří boran, methan, amoniak nebo voda. Hydrid sodný není rozpustný v organických rozpouštědlech (rozpouští se však v roztaveném sodíku), což je konzistentní s tím, že iont H− zatím není v roztoku znám. Vzhledem k této nerozpustnosti probíhají všechny reakce na povrchu tuhé látky.
Remove ads
Vlastnosti a struktura
NaH vzniká přímou reakcí vodíku a kapalného sodíku.[2] Čistý hydrid sodný je bezbarvý, běžné vzorky bývají šedé.
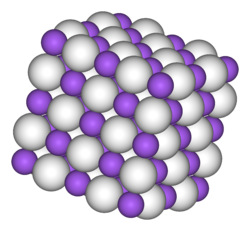
Hydrid sodný, podobně jako hydridy ostatních alkalických kovů (LiH, KH, RbH a CsH), má krystalovou strukturu jako chlorid sodný. Každý iont Na+ je obklopen šesti ionty H− v osmistěnné geometrii. Iontové poloměry, souzeno podle vzdáleností Na-H a Na-F, iontů H− (146 pm v NaH) a F− (133 pm) jsou srovnatelné.[3]
Remove ads
Výroba
Průmyslově se hydrid sodný vyrábí přidáváním taveniny sodíku do minerálního oleje v atmosféře vodíku za atmosférického tlaku a intenzivního míchání, reakce probíhá velmi rychle za teploty 250–300 °C:
2 Na + H2 → 2 NaH
Vzniklá suspenze se pak často přímo využívá pro další syntézy, např. diboranu.[4]
Použití v organické syntéze
Jako silná zásada
NaH je zásada se širokým spektrem použití v organické chemii.[5] Je schopen deprotonovat velkou škálu (i slabých) Brønstedových kyselin na příslušné sodné deriváty. Typické „snadné“ substráty obsahují vazby O-H, N-H či S-H; sem patří například alkoholy, fenoly, pyrazoly a thioly.
Nejvýznamnějším použitím NaH je deprotonace uhlíkatých kyselin, například 1,3-dikarbonylu a analogů, kupříkladu esterů kyseliny malonové. Výsledné sodné deriváty lze alkylovat. NaH se široce využívá pro kondenzační reakce karbonylových sloučenin pomocí Dieckmannovy, Stobbeovy, Darzensovy a Claisenovy kondenzace. Mezi další uhlíkaté kyseliny náchylné na deprotonaci pomocí NaH patří sulfoniové soli a dimethylsulfoxid. NaH se používá k přípravě ylidů síry, které se zase používají ke konverzi ketonů na epoxidy.
Jako redukční činidlo
NaH redukuje některé sloučeniny hlavní skupiny, ovšem analogická reaktivita v organické chemii není známa. Fluorid boritý s NaH reaguje za vzniku diboranu a fluoridu sodného:[2]
- 6 NaH + 2 BF3 → B2H6 + 6 NaF
Redukuje také vazby Si-Si v disilanech a S-S v disulfidech.
Vysoušedlo
Protože rychle a nezvratně reaguje s vodou, používá se NaH k vysoušení některých organických rozpouštědel. Častější je však použití jiných sloučenin, například hydridu vápenatého.
Ukládání vodíku
Hydrid sodný byl navržen pro použití k ukládání vodíku pro palivové články ve vozidlech. Hydrid by byl uložen v plastických peletách, které by se v přítomnosti vody drtily, čímž by se uvolňoval vodík.[6]
Nakládání s hydridem sodným
Hydrid sodný je prodáván mnoha dodavateli obvykle jako směs 60 % NaH v minerálním oleji. S takovou směsí se bezpečněji zachází a snadněji se váží. Čistý bílý NaH se získá vypláchnutím oleje pentanem nebo tetrahydrofuranem (THF); je třeba opatrnosti, protože oplachová kapalina obsahuje stopy NaH, které se mohou na vzduchu vznítit. Reakce s NaH vyžadují inertní atmosféru, například dusíkovou nebo argonovou. Typicky se používá suspenze NaH v THF, protože jde o látku odolávající deprotonaci, ovšem rozpouštějící většinu organosodných sloučenin.
Remove ads
Bezpečnost
NaH se může na vzduchu vznítit, zvlášť při kontaktu s vodou, kdy se uvolňuje (rovněž hořlavý) vodík. Hydrolýzou vzniká žíravý hydroxid sodný. Proto se také (viz výše) hydrid sodný uchovává v oleji.[7]
Odkazy
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads