Top-Fragen
Zeitleiste
Chat
Kontext
Isoleucin
chemische Verbindung, essentielle Aminosäure Aus Wikipedia, der freien Enzyklopädie
Remove ads
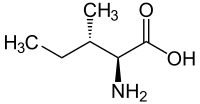
Isoleucin, abgekürzt Ile oder I, ist in seiner natürlichen L-Form eine essentielle proteinogene α-Aminosäure.
Da Isoleucin von der Asparaginsäure ableitbar ist, wird es zur Aspartatgruppe gezählt. Es gehört zusammen mit seinen Konstitutionsisomeren Leucin, Norleucin und tert-Leucin zur Stoffgruppe der Leucine.
Remove ads
Geschichte
1901 äußerte der spätere Nobelpreisträger Emil Fischer die Vermutung, dass in der von ihm isolierten Leucinfraktion neben Leucin eine „gleich zusammengesetzte, aber stärker drehende Aminosäure enthalten ist“.[4] Tatsächlich konnte der deutsche Chemiker Felix Ehrlich 1903 aus der Melasse von Rübenzucker eine zu Leucin isomere Verbindung isolieren, als Isoleucin.[5] Die Konstitution erkannte Felix Ehrlich 1907 durch weitergehende Untersuchung.[6]
Remove ads
Metabolismus
Stoffwechselkrankheiten
Der Abbau von Isoleucin ist bei den folgenden Stoffwechselkrankheiten gestört:
Vorkommen
Isoleucin ist peptidisch gebunden Bestandteil tierischer und pflanzlicher Proteine. Die folgenden Beispiele beziehen sich jeweils auf 100 g des Lebensmittels, zusätzlich ist der prozentuale Anteil von Isoleucin am Gesamtprotein angegeben.[7]
Alle diese Nahrungsmittel enthalten praktisch ausschließlich chemisch gebundenes L-Isoleucin als Proteinbestandteil, jedoch in rohem Zustand kein freies L-Isoleucin.
Stereoisomerie
Isoleucin besitzt zwei Stereozentren, somit existieren vier Stereoisomere; in unserer Umwelt spielt jedoch nur das L-Isoleucin als proteinogene Aminosäure eine Rolle und ist physiologisch bedeutsam. Wenn von „Isoleucin“ ohne weiteren Namenszusatz (Deskriptor) gesprochen wird, ist gemeinhin L-Isoleucin gemeint.
Enantiomer zum natürlichen L-Isoleucin ist das D-Isoleucin. L-allo-Isoleucin und dessen Enantiomer D-allo-Isoleucin sind Diastereomere von L-Isoleucin.
| Isomere von Isoleucin | ||||
| Name | L-Isoleucin | D-Isoleucin | L-allo-Isoleucin | D-allo-Isoleucin |
| Andere Namen | (2S,3S)-2-Amino-3-methylpentansäure (S)-Isoleucin |
(2R,3R)-2-Amino-3-methylpentansäure (2R,3R)-2-Amino-3-methylvaleriansäure |
(2S,3R)-2-Amino-3-methylpentansäure | (2R,3S)-2-Amino-3-methylpentansäure |
| Strukturformel |  |
 |
 |
 |
| CAS-Nummer | 73-32-5 | 319-78-8 | 1509-34-8 | 1509-35-9 |
| 443-79-8 (unspez.) | ||||
| EG-Nummer | 200-798-2 | 206-269-2 | 216-142-3 | 216-143-9 |
| 207-139-8 (unspez.) | ||||
| ECHA-Infocard | 100.000.726 | 100.005.701 | 100.014.675 | 100.014.676 |
| 100.006.492 (unspez.) | ||||
| PubChem | 6306 | 76551 | 99288 | 94206 |
| 791 (unspez.) | ||||
| Wikidata | Q484940 | Q27103290 | Q27092902 | Q27109362 |
| Q27117434 (unspez.) | ||||
| Schmelzpunkt | Zersetzung: 284 °C[2] | |||
Remove ads
Eigenschaften
Isoleucin liegt am isoelektrischen Punkt (einem bestimmten pH-Wert) als Zwitterion (inneres Salz) vor, wobei das Proton der Carboxygruppe (–COOH) abdissoziiert ist und die Aminogruppe (–NH2) protoniert.
- Seitenkette: lipophil
- isoelektrischer Punkt: 5,94[8]
- Van-der-Waals-Volumen: 124
- Lipidlöslichkeit: LogP = 4,5
Biochemische Bedeutung
Einerseits wird Isoleucin als Baustein für den Proteinaufbau benötigt. Andererseits kann es auch zur Energiegewinnung in Muskelzellen dienen. Das spielt bei proteinreicher Kost eine Rolle oder aber bei längeren Anstrengungen und in Hungerphasen, wenn der Körper auf eigene Reserven zurückgreift. Der Abbau von Isoleucin liefert Acetyl-CoA und Propionyl-CoA.[9]
Die Einschätzungen des Tagesbedarfs für gesunde Erwachsene reichen, je nach verwendeter Methode, von 7,5 bis 28 mg Isoleucin pro Kilogramm Körpergewicht.[10] Im menschlichen Organismus kommt Isoleucin fast nur in gebundenem Zustand vor. Die Konzentration von freiem Isoleucin im Blut beträgt rund 7 mg/l, über den Urin werden pro Tag 10 bis 15 mg ausgeschieden.[11]
Remove ads
Gewinnung
Die vorwiegende Gewinnungsmethode sind Fermentationsprozesse, bei denen glukosehaltige Lösungen mit Zusatz von L-Threonin durch L-Isoleucin produzierende Mikroorganismen umgesetzt werden.[12][13] Hingegen erhält man durch Hydrolyse von Proteinen und nachfolgende Trennoperationen der Hydrolysate zunächst ein Gemisch der natürlichen Aminosäuren L-Leucin und L-Isoleucin. Diese Konstitutionsisomere lassen sich dann z. B. nach einem enzymatischen Verfahren trennen.[14]
Remove ads
Verwendung
Als Bestandteil von Aminosäure-Infusionslösungen zur parenteralen Ernährung findet L-Isoleucin, neben anderen Aminosäuren, breite Anwendung in der Humanmedizin. Für Patienten mit gestörter Verdauung wurde eine oral anzuwendende „chemisch definierte Diät“ entwickelt, die L-Isoleucin enthält. In dieser Diät bilden die Aminosäuren die Stickstoffquelle; alle lebensnotwendigen Nährstoffe liegen in chemisch genau definierter Form vor.[12]
Remove ads
Weblinks
Wikibooks: Biochemie und Pathobiochemie: Valin-, Leucin- und Isoleucin-Stoffwechsel – Lern- und Lehrmaterialien
Wiktionary: Isoleucin – Bedeutungserklärungen, Wortherkunft, Synonyme, Übersetzungen
Einzelnachweise
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads