Top-Fragen
Zeitleiste
Chat
Kontext
Colitis ulcerosa
chronisch-entzündliche Darmerkrankung beim Menschen Aus Wikipedia, der freien Enzyklopädie
Remove ads
Die Colitis ulcerosa (auch ulzerative Kolitis und ulzeröse Kolitis, abgekürzt auch UC oder CU) ist eine meist vom Enddarm ausgehende chronisch-entzündliche Darmerkrankung. Es handelt sich um eine Autoimmunerkrankung. Sie ist durch einen entzündlichen Befall des Dickdarms gekennzeichnet und verläuft in Schüben. Im Gegensatz zum Morbus Crohn ist von der Entzündung nur der Dickdarm kontinuierlich betroffen und diese ist auf die Darmschleimhaut (Mukosa) und die darunter liegende Bindegewebsschicht (Submukosa) beschränkt.
Patienten mit Colitis ulcerosa leiden an einer zum Teil erheblichen Beeinträchtigung ihrer Lebensqualität. Trotz verbesserter diagnostischer Möglichkeiten und zahlreicher neuer Therapeutika existiert kein Heilmittel. Die Therapie zielt daher darauf ab, Symptome zu mildern oder zu beseitigen, die Lebensqualität zu verbessern sowie Komplikationen vorzubeugen oder zu behandeln.
Remove ads
Häufigkeit
Zusammenfassung
Kontext
Im Jahr 1859 erkannte der britische Arzt Samuel Wilks (* 1824; † 1911) eine gastrointestinale Erkrankung, die sich von der infektiösen Gastroenteritis unterschied und die später, im Jahr 1875, als Colitis ulcerosa bezeichnet wurde.[1] Im Gegensatz dazu beschrieben Burrill Crohn, Leon Ginzburg und Gordon Oppenheimer erstmals 1932[2] die regionale Ileitis – heute bekannt als Morbus Crohn.
In Nordamerika sind über 1,5 Millionen, in Europa über 2 Millionen Menschen an Colitis ulcerosa erkrankt; in Deutschland davon ca. mindestens 150.000.[3][4] Da es in Deutschland kein zentrales Register für CU gibt und die verfügbaren epidemiologischen Daten unzureichend sind, ist eine genaue Bestimmung der Patientenzahl nicht möglich. Besonders bei Hausärzten werden CU-Patienten mit leichter Symptomatik manchmal fälschlicherweise mit Reizdarmsyndrom oder Hämorrhoiden diagnostiziert. Frauen und Männer sind gleich häufig betroffen. Das typische Erkrankungsalter liegt zwischen dem 20. und 40. Lebensjahr.[5]
Die höchste Krankheitshäufigkeit (Prävalenz) in Europa wurde in Norwegen (505 pro 100.000 Einwohner) und in Nordamerika in den USA (286 pro 100.000 Einwohner) festgestellt.[3] Deutlich niedriger liegen die höchsten Prävalenzwerte in Afrika (11), Südamerika (44) und Asien (106) pro 100.000 Einwohner. Für Deutschland wird diese im Jahr 2020 auf mindestens 90 pro 100.000 geschätzt.[6]
Die Neuerkrankungsrate (Inzidenz) ist für folgende Regionen am höchsten (Wert pro 100.000 Einwohner pro Jahr): Nordamerika mit Kanada bei 23 und Europa mit den Färöer bei 58. Demgegenüber liegen die höchsten regionalen Werte in Afrika (3,3), Südamerika (0,2) und Asien (0,8) deutlich darunter.[3] 2020 wird die Inzidenz in Deutschland auf 4 pro 100.000 Einwohnern pro Jahr geschätzt.[6]
Traditionell wurden chronisch-entzündliche Darmerkrankungen wie die Colitis ulcerosa der westlichen Welt (Länder in Westeuropa, die USA, Kanada, Australien oder Neuseeland) zugeschrieben.[3] Zum Übergang des 21. Jahrhunderts hat sich jedoch Epidemiologie verändert. Die computergestützte Auswertung weltweiter historischer epidemiologischer Daten zeigt je nach Epoche und Region Änderungen in der Prävalenz und Inzidenz, wodurch sich vier Stadien in einem Modell definieren lassen:[7]
Stadium 1 wird als Emergenz (Auftreten) bezeichnet und ist durch eine niedrige Inzidenz und Prävalenz charakterisiert. Über mehrere Jahrhunderte bleibt die Erkrankung auf vereinzelte Fälle mit dauerhaft niedriger Prävalenz beschränkt. Im Zuge der Industrialisierung, einem wirtschaftlichen Fortschritt, zunehmende Urbanisierung sowie verbesserte medizinische Versorgung und besseren Zugang zum Gesundheitswesen kommt es zu einem deutlichen Anstieg der Inzidenz, während die Prävalenz zunächst weiterhin niedrig bleibt (Stadium 2). Im Stadium 3 verlangsamt sich der Anstieg der Inzidenz oder erreicht ein Plateau, während die Prävalenz aufgrund der zunehmenden Lebenserwartung und chronischen Natur der Erkrankung deutlich ansteigt. Dies führt dazu, dass immer mehr Menschen langfristig mit der Krankheit leben. Ein weiteres Stadium 4 wurde hypothetisch beschrieben, in dem die Prävalenz ein Plateau erreicht (Prävalenzgleichgewicht). In diesem Stadium bleibt die Gesamtzahl der Erkrankten aufgrund demografischer Veränderungen, insbesondere der Alterung der IBD-Population, relativ stabil. Bislang konnte dieses Stadium jedoch epidemiologisch noch nicht eindeutig bestätigt werden.
Einige einkommensschwache Regionen in Afrika, Asien und Lateinamerika wie beispielsweise Sambia, Kasachstan oder Thailand befinden sich wahrscheinlich noch im Stadium 1. Dagegen sind jüngere Industriestaaten in Asien oder Lateinamerika in Stadium 2 verortet. Hierbei stehen Länder wie Japan oder Südkorea kurz vor Stadium 3 der Entwicklung, da sie sich schnell industrialisiert hatten. In China und Malaysia dagegen erfolgte dies später, weswegen sie erst kürzlich in Stadium 2 gelangt sind. Die meisten länger industrialisierten Länder wie die in Westeuropa oder Nordamerika sind in Stadium 3, wobei es Ausnahmen wie z. B. Irland gibt.
Remove ads
Klassifikation
Zusammenfassung
Kontext

Die S3-Leitlinie empfiehlt, eine Einteilung nach dem Befallsmuster vorzunehmen („Montreal-Klassifikation“[8]):[9]
- E1: Proktitis, limitiert auf das Rektum (distal des rektosigmoidalen Übergangs)
- E2: Linksseitencolitis, Befall bis zur linken Flexur
- E3: Ausgedehnte Colitis, Ausdehnung über die linke Flexur hinaus bis zur Pancolitis
Eine Einteilung nach der Ausdehnung ist aus folgenden Gründen sinnvoll: Zäpfchen wirken nur im Rektum (E1), nicht aber in höheren Colonregionen. Mit Einläufen erreicht man das linksseitige Colon (E2). Bei generalisiertem Befall sind lokale Therapien allein nicht ausreichend, hier ist dann eine systemische Therapie indiziert. Auch entscheidet die Ausdehnung über das Ausmaß der endoskopischen Überwachung und den Beginn des Karzinomüberwachungsprogramms.[9]
In manchen Fällen greift die Entzündung auch auf das terminale Ileum über („Backwash-Ileitis“), was eine Unterscheidung der Ileocolitis Crohn erschwert.[10]
Ein weiteres Klassifikationsmerkmal ist das gleichzeitige Vorliegen einer primär sklerosierenden Cholangitis (PSC). Die Kombination von Colitis ulcerosa und PSC bedeutet ein wesentlich höheres Risiko, ein Dickdarmkarzinom zu entwickeln. Das muss bei den Empfehlungen zur endoskopischen Überwachung berücksichtigt werden.[11]
Remove ads
Ätiologie und Pathogenese
Zusammenfassung
Kontext
Die Ursache (Ätiologie) der Erkrankung ist unbekannt, zahlreiche genetische, Umgebungs- und Lebensstilfaktoren spielen eine Rolle.[12] Ähnlich wie beim Morbus Crohn liegt eine genetisch prädisponierte, krankhaft gesteigerte und anhaltende Immunreaktion zu Grunde. Diese richtet sich gegen die mukosalen und mikrobiellen Strukturen der Darmschleimhaut. Es handelt sich in beiden Fällen um eine chronisch entzündliche, in Schüben verlaufende Darmerkrankung.[10][13]
Bakterielle Antigene spielen hierbei eine zentrale Rolle in der Entstehung chronisch-entzündlicher Darmerkrankungen (CED).[14] Veränderungen der Darmflora bei CED-Patienten, ein vermehrtes Eindringen von Bakterien in die Mukosa sowie eine gestörte Toleranz des mukosalen Immunsystems gegenüber der physiologischen Darmflora führen zu einer chronischen Immunaktivierung. Ob Barrierestörungen der Darmschleimhaut primär oder sekundär sind, ist unklar. Es wurden aber keine spezifischen Keime oder Viren als Krankheitsauslöser nachgewiesen.
Es konnten zahlreiche Genmutationen wie IL-23R[15] oder IBD3 des HLA-Systems bei Chromosm 6[16] identifiziert werden, die mit dem Auftreten von CEDs in Verbindung stehen. Gemeinsam ist hierbei u. a. eine gestörte Barrierefunktion und Entzündungsprozesse des Darms. Familiäre Vorbelastung stellt einen wesentlichen Risikofaktor für chronisch-entzündliche Darmerkrankungen wie CU dar, so haben Kinder und Geschwister von CED-Patienten ein deutlich erhöhtes Erkrankungsrisiko. Bei eineiigen Zwillingen liegt die Konkordanzrate für CU bei 6–13 %.[12] Eine familiäre Häufung ist bei etwa 10 % der CED-Patienten zu finden.[14]
Umweltfaktoren wie Hygienestandard können das Risiko, an CU zu erkranken positiv (Haustiere) oder negativ (zu gute Hygiene) beeinflussen. Bei der Ernährung wurde ein Zusammenhang zwischen einem erhöhten Risiko für CED und einem hohen Konsum von Fett sowie tierischem Protein festgestellt. Ein ballaststoffreicher Verzehr hingegen senkt das Risiko. Auch längeres Stillen, insbesondere über drei Monate hinaus, reduziert das Erkrankungsrisiko für CED. Frühes Tabakrauchen – inklusive Passivrauchen bei Kindern – senkt das Erkrankungsrisiko; zudem verläuft die Krankheit bei Rauchern milder als bei Nichtrauchern.[12] Beim Morbus Crohn dagegen ist das Erkrankungsrisiko erhöht, wie auch das postoperativen Rezidivrisiko. Nach einer akuten Gastroenteritis ist das Risiko, zeitnah an CED zu erkranken, etwa doppelt so hoch wie ohne eine solche Infektion. Vermutlich spielt dabei eine veränderte Darmflora eine Rolle, die bei genetisch veranlagten Personen den Beginn eines chronisch-entzündlichen Prozesses begünstigt. Eine Appendektomie vor dem 20. Lebensjahr senkt das Risiko für CU. Es wird untersucht, ob die Einnahme oraler Verhütungsmittel sowie eine Antibiotikatherapie vor dem 15. Lebensjahr das Erkrankungsrisiko für CEDs erhöhen kann.[12] Im Gegensatz zu kurzfristigen Stress vermag Dauerstress die Schubfrequenz der CU zu erhöhen.[14]
In der medizinischen Forschung wird abgebautes Carrageen verwendet, um die Krankheit in Tiermodellen an z. B. Ratten und Hamstern künstlich auszulösen.[17][18]
Colitis ulcerosa wurde über einen langen Zeitraum ähnlich wie Morbus Crohn zu den psychosomatischen Krankheiten gezählt, sie gehört zu den Holy Seven. Mittlerweile ist allerdings klar, dass die Colitis ulcerosa durch die genannten organischen Ursachen hervorgerufen wird, und dass die Psychosomatik allenfalls Begleit- und Folgeerscheinungen beeinflusst.[19]
Remove ads
Symptome/Beschwerden
Zusammenfassung
Kontext
Mögliche Symptome bei einer Colitis Ulcerosa sind (in der Regel nehmen die Beschwerden zu, je ausgeprägter die Entzündung ist. Einige Beschwerden können aber auch während der Remission bestehen bleiben):[20]
- Durchfälle, die oft blutig und/oder schleimig sind
- Bauchschmerzen oder Bauchkrämpfe
- klinische Zeichen eines Darmverschlusses
- Imperativer Stuhldrang
- Häufiger Stuhlgang, auch nachts
- Schmerzen vor oder nach dem Stuhlgang
- Gewichtsverlust
- Müdigkeit (bis hin zur Fatigue[21]) und Abgeschlagenheit
- Verminderte Leistungsfähigkeit und körperliche Schwäche
- Fieber
- Blutarmut und Eisenmangel
Klinisch stehen wiederkehrende (rezidivierende) Diarrhoen, Darmblutungen und Koliken im Vordergrund. Der Verlauf der Colitis ulcerosa ist nicht vorhersehbar. Häufig ist der Beginn schleichend. Es gibt aber auch akute Phasen und schwerste Verläufe.
Problematisch im Alltag sind Stuhlinkontinenz und zwanghafte Stuhlgänge, die körperliche Schwächung an sich sowie Begleiterkrankungen und die Nebenwirkung der verabreichten Medikamente. Starke Blähungen können im Schub zur erhöhten Stuhlfrequenz führen. Die schubabhängigen Blähungen liegen teils an einer schubbedingten Zuckerunverträglichkeit (etwa Lactose, Fructose, Sorbit). Krankheitsspezifische Symptome (wie Durchfälle) können stark in den Alltag der betroffenen Personen eingreifen.[22] Häufig entwickeln sich zudem Ängste und Depressionen. Entsprechend ist die Lebensqualität der Betroffenen oft verringert.[23] Auch psychischer Stress kann den Krankheitsverlauf negativ beeinflussen.[24] Hinsichtlich dieser unterschiedlichen Problemlagen ist es bei der Krankheitsbewältigung wichtig, die gesamte Lebenssituation in den Blick zu nehmen.[22]
Schwere der Erkrankung
Der Schweregrad bzw. die Aktivität einer vorliegenden Colitis ulcerosa hängt von mehreren Faktoren ab. Endoskopisch können die betroffenen Darmbereiche eine geringe Aktivität mit spröder, granulärer Mukosa mit reduzierter Gefäßzeichnung und gegebenenfalls mildem Erythem aufweisen bis zu einer schweren Aktivität in Form von (konfluierenden) Ulzera und spontanen, vorwiegend petechialen Blutungen.[4]
Eine etablierte Methode zur Erfassung der Krankheitsaktivität ist der sogenannte Mayo-Score.[27][26] Dieser geht auf eine 1987[28] in der Mayo Clinic durchgeführte klinische Studie zurück. Zur Bewertung der entzündlichen Aktivität werden vier Parameter mit jeweils 0 bis 3 Punkten bestimmt: tägliche Stuhlfrequenz über normal, das Vorhandensein rektaler Blutungen, der Endoskopiebefund (Mayo Endoscopic Score, MES) sowie die ärztliche Gesamtbeurteilung (Physician’s Global Assessment, PGA). Er wird insbesondere bei klinischen Prüfungen verwendet.[29] Der Mayo-Score kann einen Punktewert von 0 bis 12 einnehmen. Falls der MES höchstens 1 ist, wird dies in vielen klinischen Studien als mukosale Heilung (also Heilung der Darmschleimhaut) oder endoskopische Remission definiert. Dagegen empfehlen aktuelle Leitlinien einen Wert von 0 als endoskopische Heilung, was wegen der deutlich besseren Langzeitprognose als Therapieziel anzustreben ist.[25] Fällt der Punktewert des MES um mindestens einen Punkt, wird dies als endoskopisches Ansprechen betrachtet. Es gibt vereinfachte Mayo-Scores: beim modifizierten Mayo-Score (mMayo-Score) wird auf die PGA verzichtet. Der partielle Mayo-Score lässt die Endoskopie aus, da diese in der klinischen Praxis nicht jedesmal durchgeführt werden kann/soll. Beide können maximal 9 Punkte haben und korrelieren stark miteinander.[30]
Der UCEIS (Ulcerative Colitis Endoscopic Index of Severity) ist ein validiertes, neueres endoskopisches Bewertungssystem und wurde 2012[31] entwickelt.[9] Er ist dem Mayo-Score insofern überlegen, da er eine Korrelation zwischen Behandlung und Krankheitsaktivität klarer herausstellt.[32] Im Gegensatz zum MES des Mayo-Scores wird die Sprödigkeit der Darmschleimhaut nicht berücksichtigt. Der UCEIS kann Punkte im Bereich von 0 bis 8 einnehmen. Eine endoskopische Remission wird als UCEIS < 2 definiert, bei einem endoskopischen Ansprechen muss der UCEIS um mindestens 2 Punkte fallen.[25]
Extraintestinale Manifestationen
Bei Colitis ulcerosa sowie Morbus Crohn ist das Immunsystem fehlreguliert und es kommt zu systemischen Entzündungen. Daher können sich Komplikationen und Symptome auch außerhalb des Verdauungsbereichs (extraintestinal) manifestieren. Extraintestinale Symptome lassen sich in zwei Gruppen unterteilen: extraintestinale Manifestationen (EIM) und extraintestinale Komplikationen.[37] EIM können jedes Organsystem betreffen, was sich sogar teilweise negativer[38][36] als die Grunderkrankung auf das Wohlbefinden des Patienten auswirkt. So sind am häufigsten die Gelenke, die Haut, der hepatobiliäre System (Funktionseinheit aus Leber, ableitenden Gallengänge und Gallenblase) und das Auge, seltener auch Lunge, Herz, Bauchspeicheldrüse oder das Gefäßsystem betroffen. Extraintestinale Komplikationen werden hauptsächlich durch die Grunderkrankung selbst verursacht und umfassen Zustände wie Malabsorption mit daraus resultierenden Mikronährstoffmängeln, Osteoporose, periphere Neuropathien, Nierensteine, Gallensteine und medikamentenbedingte Nebenwirkungen bei entzündlichen Darmerkrankungen.
Die Häufigkeit der EIM ist unterschiedlich und wird allgemein bei chronisch-entzündlichen Darmerkrankungen mit 6 bis 47 % angegeben.[37] EIM können entweder abhängig von der Krankheitsaktivität (Zunahme der Entzündungsaktivität im Darm) wie bei Arthritis-Erkrankungen entstehen bzw. umgekehrt auf eine medikamentöse Behandlung der Entzündung des Darmes ansprechen. Sie können aber auch wie bei der Spondylitis ankylosans und Uveitis davon unabhängig sein. Es können auch mehrere EIM gleichzeitig auftreten, wobei eine bestehende EIM die Wahrscheinlichkeit für weitere erhöht. So können 3 % der Patienten fünf EIMs aufweisen.[38] Bei bis zu einem Viertel der Patienten wurden EIMs identifiziert, bevor die entzündlichen Darmerkrankung selbst diagnostiziert wurde.[34] Bei Morbus Crohn sind EIMs weiter verbreitet als bei Colitis ulcerosa.
Die genauen immunologischen Ursachen für extraintestinale Manifestationen sind noch unklar. Wahrscheinlich entstehen sie entweder durch eine Ausbreitung der Immunreaktion vom Darm auf andere Organe oder als eigenständige Entzündungsreaktion. Besonders die Entzündung im Dickdarm scheint entscheidend zu sein, da Patienten mit Dickdarmbeteiligung häufiger EIMs entwickeln.[38] Allgemein werden EIMs durch ähnliche genetische Risikofaktoren und Umweltfaktoren (insbesondere Tabakrauchen) beeinflusst, die ähnlich oder identisch mit denen der Darmentzündung sind. Das Immunsystem und die Darmflora spielen dabei eine zentrale Rolle.[36]
Von den EIMs lassen sich ferner assoziierte Autoimmunerkrankungen unterscheiden. Beobachtet wurden beispielsweise Diabetes mellitus Typ 1, Multiple Skleorse, systemischer Lupus erythematodes, Asthma oder Zöliakie.
Akuter Schub
Der akute Schub einer Colitis ulcerosa ist durch die typischen klinischen Beschwerden, das heißt blutige Diarrhoe und gegebenenfalls beständigen schmerzhaften Harn- und Stuhldrang (Tenesmus) charakterisiert. Stuhlfrequenzen von etwa 40-mal innerhalb 24 Stunden sind keine Seltenheit.

Fulminanter Schub
Bei einem schweren (fulminanten) Schub treten häufig blutige Durchfälle (Diarrhoe), Fieber über 38,5 °C und ein reduzierter Allgemeinzustand sowie Gewichtsabnahme auf. Zusätzlich kann es zu Herzrasen (Tachykardie) und Blutarmut (Anämie) kommen. Als weitere Komplikation ist das toxische Megakolon zu nennen.[39]
Chronisch aktiver Verlauf
Ein chronisch aktiver Verlauf ist gekennzeichnet durch ein Fortbestehen (Persistenz) der klinischen Symptome trotz einer angemessenen medikamentösen Therapie, die zwar eine Besserung, jedoch keine vollständige und dauerhafte (weniger als zwei Rezidive, also erneute Schübe, pro Jahr) Remission bewirkt.
Häufig entwickelt sich bei chronisch aktiven Verläufen eine Abhängigkeit von Medikamenten. Nach einiger Zeit wirken sie schwächer oder können nicht unter einem bestimmten Wert dosiert werden, ohne dass sofort wieder starke Probleme auftreten. Man spricht dann von einem refraktären (nicht ansprechenden) Verlauf.
Remission
Von einer Remission der Colitis ulcerosa wird gesprochen, wenn keine Diarrhoe (nicht mehr als drei Stühle täglich), kein sichtbares Blut im Stuhl sowie keine durch die Colitis ulcerosa bedingten Beschwerden vorliegen.[9]
Remove ads
Diagnostik/Differentialdiagnosen
Zusammenfassung
Kontext
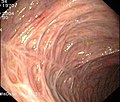
- Endoskopische Befunde bei Colitis ulcerosa
- Floride (blühende = aktive) Colitis ulcerosa
- Narbenstadium einer Colitis ulcerosa
Endoskopie
Die Diagnose Colitis ulcerosa kann nur durch eine Darmspiegelung (Koloskopie) mit Probeentnahmen (Biopsie) und anschließender feingeweblicher (histologischer) Untersuchung gestellt werden.
Differenzialdiagnostisch sind Erkrankungen mit ähnlichen endoskopischen Befunden abzugrenzen, insbesondere der Morbus Crohn, weiterhin eine infektiös oder medikamentös bedingte Kolitis, eine pseudomembranöse Kolitis, eine ischämische Kolitis oder eine Divertikelkolitis.
Labor
Bei Patienten mit Verdacht auf eine CU umfasst die grundlegende Labordiagostik ein Blutbild, inflammatorische Marker (CRP), Parameter des Eisenhaushaltes, Nierenretentionsparameter, Aminotransferasen und Cholestaseparameter.[9] Spricht der Patient auf die Therapie an, können CRP und/oder fäkale Neutrophilenmarker als laborchemische Verlaufsparameter herangezogen werden.
Bei Patienten mit milder bis moderater Colitis ulcerosa oder einem vorwiegend distalen Befall können die Laborwerte oft normal sein. Besonders bei einer Proktitis sind normalerweise keine auffälligen Laborwerte zu erwarten. Der CRP-Wert korreliert zwar mit dem Ausmaß der Erkrankung, aber nur schwach zur klinischen Aktivität. Bei starker Krankheitsaktivität sind meist auch die Blutsenkungsreaktion (BSG) erhöht und eine Anämie vorhanden. Das Ferritin selbst ist zur Beurteilung des Eisenhaushalts nur eingeschränkt aussagekräftig, da es während eines Krankheitsschubs als Akutphaseprotein erhöht sein kann und somit keine verlässlichen Informationen über die Eisenspeicher liefert.[9] Deshalb sollten bei Unsicherheiten zusätzlich die Transferrinsättigung oder der lösliche Transferrinrezeptor gemessen werden.
Fäkale Marker, insbesondere Calprotectin, haben sich in mehreren Studien als verlässliche Indikatoren für die Entzündungsaktivität bei CU erwiesen. Allerdings können weder serologische Marker wie CRP, noch fäkale Entzündungsmarker zwischen einer Colitis ulcerosa und infektiösen Ursachen unterscheiden. Besonders bei der Erstdiagnose sind daher Stuhlkulturen hilfreich, um infektiöse Kolitiden von anderen Formen zu unterscheiden.[9] So soll der Stuhl mikrobiologisch auf bakteriell infektiöse Erreger wie Campylobacter spp. oder Escherichia coli O157:H7 inklusive Clostridioides-difficile-Toxine A und B untersucht werden.
Die routinemäßige Bestimmung perinukleärer anti-neutrophiler cytoplasmatischer Antikörper (pANCA) zur Diagnose der CU und von Anti-Saccharomyces-cerevisiae-Antikörpern (ASCA) zur Abgrenzung des Morbus Crohn wird aufgrund ihrer geringen Sensitivität bis auf Einzelfälle nicht empfohlen.[9]
Remove ads
Pathologie/Morphologie


- Bei einem milden Verlauf kommt es zur ödematösen Schwellung der Darmschleimhaut.
- Bei mittleren Verlaufsformen kommt es zu leichten Blutungen und Geschwürsbildungen.
- Bei schweren Verläufen kommt es zu großflächigen Geschwürsbildungen, die zum Verlust des Reliefs und zur Schleimhautabflachung führen. Durch überschießende Regeneration kommt es zur Bildung von Pseudopolypen. Feingeweblich (histologisch) fallen Lymphozyten und Histiozyten auf, während die Zahl der Becherzellen stark vermindert ist. Als typisch, wenn auch nicht beweisend, gelten Kryptenabszesse.
- Im akuten schwersten Verlauf kann es zur toxischen Dickdarmerweiterung kommen. Dabei findet sich eine Überblähung des Bauchraumes und eine Bauchfellentzündung, außerdem besteht die Gefahr einer Perforation, weshalb jegliche invasive Diagnostik kontraindiziert ist.
Remove ads
Karzinom-Risiko
Nach längerer Erkrankungszeit und ausgedehntem Krankheitsverlauf (8–10 Jahre bei Befall des gesamten Kolons, 12–15 Jahre nach linksseitiger Kolitis) besteht ein erhöhtes Risiko für eine bösartige (maligne) Entartung. Neben der Dauer der Erkrankung stellt die Ausdehnung der Colitis ulcerosa einen eindeutigen Risikofaktor für die Entstehung eines Dickdarmkrebses (kolorektalen Karzinoms) dar und wird deshalb auch als sogenannter Vorkrebs (Präkanzerose) betrachtet.
Remove ads
Endoskopische Tumor-Vorsorge
Bei regelmäßigen koloskopischen Kontrollen mit Stufenbiopsien (Gewebeprobenentnahme aus mehreren Abschnitten des Kolons) ist das Kolitis-Karzinom selten (2,1 % nach einer Erkrankungsdauer von zehn Jahren, bei 8,5 % nach 20 Jahren und bei 17,8 % nach 30 Jahren). Es sollte daher eine jährliche Koloskopie mit Stufenbiopsien bei Patienten mit (sub-)totaler Colitis ulcerosa, die mehr als acht Jahre besteht, oder linksseitiger Colitis, die mehr als 15 Jahre besteht, durchgeführt werden.
Remove ads
Therapie
Zusammenfassung
Kontext
Allgemeine Strategie
Grundsätzlich sollte nach der aktuellen Leitlinie behandelt werden.[9] Das primäre Therapieziel ist es, die Lebensqualität zu erhalten und Komplikationen zu verhindern. Hierbei richtet man sich nach dem Schweregrad, dem Krankheitsverlauf sowie -dauer, dem Befallsmuster bzw. der Lokalisation der Erkrankung, dem Ansprechen auf vorangegangene Therapien, dem Vorliegen extraintestinaler Manifestationen und der individuellen Patientensituation.[9]
Die Krankheit verläuft in Schüben mit zwischenzeitlichen Remissionen. Schübe kündigen sich durch vermehrte blutige Durchfälle, Tenesmen, imperativer Stuhldrang (plötzliches, sofortiges und dringendes Bedürfnis, den Darm zu entleeren) und erhöhte Entzündungsparameter an. Je besser die Behandlung eines Schubes gelingt, umso länger sind die durchschnittlichen Remissionszeiten. Ziel der Behandlung eines Schubes ist vor allem, eine Remission ohne Dauerbehandlung mit Glucocorticoiden zu erzielen (steroidfreie klinische und endoskopische Remission). Gelingt dieses nicht, so handelt es sich um einen Steroid-abhängigen Verlauf mit zahlreichen Nebenwirkungen.[40]
Ein akuter Schub wird zunächst mit 5-Aminosalizylsäure (5-ASA, Mesalazin) bzw. deren Derivaten sowie Glucocorticoiden behandelt. Führt diese Therapie nicht zur Remission, spricht man von einem steroidrefraktären Schub, der eine intensivierte Behandlung erforderlich macht. Hierzu zählen insbesondere TNF-Inhibitoren, Calcineurin-Inhibitoren und weitere Immunsuppressiva. In der Remission sollte eine Erhaltungstherapie mit dem Ziel durchgeführt werden, den Zeitbis zum nächsten Schub zu verlängern und die Symptomlast zu minimieren. Bei einem fulminanten, therapieresistenten Schub, dem Auftreten bedrohlicher Komplikationen oder aus anderen Gründen kann eine Proktokolektomie erforderlich sein.
Therapeutisch soll entweder die klinische Remission eingeleitet werden, was man als Induktion bzw. Induktionstherapie bezeichnet. Oder man möchte weitere Krankheitsschübe verhindern (Erhaltungstherapie).[26]
Konventionelle Therapie
5-ASA

Bei einer leichten bis mittleren Krankheitsaktivität soll die Induktionstherapie mittels Mesalazin (auch 5-Aminosalicylsäure, 5-ASA) und deren Derivaten (Sulfasalazin, Olsalazin, Balsalazid) eingeleitet werden.[9] Die Mittel wirken direkt topisch. Mit einer rektalen Applikation vermeidet man den Kontakt mit Magen und Dünndarm, was höhere Wirkstoffkonzentrationen im entzündeten Dickdarmbereich erlaubt. Hierfür stehen Applikationen in Form von Zäpfchen, Schaum oder Einäufen zur Verfügung. Mit Hilfe von Zäpfchen kann der Mastdarm, mittels Schäumen das Sigma und durch Einläufe das absteigende Colon erreicht werden.[26] Ist die Colitis ulcerosa (CU) auf das Rektum beschränkt, kann eine zusätzliche orale Gabe von Mesalazin erwogen werden.
Falls Patienten nicht auf diese Monotherapie ansprechen, soll sie entweder mit topischen Steroiden kombiniert werden (s. u.). Alternativ ist eine orale Gabe von Mesalazin-freisetzenden Präparaten angezeigt. Solche stehen als magensaftresistente Tabletten oder Mikrogranula zur Verfügung. Die magensaftresistente Galenik der oralen Präparate soll verhindern, dass die Medikamente bereits im Magen ihre Wirkung entfalten, was Nebenwirkungen in Form einer Gastritis oder eines Magengeschwürs bewirken kann. Wegen der häufigeren Nebenwirkungen bei vergleichbarer Wirksamkeit sollte orales Mesalazin gegenüber oralem Sulfasalazin eingesetzt werden.[9] Die Kombinationstherapie wird auch bei einer leichten bis mäßig schweren linksseitigen CU angewendet.
Gemäß Leitlinie sollen 5-Aminosalizylate primär als remissionserhaltende Therapie eingesetzt werden (Erhaltungstherapie), wenn ein Ansprechen auf Aminosalizylate oder Steroide besteht. Zeigt sich diese als wirksam, soll die Erhaltungstherapie mindestens zwei Jahre fortgeführt werden. Sulfasalazin ist im Vergleich zu anderen 5-ASA-Derivate geringfügig wirksamer.[9] Als COX-2-Hemmer wirkt 5-ASA lokal antientzündlich. Zusätzlich vermindern 5-ASA-Derivate die Häufigkeit von kolorektalen Karzinomen[41], wodurch eine längere Therapie favorisiert wird.
Glucocorticoide
Wenn das 5-ASA nicht ausreicht, wird zunächst Glucocorticoid örtlich (rektal als Einlauf bzw. Schaum oder oral als Tablette mit MMX-Galenik) oder systemisch (oral oder intravenös) für kurze Zeit eingesetzt. Ist die Erkrankung auf den Enddarm und das Sigma begrenzt, bringt Budesonid-Schaum gegenüber anderen Glucocorticoidpräparaten den Vorteil, dass es nur örtlich und kaum im übrigen Organismus wirkt. Es wird bei der ersten Leberpassage abgebaut. Vitamin D soll unter einer Glukokortikoidtherapie supplementiert werden.
Fortgeschrittene Therapie
TNF-Inhibitoren
Mit Infliximab, Golimumab, Adalimumab sind drei TNF-Inhibitoren (TNFi) zur Behandlung von CU zugelassen. Gemeinsam ist deren Bindung an das Zytokin Tumornekrosefaktor-alpha (TNF-α), was dessen Wirkung neutralisiert. Golimumab und Adalimumab werden subkutan injiziert und bieten diesen Vorteil gegenüber Infliximab, das nur per Infusion verabreicht werden kann.
Integrin-Antagonisten
Seit Mai 2014 ist Vedolizumab, ein humanisierter monoklonaler Antikörper aus der Gruppe der Integrin-Antagonisten, zur Behandlung von Colitis ulcerosa oder Morbus Crohn zugelassen.
Sphingosin-1-phosphatrezeptor-Modulator
Ozanimod ist der erste, 2021 zugelassene Sphingosin-1-phosphatrezeptor-(S1PR)-Modulator und wird oral verabreicht. Es blockiert die Rezeptorsubtypen 1 und 5 (also S1P1 und S1P5), wodurch die Anzahl von zirkulierenden, aktivierten und entzündungsfördernden Lymphozyten gesenkt wird.[44] Infolgedessen wandern diese nicht mehr aus den Lymphknoten in die Darmwand, wodurch Entzündungsprozesse wieder abklingen sollen. Etrasimod wurde als zweiter Vertreter der S1PR-Modulatoren 2024 zugelassen; er bindet zusätzlich zu Ozanimod noch an S1P4.[45]
Interleukin-Inhibitoren
Mirikizumab hemmt Interleukin-23 und ist zur Behandlung mittelschwerer bis schwerer aktiver Colitis ulcerosa zugelassen, die unzureichend auf eine konventionelle Therapie oder eine biologische Behandlung angesprochen haben, nicht mehr darauf ansprechen oder diese nicht vertragen. Ustekinumab richtet sich sowohl gegen IL-12 als auch IL-23. 2024 wurde der IL-23-Inhibitor Risankizumab zur Behandlung von mittelschwerer bis schwerer aktiver CU zugelassen für Patienten, bei denen ebenfalls andere Therapien nicht ausreichend gewirkt haben oder nicht vertragen wurden.[46] Schließlich hat der IL-23-Inhibitor Guselkumab 2025 die Zulassung für die Behandlung mittelschwerer bis schwerer aktiven CU erhalten.[47]
Calcineurin-Inhibitoren
Die Calcineurininhibitoren Ciclosporin A und Tacrolimus wurde bei der Colitis ulcerosa allein oder in Kombination z. B. mit TNF-Inhibitoren eingesetzt.
Januskinase-Inhibitoren
Tofacitinib hemmt JAK1 und JAK3. Es kann bei der intensivierten Behandlung des Steroid-refraktären Schubes eingesetzt werden.[48][49] Zudem sind Filgotinib und Upadacitinib zugelassen, die die Aktivität selektiv von JAK1 inhibieren.
Sonstige Immunsuppressiva
Ist eine längerfristige Immunsuppression sinnvoll, sollte zunächst Azathioprin eingesetzt werden. Bei Unverträglichkeit kann auf 6-Mercaptopurin ausgewichen werden. Daneben stehen weitere Reservemedikamente aus der Gruppe der Antimetabolite Methotrexat (MTX) zur Verfügung. Diese kommen bei Patienten in Betracht, die auf Glucocorticoide nicht oder nicht ausreichend ansprechen und bei denen Azathioprin keine Wirkung zeigt, sowie in schwer verlaufenden Fällen oder auch begleitend zu Therapiebeginn mit Azathioprin.
Probiotika
E-Coli-Alfred Nissle-1917-Bakterien (EcN): Diese probiotischen Bakterien sind unter dem Namen Mutaflor in Apotheken erhältlich. Das Präparat muss ständig, auch beim Transport, gekühlt werden und ist nur einige Monate haltbar. Gemäß Leitlinie können sie als Ersatz von 5-ASA-Präparaten wie Mesalazin in Erwägung gezogen werden.[48] Dennoch wird Mesalazin häufiger gegenüber EcN in der klinischen Praxis bevorzugt, da sowohl die Datenlage größer ist als es auch einen zusätzlichen karzinompräventiven Effekt entfaltet. In der Induktionstherapie konnte keine Gleichwertigkeit gegenüber Mesalazin gezeigt werden.[48]
Die Britische Gesellschaft für Gastroenterologie empfehlen Probiotika nicht zur Einleitung oder Aufrechterhaltung einer Remission bei Patienten mit Colitis ulcerosa. Die Gründe sind die geringe Evidenz eines möglichen kleinen Effektes im Vergleich zu Placebo.[29]
Antikoagulantien
Je nach Intensität eines akuten Schubes besteht ein erhöhtes Risiko für thromboembolische Komplikationen. Daher wird bei höhergradigen Schüben grundsätzlich eine Behandlung mit Gerinnungshemmern empfohlen.[9]
Medikamentöse Therapie außerhalb der Leitlinie
Es befinden sich zahlreiche weitere Medikamente in der Zulassung und werden daher derzeit (2008) nur im Rahmen von Studien verwendet, viele zunächst für Morbus Crohn und evtl. später für Colitis ulcerosa, etwa Biologika, die verträglicher sein sollen als Infliximab und zum Teil auch einfacher zu verabreichen sind (etwa subkutan und ohne Gewichtsanpassung), außerdem einige schon länger bekannte Wirkstoffe, deren Wirksamkeit für die Colitis erst erkannt wird: Certolizumab, Etanercept, Basiliximab, Daclizumab, Visilizumab, Mycophenolat-Mofetil (MMF), 6-Thioguanin, Heparin, Dehydroepiandrosteron (DHEA).
Antibiotika finden kaum Verwendung. Lediglich Ciprofloxacin und Metronidazol konnten in bestimmten Fällen in Studien Linderung bringen. Schwere Schübe werden in Krankenhäusern oft zusätzlich zur bisherigen Medikation mit einer Kombination aus Antibiotika und hochdosiertem Cortison behandelt.
Chirurgische Therapie
Erste spezielle Operationsverfahren zur Behandlung der Kolitis wurden um 1900[50] durchgeführt.[51]
In fortgeschrittenen (Pancolitis) oder schwereren Fällen bei Komplikationen wie dem toxischen Megakolon kann eine Operation nötig werden. Dies bedeutet in der Regel eine vollständige Entfernung des Dickdarms (Proktokolektomie), gefolgt von einer Operation, die ileoanale Pouch-Operation genannt wird.[9] Die restaurative Proktokolektomie ist mittlerweile eine Standardoperation, Ziel ist die Wiederherstellung der gastrointestinalen Kontinuität und Erhalt der Kontinenzfunktion. Wenn ein Adenokarzinom des Darmes vorliegt, ist eine Kolektomie indiziert.[4]
Im Zuge des ileoanalen Pouches wird aus dem Dünndarm eine Art künstlicher Enddarm konstruiert, der die Reservoirfunktion des entfernten Mastdarmes übernimmt. Der Dünndarm wird dann an den Darmausgang angeschlossen, so dass die Patienten eine normale Stuhlentleerung haben. In besonders schweren Fällen oder wenn ein künstlicher Darmausgang schon länger vorliegt, wird in einem Zwischenschritt lediglich der Pouch angelegt, um ihn nach der zweiten schweren OP erst einmal zur Ruhe kommen zu lassen. Bei vorhersehbarer Stuhlinkontinenz wird mit einer Art Trichter im Zwei- bis Dreitage-Rhythmus Spülungen des Pouches (in Anbetracht des Haltens der Flüssigkeit) vorgenommen, um damit den Schließmuskel zu trainieren. Dieses Training wird nach dem Krankenhausaufenthalt selbstständig fortgeführt und erfordert einige Disziplin und am Anfang auch Überwindung. In der darauf folgenden (relativ harmlosen) OP werden dann beide Enden (Ileostoma und Pouch-Zugang) miteinander verbunden.
Die Operationen erfolgt in enger Absprache und Zusammenarbeit mit der Gastroenterologie und Viszeralchirurgie, es können erhebliche Nebenwirkungen auftreten, insbesondere das Risiko einer Pouchitis, also einer akutem oder chronischem Schleimhautentzündung des neu geschaffenen Pouches.[4] Sie ist wahrscheinlich die Folge einer Immunreaktion auf die neu etablierte Mikrobiota im Ileum-Pouch (Dysbiose).[52] Die Häufigkeit kann bis zu 40 % betragen; in 10 bis 20 % der Fälle wird die Pouchitis chronisch. Zu den Symptomen gehören häufigerer und zwanghafte Stuhlgänge, Inkontinenz (auch das unkontrollierte, meist geringe Auslaufen von Stuhl oder Schleim aus dem After), Bauchschmerzen sowie Beschwerden im Perianalbereich. Die Behandlung erfolgt hauptsächlich mit Antibiotika (Metronidazol, Ciprofloxacin oder Rifaximin); Probiotika können wirksam sein, um Rückfälle zu verhindern. Ein Pouchversagen, das eine Entfernung des Pouches oder eine dauerhafte Umleitung erfordert, tritt bei 8 bis 10 % der Patienten auf.[52] Zudem liegt ein erhöhtes Risiko vor, unfruchtbar zu werden, sowie für sexuelle Funktionsstörungen.
Eine teilweise Entfernung des Darmes kann bei speziellen Einzelfällen durchgeführt werden.[4]
Extrakorporales Therapieverfahren
Die Leukozytapherese, also die extrakorporale Entfernung einer Übermenge an Granulozyten und Monozyten, die für die Aufrechterhaltung der Entzündungsreaktion mitverantwortlich sein sollen, ist in Japan ein Standardverfahren zur Behandlung der Colitis ulcerosa. Die Leitlinien für Deutschland empfehlen die Leukozytapherese in Ausnahmefällen. Die hohen Kosten werden von den gesetzlichen Krankenkassen jedoch allenfalls nach einer Einzelfallprüfung und bei Versagen sämtlicher medikamentöser Therapieoptionen übernommen.[53]
Mangelerscheinungen
Zwar lässt sich die Erkrankung über die Ernährung nicht verhindern – mit Ausnahme des Stillens (mindestens 6 Monate) gibt es keine Ernährungsform, die das Risiko für die Entstehung einer CU-Erkrankung reduziert.[9] Im Schub sowie auch in Remission als Wechselwirkung mit Medikamenten kann es aber zu Mangelerscheinungen kommen. Auch wenn die Entzündung bei Colitis ulcerosa immer auf den Dickdarm beschränkt ist, werden bei starken Durchfällen viele Nährstoffe nicht im Dünndarm resorbiert. Mängel können daher im Schub ausgeprägt sein. Allgemein sollten zum Zeitpunkt der Erstdiagnose und im weiteren Krankheitsverlauf Anzeichen einer Mangelernährung untersucht werden.[9]
Bekannt sind ein Eisen-, ein 25-OH-Vitamin D-, ein Folsäure- und ein Zink- bzw. Selenmangel. Nach Anlage eines Ileoanalen Pouches wurden auch Vitamin B12-Mängel beschrieben.[9] Wenn ein solcher Mikronährstoffmangel identifiziert wurden, soll entsprechend gezielt supplementiert werden. Dies kann insbesondere in der Remissionsphase oral erfolgen; eine parenterale Substitution ist bei Unverträglichkeit solcher Präparate (z. B. Eisen) oder unzureichender Resorption (Eisen, Vitamin B12) insbesondere bei ausgeprägter entzündlicher Aktivität angezeigt.[9] Eine allgemeine Vitamin- oder Spurenelementsubstitution wird von der Leitlinie aber nicht empfohlen.
Auch vor einer geplanten Operation sollte bei Vorliegen einer schweren Mangelernährung eine Ernährungstherapie von mindestens sieben Tagen erfolgen. Dies liegt daran, dass Patienten mit entsprechender Mangelernährung ein deutlich erhöhtes Risiko an postoperativen Komplikationen aufweisen. Eine schwere Mangelernährung liegt vor, wenn der BMI unter 18,5 kg/m2 liegt, ein Gewichtsverlust von mehr als 10 % in den letzten 6 Monaten auftrat und/oder der Wert an Serumalbumin 30 g/l unterschreitet.
Die Leitlinie empfiehlt keine spezielle Diät oder Ernährungstherapie (z. B. eine sulfitarme Kost) zur Remissionserhaltung. Auf die Krankheitsaktivität in der akuten Phase oder bei chronisch-aktiver Colitis ulcerosa liegen für spezielle ernährungstherapeutische Maßnahmen – Trinknahrung, enterale (künstliche) und parenterale Ernährung – keine oder kaum Evidenzen vor. Allgemein sollte individuell und stufenweise zunächst eine Ernährungsberatung, dann eine zusätzliche Ernährung durch Trinknahrung, dann eine Ernährung über eine Sonde und schließlich eine parenterale Ernährung erfolgen. Eine künstliche Ernährung kann bei Zeichen einer Mangelernährung oder bei hohem Risiko für Ernährungsdefizite unterstützend eingesetzt werden.
Komplementäre Therapien
- Myrrhe: Myrrhe wird in der Naturheilkunde schon länger gegen Entzündungen innerlich und äußerlich angewendet. Neben der reinen (beim Kauen bitteren) Myrrhe stehen auch geschmacksneutrale Präparate zur Verfügung. Die Heilpflanze setzt den Spannungszustand der glatten Darmmuskulatur herab. Dadurch verringert sich die Zahl der Darmkontraktionen und Darmkrämpfe werden gelindert.[54] Außerdem reduziert Myrrhe im Darm entzündungsfördernde Prozesse und besitzt die Fähigkeit, dort die Bildung freier Radikale zu vermindern und somit das antioxidative Schutzsystem zu verstärken.[55] Verschiedene in-vitro-Untersuchungen zeigen darüber hinaus, dass Myrrhe eine gestörte Darmbarriere stabilisieren kann und das Abheilen der Darmschleimhaut bei einem Entzündungsprozess fördert.[56][57][58] Forschungen an der Universität Leipzig ergaben, dass Myrrhe und Kaffeekohle die Darmbarriere vergleichbar gut stabilisieren können wie das Kortisonpräparat Budesonid.[58] Eine klinische Studie in der remissionserhaltenden Therapie mit Myrrhe, Kamilleblütenextrakt und Kaffeekohle hat gezeigt, dass diese pflanzliche Therapie vergleichbar wirksam ist wie die Standardtherapie mit Mesalazin. Aufgrund dieser Studie empfiehlt die aktuelle S3-Leitlinie „Colitis ulcerosa“ der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS): „Eine Kombination aus Myrrhe, Kamillenblütenextrakt und Kaffeekohle kann komplementär in der remissionserhaltenden Behandlung eingesetzt werden.“[48]
- Weihrauch (Boswellia serrata): Studien deuten darauf hin, dass die im Weihrauch enthaltenen Boswelliasäuren entzündungshemmend wirken und bei entzündlichen Darmerkrankungen wie Colitis ulcerosa Linderung bringen können.[9]
- Flohsamenschalen: Eine Studie zeigte eine der Anwendung von Aminosalizylaten (z. B. Mesalazin) ähnliche Wirkung durch die Einnahme der Samenschalen des Wegerichgewächses Plantago ovata. Gemäß S3-Leitlinie kann P. ovata komplementär in der remissionserhaltenden Behandlung eingesetzt werden.[9]
- Lecithin: Gesunde Darmschleimhaut im Dickdarm enthält Lecithin, und dieses Lecithin spielt eine wichtige Rolle für die Barrierefunktion des Darms, also die Möglichkeit der Abgrenzung gegen Bakterien und Schadstoffe sowie die Möglichkeit, diese ohne Immunreaktion zu tolerieren. In Studien wurde gezeigt, dass die Darmschleimhaut von Colitis-ulcerosa-Betroffenen signifikant weniger Lecithin enthält als die von Gesunden. Da Lecithin jedoch durch Enzyme der Bauchspeicheldrüse für die Verdauung aufgespalten wird, erreicht normal verabreichtes Lecithin den betroffenen Dickdarm nicht. Um intaktes Lecithin oral bis zum Dickdarm transportieren zu können, wird ein Lecithin-Granulat für diesen Therapieansatz mit dem Polymerharz Eudragit S100 magensaftresistent mikroverkapselt, so dass das Lecithin erst im unteren Dünndarm und im Dickdarm freigesetzt wird. Eine 2014 begonnene Zulassungsstudie für ein Medikament wurde Ende 2016 aufgrund mangelnder Wirksamkeit gegenüber einem Placebo jedoch abgebrochen.[59] Gemäß den Studienautoren könnte die fehlende Wirksamkeit durch die gleichzeitige Gabe von Mesalazin verursacht worden sein, wodurch ein möglicher Effekt von Lecithin überlagert wurde und ein unabhängig bewertbarer Nutzen der Substanz nicht erkennbar war. Nachträgliche Laboruntersuchungen bestätigten diese Annahme.[60][61] Daher sind frühere positive Ergebnisse zur Wirksamkeit von Lecithin-Präparaten[62] möglicherweise doch korrekt gewesen.
- Zwar haben sich Eier des Schweinepeitschenwurms (TSO-Eier) oral eingenommen in einer kleinen monozentrischen Studie als erfolgversprechend und ohne schwerwiegende Nebenwirkungen dargestellt. Da aber eine große RCT zur Remissionsinduktion bei Morbus Crohn negativ ausgefallen ist, wird der Therapieansatz nicht mehr verfolgt.[9]
- Das curcuminhaltige Kurkuma (Curcuma longa) ist zusammen mit Mesalazin oder Sulfasalazin verabreicht für die Remissionserhaltung geeignet. Gemäß S3-Leitlinie liegen Studien mit positiven Ergebnissen in der Remissionsinduktion sowie in der Remissionserhaltung vor.[9]
- Nicotin: Colitis ulcerosa kommt bei Nichtrauchern signifikant häufiger vor als bei Rauchern.[63][64] Zwei RCTs zeigten zusätzlich positive Effekte von Nicotinpflastern, jedoch nicht als remissionserhaltende Therapie oder als alleinige Behandlungsmethode bei aktiver Colitis.[9] Nachteilig ist diese Gabe vor allem bei lebenslangen Nichtrauchern, da sie zu häufigen und teils schweren Nebenwirkungen führt.
Mitarbeit der Patienten
Zum besseren Verständnis der eigenen Situation und der aktuellen Beschwerden kann mit Hilfe eines Fragebogens[65] betroffenen Patienten eine umfassende Übersicht über ihre aktuelle Gesundheitssituation und ihr persönliches Problemprofil gegeben werden. Bei Bedarf erhalten die Betroffenen Vorschläge für passende und aussichtsreiche Unterstützungsangebote. Die Ergebnisse des Fragebogens können im Anschluss an die Auswertung als Ausgangspunkt für ein ärztliches Gespräch genutzt werden. Der Nutzen des Fragebogens und die Wirksamkeit auf die Lebensqualität von Betroffenen wurden in einer randomisierten kontrollierten Studie bestätigt.[66]
Remove ads
Impfungen
Zusammenfassung
Kontext
Die S3-Leitlinie empfiehlt, dass bei Erstdiagnose oder spätestens vor Einleitung einer immunsuppressiven Therapie der Impfstatus überprüft und ggf. aktualisiert werden sollte.[67] Impfungen mit nicht-lebenden Impfstoffen sind auch während einer solchen Behandlung sicher. Lebendimpfstoffe dagegen sollten nach Einleitung einer systemischen immunsuppressiven Therapie nicht verimpft werden bzw. die immunsuppressive Therapie in Abhängigkeit des Therapeutikums ein bis sechs Monate pausiert werden. Besonders wichtig sind Impfungen gegen Pneumokokken, Hepatitis B, Influenza und COVID-19. Der Grund hierfür ist, dass Patienten mit Colitis ulcerosa häufiger an impfpräventablen Infektionskrankheit erkranken, was dann zur Hospitalisierung führt. Während der Therapie sollten die allgemeinen Impfempfehlungen des Robert Koch-Instituts unter Berücksichtigung der Richtlinien für Menschen mit geschwächtem Immunsystem eingehalten werden. Zudem ist auch die korrespondierende Impfung von Kontaktpersonen in der engeren Umgebung von CU-Patienten empfohlen.
Bei der Behandlung mit JAK-Inhibitoren wurde festgestellt, dass das Risiko für Gürtelrose (Herpes zoster) erhöht ist.[48] Dieses Risiko steigt mit der Dosis und variiert je nach Medikament, am häufigsten bei Upadacitinib, gefolgt von Tofacitinib und Filgotinib. Deshalb sollten Patienten, die solche Medikamente bekommen, eine Impfung gegen Gürtelrose mit einem Totimpfstoff (Shingrix) angeboten bekommen.[67]
Impfungen während der Kindheit oder gegen das Influenza-A-Virus H1N1 haben keine Auswirkungen auf die Entstehung einer Colitis ulcerosa.[68]
Remove ads
Literatur
Leitlinien
- S3-Leitlinie Colitis ulcerosa (Version 7.0) der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS). In: AWMF online (Stand 07/2025)
- Torsten Kucharzik et al.: ECCO Guidelines on the Prevention, Diagnosis, and Management of Infections in Inflammatory Bowel Disease. In: Journal of Crohn's & Colitis. Band 15, Nr. 6, 22. Juni 2021, S. 879–913, doi:10.1093/ecco-jcc/jjab052, PMID 33730753 (englisch).
- Gordon W. Moran et al.: British Society of Gastroenterology guidelines on inflammatory bowel disease in adults: 2025. In: Gut. Band 74, Suppl 2, 23. Juni 2025, S. s1–s101, doi:10.1136/gutjnl-2024-334395, PMID 40550582 (englisch).
- David T. Rubin et al.: ACG Clinical Guideline Update: Ulcerative Colitis in Adults. In: The American Journal of Gastroenterology. Band 120, Nr. 6, 3. Juni 2025, S. 1187–1224, doi:10.14309/ajg.0000000000003463, PMID 40701556 (englisch).
- Joseph D. Feuerstein et al.: AGA Clinical Practice Guidelines on the Management of Moderate to Severe Ulcerative Colitis. In: Gastroenterology. Band 158, Nr. 5, April 2020, S. 1450–1461, doi:10.1053/j.gastro.2020.01.006, PMID 31945371, PMC 7175923 (freier Volltext) – (englisch).
Fachartikel
- Daniel Baumgart: Diagnostik und Therapie von Morbus Crohn und Colitis ulcerosa. In: Dtsch Arztebl Int. Nr. 106(8), 2009, S. 123–133 (aerzteblatt.de).
- Silvio Danese, Claudio Fiocchi: Ulcerative colitis. In: The New England Journal of Medicine. Band 365, Nr. 18, 3. November 2011, S. 1713–1725, doi:10.1056/NEJMra1102942, PMID 22047562 (englisch).
- Torsten Kucharzik et al. (Hrsg.): Therapie chronisch entzündlicher Darmerkrankungen. De Gruyter, 2018, ISBN 978-3-11-048542-4, doi:10.1515/9783110492682.
- Jörg C. Hoffmann et al. (Hrsg.): Chronisch-entzündliche Darmerkrankungen. 3. Auflage. Springer, 2020, ISBN 978-3-662-59103-1, doi:10.1007/978-3-662-59104-8.
- Taku Kobayashi et al.: Ulcerative colitis. In: Nature Reviews. Disease Primers. Band 6, Nr. 1, 10. September 2020, S. 74, doi:10.1038/s41572-020-0205-x, PMID 32913180 (englisch).
- Paula Sousa et al.: Management of inflammatory bowel disease in the elderly: A review. In: Digestive and Liver Disease: Official Journal of the Italian Society of Gastroenterology and the Italian Association for the Study of the Liver. Band 55, Nr. 8, August 2023, S. 1001–1009, doi:10.1016/j.dld.2022.12.024, PMID 36681569 (englisch).
Remove ads
Weblinks
- Ulcerative Colitis, MedicineNet.com (englisch)
- Bildergalerie zur Colitis ulcerosa
Überregionale Verbände
- Deutsche Morbus-Crohn-/Colitis-ulcerosa-Vereinigung (DCCV e. V.)
- Österreichische Morbus Crohn/Colitis ulcerosa Vereinigung (ÖMCCV)
- SMCCV (Schweizerische Morbus Crohn/Colitis ulcerosa Vereinigung)
- European Federation of Crohn’s and Ulcerative Colitis Associations (EFCCA) – Dachverband der europäischen Patientenvereinigungen
- Kompetenznetz chronisch entzündliche Darmerkrankungen e. V.
Einzelnachweise
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads