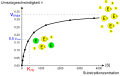بالاترین سوالات
زمانبندی
چت
دیدگاه
آنزیم
دستهای از مولکولهای زیستی که فعالیت کاتالیزی دارند. از ویکیپدیا، دانشنامه آزاد
Remove ads
آنزیم (به فرانسوی: enzyme) یا زیمایه[۱] اغلب پروتئینهایی هستند که به عنوان زیستکاتالیزور عمل میکنند. کاتالیزورها سرعت واکنشهای شیمیایی را افزایش میدهند. مولکولهایی که ممکن است آنزیمها روی آن عمل کنند بستر نامیده میشوند و آنزیم بسترها را به مولکولهای مختلفی که به عنوان فرآورده معروف هستند تبدیل میکند. تقریباً تمام فرایندهای سوختوسازی موجود در یاخته نیاز به کاتالیز آنزیم دارند تا به سرعت کافی انجام شود تا زندگی ادامه یابد. مسیرهای سوختوسازی به کاتالیز مراحل فردی آنزیمها بستگی دارند. مطالعه آنزیمها که به عنوان آنزیمشناسی یا زیمایهشناسی[a] نامیده میشود و در زمینهٔ نوینی به نام تجزیهٔ شبهآنزیمی رشد یافته است، با درک اینکه در طول فرگشت، برخی از آنزیمها توانایی انجام کاتالیز زیستی را از دست دادهاند، که غالباً در توالی آمینواسیدهای آنها و خصوصیات غیرعادی «شبه کاتالیستی» بازتاب میشود. آنزیمها بخشی از دستگاه ایمنی هستند که در بزاق، اشک، عرق و معده وجود دارد و به تجزیه و حذف هرگونه بیماریزا پاسخ میدهد
آنزیمها در بیش از ۵۰۰۰ نوع واکنش بیوشیمیایی به عنوان کاتالیزور شناخته شدهاند. سایر بیوکاتالیستها مولکولهای RNA کاتالیزوری هستند که ریبوزیم نامیده میشوند. ویژگی آنزیمها از ساختارهای سه بعدی منحصر به فرد آنها ناشی میشود. مانند همه کاتالیزورها، آنزیمها با کاهش انرژی فعالسازی، سرعت واکنش را افزایش میدهند. بعضی از آنزیمها میتوانند با تبدیل خود به بستر موجب تولید میلیونها بار سریعتر محصول شوند. اوروتیدین '۵-فسفات دکربوکسیلاز موجب میشود واکنشی که در نبود این آنزیم میلیونها سال به طول میانجامد در چند میلیثانیه رخ دهد. از نظر شیمیایی، آنزیمها مانند هر کاتالیزوری هستند و در واکنشهای شیمیایی مصرف نمیشوند و تعادل یک واکنش را تغییر نمیدهند.
آنزیمها با ویژگیهای خاصی نسبت به سایر کاتالیزورهای دیگر متفاوت هستند. فعالیت آنزیم را میتوان تحت تأثیر مولکولهای دیگر قرار داد: بازدارندهها مولکولهایی هستند که باعث کاهش فعالیت آنزیم میشوند و فعالکنندهها مولکولهایی هستند که فعالیت را افزایش میدهند. بسیاری از داروهای درمانی و سموم مهارکننده یا بازدارنده آنزیم هستند. فعالیت آنزیم بهطور قابل توجهی خارج از دمای و pH مطلوب آن کاهش مییابد و بسیاری از آنزیمها هنگام قرار گرفتن در معرض گرمای بیش از حد (پایدار) واسرشته میشوند و ساختار و خواص کاتالیزوری خود را از دست میدهند.
بعضی از آنزیمها بهصورت تجاری بهطور مثال در سنتز آنتیبیوتیکها استفاده میشوند. برخی از محصولات خانگی برای سرعت بخشیدن به واکنشهای شیمیایی از آنزیمها استفاده میکنند: آنزیمهای موجود در پودرهای شستشوی بیولوژیکی پروتئین، نشاسته یا لکههای چربی روی لباسها را تجزیه میکنند و آنزیمهای موجود در تردکنندههای گوشت پروتئینها را به مولکولهای کوچکتر تجزیه میکنند و باعث میشود گوشت راحت تر جویده شود.
Remove ads
تاریخچه
خلاصه
دیدگاه

در اواخر سده ۱۷ و اوایل سده ۱۸، هضم گوشت توسط ترشحات معده[۲] و تبدیل نشاسته به قند توسط عصارههای گیاهی و بزاق شناخته شد اما مکانیسمهایی که به موجب آن اتفاق میافتد مشخص نشده بود.[۳] شیمیدان فرانسوی، آنسلم پین اولین کسی بود که در سال ۱۸۳۳ آنزیم، دیاستاز را کشف کرد.[۴] چند دهه بعد، هنگام مطالعه تخمیر قند به الکل توسط مخمر، لویی پاستور نتیجه گرفت که این تخمیر توسط نیروی حیاتی موجود در سلولهای مخمر به نام تخمیر[b] ایجاد شده است، که تصور میشد فقط در موجودات زنده وجود دارد. وی نوشت: «تخمیر الکلی عملی است که با زندگی و سازماندهی سلولهای مخمر ارتباط دارد، نه با مرگ یا قرارگیری سلولهای مخمر.»[۵]
در سال ۱۸۷۷، ویلهلم کوهن (فیزیولوژیست آلمانی) برای اولین بار از اصطلاح آنزیم، که از واژه یونانی ἔνζυμον، به معنای «خمیر» یا «در خمیرمایه» است، برای توصیف این فرایند استفاده کرد.[۶] بعداً واژه آنزیم برای اشاره به مواد غیرزنده مانند پپسین مورد استفاده قرار گرفت و از کلمه تخمیر برای اشاره به فعالیتهای شیمیایی تولید شده توسط موجودات زنده استفاده شد.[۷] ادوارد بوخنر اولین مقاله خود را در مورد مطالعه عصارههای مخمر در سال ۱۸۹۷ ارائه کرد. در یک سری آزمایشها در دانشگاه هومبولت برلین، وی دریافت که شکر توسط عصاره مخمر حتی وقتی سلول مخمر زنده در مخلوط وجود ندارد تخمیر میشود[۸] او آنزیمی را که تخمیر ساکارز را به وجود آورد، " زیماز " نامید.[۹] وی در سال ۱۹۰۷ به دلیل «کشف یک روش تخمیر بدون سلول زنده» جایزه نوبل شیمی را دریافت کرد.[۱۰]
به دنبال نمونه بوخنر، معمولاً آنزیمها مطابق واکنشی که انجام میدهند به صورت ترکیب پسوند -آز با اضافه بستر، برای نمونه، لاکتاز آنزیمی است که لاکتوز را جدا میکند یا بسته به نوع واکنش مانند، DNA پلیمراز که پلیمرهای DNA را تشکیل میدهد نامگذاری شدهاند. هویت بیوشیمیایی آنزیمها در اوایل دهه ۱۹۰۰ ناشناخته بود. بسیاری از دانشمندان مشاهده میکردند که فعالیت آنزیمی با پروتئین همراه است، اما دیگران (مانند برنده جایزه نوبل، ریچارد ویلستر) برا این باور بودند که پروتئینها صرفاً حامل آنزیمهای واقعی هستند و پروتئینها به خودی خود قادر به کاتالیز نیستند.[۱۱]
در سال ۱۹۲۶، جیمز ب. سامنر نشان داد که آنزیم اورهآز پروتئین خالص است و موجب بلوری شدن آن میشود. او همچین در سال ۱۹۳۷ برای آنزیم کاتالاز نیز همین ترتیب را انجام داد. نتیجهگیری که پروتئین خالص میتواند همان آنزیمها باشند بهطور قطعی توسط جان هاوارد نورثروب و وندل مردیت استنلی، که در سال ۱۹۳۰ روی آنزیمهای گوارشی پپسین، تریپسین و کیموتریپسین کار میکردند نشان داده شد. این سه دانشمند جایزه نوبل شیمی را در سال ۱۹۴۶ دریافت کردند.[۱۲] این کشف که آنزیمها میتوانند متبلور شوند، درنهایت باعث شد که ساختارهای آنها با بلورشناسی پرتو ایکس حل شود و نخستین بار برای لیزوزیم، آنزیمی که در اشک، بزاق و سفیده تخممرغ یافت میشود و پوشش برخی از باکتریها را هضم میکند انجام شد. این ساختار توسط گروهی به سرپرستی دیوید چیلتون فیلیپس حل و در سال ۱۹۶۵ منتشر شد.[۱۳] ساختار با وضوح بالا ی لیزوزیم آغازگر ایجاد زمینه زیستشناسی ساختاری و تلاش برای درک نحوه عملکرد آنزیمها در سطح اتمی جزئیات بود.[۱۴]
Remove ads
نامگذاری
خلاصه
دیدگاه
نام آنزیم اغلب از زیر لایه آن یا واکنش شیمیایی که آن را کاتالیز میکند گرفته میشود، با پسوندی که به صورت -آز[c] در انتهای واژه تمام میشود.[۱۵] : 8.1.3 نمونههای آن شامل لاکتاز، الکل دهیدروژناز و دیانای پلیمراز است. آنزیمهای مختلفی که همان واکنش شیمیایی را کاتالیز میکنند، ایزوزیمز[d] نامیده میشوند.: 10.3
ردهبندی
اتحادیهٔ بینالمللی زیستشیمی و زیستشناسی مولکولی برای نامگذاری آنزیمها، عدد گروه آنزیم (شماره EC) را ایجاد کرده است. هر آنزیم توسط دنباله ای از چهار عدد پیش از "EC" که مخفف "کمیسیون آنزیم" است توصیف میشوند. شماره اول آنزیم را بهطور گسترده بر اساس مکانیسم آن طبقهبندی میکند.[۱۶] این بخشها با سایر ویژگیها از جمله بستر، محصولات و مکانیسم شیمیایی تقسیم میشوند. آنزیم با چهار نام عددی معین کاملاً مشخص میشود.[۱۷]
به عنوان مثال، هگزوکیناز (EC 2.7.1.1) یک ترانسفراز (EC 2) است که یک گروه فسفات (EC 2.7) را به یک قند هگزوز، یک مولکول حاوی گروه الکل اضافه میکند (EC 2.7.1).[۱۷]
Remove ads
ساختار
خلاصه
دیدگاه
آنزیمها بهطور کلی پروتئینهای کروی هستند که به تنهایی یا در کمپلکسهای بزرگتر[e] فعالیت میکنند. دنباله اسیدهای آمینه ساختار را مشخص میکند که به نوبه خود فعالیت کاتالیزوری آنزیم را تعیین میکند.[۱۹] گرچه ساختار عملکرد را تعیین میکند، ولی فعالیت آنزیمی جدید نمیتواند به تنهایی از طریق ساختار پیشبینی شود.[۲۰] ساختارهای آنزیمی وقتی گرم میشوند یا در معرض دناتورانتهای شیمیایی قرار میگیرند آشکار میشوند که واسرشتن نام دارد و این اختلال در ساختار معمولاً باعث از بین رفتن فعالیت میشود.[۲۱]
دناتوراسیون آنزیم معمولاً با دمای بالاتر از سطح طبیعی یک گونه مرتبط است. در نتیجه، آنزیمهای موجود در باکتریهایی که در محیطهای آتشفشانی مانند چشمههای آب گرم زندگی میکنند به دلیل توانایی عملکرد در دماهای بالا مورد مصارف صنعتی قرار میگیرند و به این ترتیب واکنشهای آنزیمی کاتالیز شده با سرعت بسیار بالایی امکانپذیر میشوند.
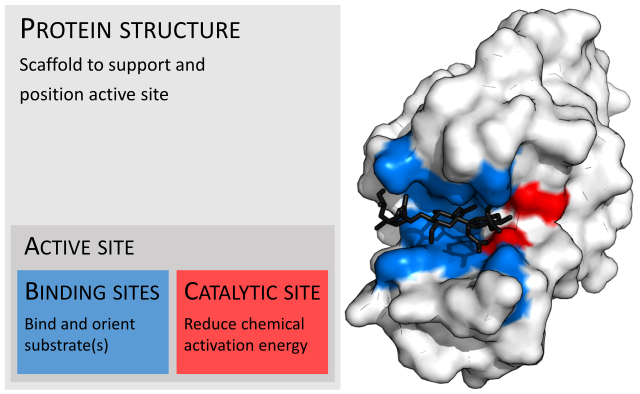
آنزیمها معمولاً بسیار بزرگتر از بسترهای آنها هستند. دامنه اندازه از ۶۲ اسید آمینه باقیمانده برای برای مونومر ۴-اگزالوکروتونات تائوتومراز،[۲۲] تا ۲۵۰۰ باقیمانده در سنتاز اسیدهای چرب حیوانات متفاوت است.[۲۳] تنها بخش کوچکی از ساختار آنها (حدود ۲–۴ آمینو اسید) که سایت کاتالیزوری نام دارد بهطور مستقیم در کاتالیز درگیر است.[۲۴] این سایت کاتالیزوری در کنار یک یا چند سایت اتصال دهنده قرار دارد که در آن ماندهها بسترها را جهت میدهند. سایت کاتالیزوریک و سایت اتصال دهنده، سایت فعال آنزیم را تشکیل میدهند. اکثریت باقیمانده ساختار آنزیم به منظور حفظ جهتگیری دقیق و پویایی محل فعال در حضور دارد.[۲۵]
در بعضی از آنزیمها هیچ اسید آمینه مستقیماً درگیر در کاتالیز نیست. در عوض آنزیم حاوی سایتهایی برای اتصال و جهتیابی کوفاکتورهای کاتالیزوری است.[۲۵] ساختارهای آنزیمی همچنین ممکن است دارای مکانهای آلوستریک باشد که اتصال یک مولکول کوچک باعث ایجاد تغییر شکل میشود که باعث افزایش یا کاهش فعالیت میشود.[۲۶]
تعداد کمی از کاتالیزورهای بیولوژیکی مبتنی بر RNA به نام ریبوزیمها وجود دارند که دوباره میتوانند به تنهایی یا در کمپلکس به همراه پروتئینها عمل کنند. رایجترین این ریبوزوم است که از پروتئین و اجزای RNA کاتالیزوری تشکیل شده است.[۱۵] : 2.2
جایگاه فعال
جایگاه فعال ناحیهای از آنزیمی است که در آن مولکولهای بستر به هم متصل میشوند و تحت واکنش شیمیایی قرار میگیرند. جایگاه فعال متشکل از باقیمانده اسید آمینه است که پیوندهای موقتی با بستر (محل اتصال) و باقی ماندهای ایجاد میکند که واکنش را کاتالیز میکند.[۲۷] اگرچه جایگاه فعال فقط ۱۰ تا ۲۰ درصد از حجم آنزیم را اشغال میکند.[۲۸]: 19 اما مهمترین بخش در ساختار یک آنزیم است زیرا مستقیماً واکنش شیمیایی را کاتالیز میکند. این ماده معمولاً از سه تا چهار اسید آمینه تشکیل میشود، در حالی که سایر اسیدهای آمینه موجود در پروتئین برای حفظ ساختار سوم آنزیم مورد نیاز است.[۲۹]
هر جایگاه فعال تکامل یافته است تا برای اتصال یک بستر خاص و کاتالیز یک واکنش خاص بهینه شود و در نتیجه ویژگی بالایی داشته باشد. این ویژگی با آرایش اسیدهای آمینه در جایگاه فعال و ساختار بسترها تعیین میشود. گاهی آنزیمها نیز برای انجام عملکرد خود نیاز به اتصال با برخی از کوفاکتورها را دارند. جایگاه فعال معمولاً یک شیار از آنزیم است که میتواند در یک تونل عمیق درون آنزیم قرار گیرد،[۳۰] یا بین رابطهای آنزیمهای چند مولتی قرار گیرد. یک جایگاه فعال میتواند یک واکنش را بهطور مکرر کاتالیز کند زیرا باقیماندهها در پایان واکنش تغییر نمیکنند (ممکن است در طول واکنش تغییر کنند، اما تا پایان دوباره تولید میشوند). این فرایند با کاهش انرژی فعال سازی واکنش حاصل میشود، بنابراین بسترهای بیشتری انرژی کافی برای انجام واکنش دارند.[۲۷]
Remove ads
سازوکار
خلاصه
دیدگاه

اتصال بستر
آنزیمها قبل از اینکه بتوانند هرگونه واکنش شیمیایی را کاتالیز کنند، باید بسترهای خود را متصل کنند. آنزیمها معمولاً مشخص میکنند که به چه لایههایی متصل میشوند و سپس واکنش شیمیایی کاتالیز میشود. ویژگی جایگاه اتصال با شکل مکمل، بار و ویژگیهای آب دوست / آبگریز به لایهها بهدست میآید؛ بنابراین آنزیمها میتوانند بین مولکولهای سوبسترا بسیار شبیه از لحاظ شیمی گزینی، جهتگزینی و استریوسپکتیک[f] تفاوت قائل شوند.[۳۱]
برخی از آنزیمهایی که بالاترین ویژگی و دقت را نشان میدهند، در کپی و بیان ژنوم نقش دارند. برخی از این آنزیمها مکانیسمهای نمونهخوانی[g] دارند. در اینجا، آنزیمی مانند DNA پلیمراز در مرحله اول یک واکنش را کاتالیز میکند و سپس در مرحله دوم صحت محصول را بررسی میکند.[۳۲] این فرایند دو مرحله ای منجر به میانگین نرخ خطای کمتر از ۱ خطا در ۱۰۰ میلیون واکنش در پلیمرازهای پستانداران با راستی بالا میشود. : 5.3.1 مکانیسمهای تصحیح مشابه نیز در RNA پلی مراز،[۳۳] آمینواسیل tRNA سنتاز[h][۳۴] و ریبوزوم یافت میشود.[۳۵]
برعکس، برخی از آنزیمها دارای خاصیت گسترده بی نظمی آنزیمی[i] هستند و بر روی طیف وسیعی از لایههای مختلف مرتبط با فیزیولوژیک اثر میگذارند. بسیاری از آنزیمها دارای فعالیتهای جانبی کوچکی هستند که بهطور اتفاقی (نظریه تکامل مولکولی خنثی[j]) بهوجود آمدهاند، که ممکن است نقطه شروع انتخاب تکاملی جدید باشد.[۳۶][۳۷]

مدل قفل و کلید
برای توضیح ویژگی مشاهده شده آنزیمها، در سال ۱۸۹۴ هرمان امیل فیشر، شیمیدان آلمانی و برنده جایزه نوبل شیمی پیشنهاد کرد که آنزیم و سوبسترا دارای اشکال هندسی مکمل خاصی هستند که دقیقاً در یکدیگر جای میگیرند. این پیشنهاد اغلب به عنوان مدل «قفل و کلید» نامیده میشود. : 8.3.2 این مدل اولیه ویژگی آنزیم را توضیح میدهد، اما قادر به توضیح ثبات حالت گذار که آنزیمها به دست میآورند نیست.[۳۸]
مدل تناسب القایی
در سال ۱۹۵۸، دانیل کوشلند اصلاحاتی را در مدل قفل و کلید پیشنهاد داد: از آنجا که آنزیمها ساختارهای نسبتاً انعطافپذیر هستند، در اثر فعل و انفعال بستر با آنزیم، سایت فعال بهطور مداوم با تعامل با بستر تغییر فرم میدهد.[۳۹] در نتیجه، بستر به سادگی به یک مکان فعال سفت و سخت متصل نمیشود. زنجیرههای جانبی اسید آمینه که جایگاه فعال را تشکیل میدهند در موقعیتهای دقیق قالببندی میشوند که آنزیم را قادر میسازد تا عملکرد کاتالیزوری خود را انجام دهد. در بعضی موارد مانند گلیکوزید هیدرولازها، مولکول سوبسترا نیز با ورود به محل فعال، اندکی تغییر شکل میدهد.[۴۰] سایت فعال همچنان تغییر میکند تا زمانی که بستر کاملاً بسته شود در آن زمان شکل نهایی و توزیع بار تعیین میشود. تناسب القایی ممکن است درستی تشخیص مولکولی را در حضوری رقابتی و نویز از طریق مکانیسم تصحیح ساختاری[k] افزایش دهد.[۴۱]
کاتالیز
آنزیمها میتوانند واکنشها را از چند طریق تسریع کنند، همه این راههای گوناگون در نهایت انرژی فعال سازی را کاهش میدهند (‡ΔG، انرژی آزاد گیبس)
- با تثبیت حالت گذار:
- ایجاد یک محیط با توزیع شارژ مکمل به حالت گذار برای کاهش انرژی آن[۴۲]
- با ارائه یک مسیر واکنش جایگزین:
- واکنش موقت با بستر، تشکیل یک واسطه کووالانسی برای ایجاد حالت انتقال انرژی پایینتر
- با بیثبات کردن حالت پایه بستر:
آنزیمها ممکن است بهطور همزمان از چندین مکانیزم استفاده کنند. به عنوان مثال، پروتئازها مانند تریپسین با استفاده از یک سهگانه کاتالیزوری، کاتالیز کووالانسی را با استفاده از یک حفره اکسیانیون[l] انجام دهند و تجمع بار را در حالت گذار تثبیت میکنند و با استفاده از یک بستر آب گرا، هیدرولیز کامل را ایجاد میکنند.[۴۵]
پویاییشناسی
آنزیمها ساختارهای ساکن و سختی نیستند. در عوض آنها دارای حرکتهای دینامیکی پیچیده داخلی شامل حرکات قسمتهایی از ساختار آنزیم مانند باقیمانده اسیدهای آمینه جداگانه، گروههای باقیمانده که یک حلقه پروتئین یا واحد ساختار ثانویه تشکیل میدهند، یا حتی یک کل حوزه پروتئین هستند. این حرکات منجر به ایجاد یک مجموعه ساختاری از ساختارهای کمی متفاوت میشود که در تعادل با یکدیگر تعامل برقرار میکنند. حالات مختلف درون این مجموعه ممکن است با جنبههای مختلف عملکرد آنزیم مرتبط باشد. به عنوان مثال، ترکیبات مختلف آنزیم دی هیدروفولات ردوکتاز مطابق با تئوری تشدید کاتالیزوری[m] با اتصال بستر، تجزیه، آزاد سازی کوفاکتور و مراحل آزاد سازی محصول از چرخه کاتالیزوری مرتبط است.[۴۶]
ارائهٔ بستر
ارائه بستر[n] فرایندی است که در آن آنزیم از بستر خود جدا میشود. آنزیمها را میتوان به غشا پلاسما به دور از یک بستر در هسته یا سیتوزول جدا کرد. یا درون غشا، یک آنزیم را میتوان به صورت تقسیم لیپید دور از بستر خود در ناحیه مختل شده جدا کرد. هنگامی که آنزیم آزاد میشود با بستر آن مخلوط میشود. متناوباً، میتوان آنزیم را در نزدیکی بستر آن جداسازی کرد تا آنزیم فعال شود. به عنوان مثال، آنزیم میتواند محلول باشد و هنگام فعال شدن به یک لیپید در غشای پلاسما متصل شود و سپس بر روی مولکولهای غشای پلاسما عمل کند.
مدولاسیون آلوستریک
مکانهای آلوستریک یا دگرریختار محلهایی روی آنزیم هستند که از جایگاه فعال متمایز هستند و به مولکولهای محیط سلولی متصل میشوند. این مولکولها سپس باعث تغییر در ساختار یا دینامیک آنزیمی میشوند که به جایگاه فعال منتقل میشود و بنابراین بر سرعت واکنش آنزیم تأثیر میگذارد.[۴۷] به این ترتیب، برهمکنش دگرریختار میتواند آنزیمها را مهار یا فعال کند. برهمکنش دگرریختار با متابولیتهای بالادست یا پایین دست در مسیر متابولیسم آنزیم باعث تنظیم بازخورد میشود و فعالیت آنزیم را با توجه به شار[o] از طریق بقیه مسیر تغییر میدهد.[۴۸]
- مکانیسم تنظیم کننده آنزیمها در تنفس سلول (قسمت پیکان سبز / بنفش نمودار مسیر فوق)
- مکانیزم واکنش کاتالیز شده با آنزیم با یک بستر واحد. آنزیم (E) به یک بستر (S) متصل میشود و محصولی (P) ایجاد میکند.
Remove ads
کوفاکتورها
خلاصه
دیدگاه

برخی از آنزیمها برای نشان دادن فعالیت کامل نیازی به مؤلفههای اضافی ندارند. برخی دیگر برای محدود کردن فعالیت به مولکولهای غیر پروتئینی به نام کوفاکتور نیاز دارند.[۴۹] کوفاکتورها میتوانند به صورت معدنی (مانند یونهای فلزی و خوشههای گوگرد آهن[p] یا ترکیبات آلی (به عنوان مثال، فلاوین[q] و هم) باشند. این کوفاکتورها اهداف بسیاری را ارائه میدهند. به عنوان مثال، یونهای فلزی میتوانند در تثبیت گونههای هستهای در محل فعال کمک کنند.[۵۰] کوفاکتورهای آلی میتوانند یا کوآنزیمهایی باشند که در طی واکنش از محل فعال آنزیم آزاد میشوند، یا گروههای پروتز که محکم به آنزیم وصل میشوند. گروههای پروتزهای آلی میتوانند به صورت کووالانسی محدود شوند (به عنوان مثال، بیوتین در آنزیمهایی مانند پیروات کربوکسیلاز).[۵۱]
کربنیک آنهیدراز نمونهای از آنزیمیست که حاوی کوفاکتور است، که از یک کوفاکتور روی که به عنوان بخشی از سایت فعال آن وجود دارد استفاده میکند.[۵۲] این یونها یا مولکولهای معمولاً در محل فعال یافت میشوند و درگیر در کاتالیز هستند.[۱۵] : 8.1.1 به عنوان مثال، فلاوین و سازندههای هم اغلب در واکنشهای ردوکس نقش دارند. : 17
به آنزیمهایی که به کوفاکتور احتیاج دارند اما محدودیتی ندارند آنزیم بنزیم یا آپوپروتئین گفته میشود. یک آنزیم همراه با کوفاکتور مورد نیاز برای فعالیت یک هولوآنزیم[r] یا هالوآنزیم[s] نامیده میشود. اصطلاح هولوزیم نیز میتواند برای آنزیمهایی از جمله DNA پلیمرازها که حاوی زیر واحدهای پروتئینی متعددی هستند استفاده شود. در اینجا هولوزانیم یک کمپلکس کامل است که شامل تمام زیر واحدهای مورد نیاز برای فعالیت است.[۱۵] : 8.1.1
کوآنزیمها (کمکزیمایهها)
کوآنزیمها مولکولهای آلی کوچکی هستند که میتوانند آزادانه یا محکم به آنزیم متصل شوند. کوآنزیمها گروههای شیمیایی را از یک آنزیم به دیگری منتقل میکنند.[۵۳] نمونههای آن شامل نیکوتینآمید آدنین دینوکلئوتید فسفات (NADPH)، نیکوتینآمید آدنین دینوکلئوتید (NADH) و آدنوزین تریفسفات (ATP) است. برخی کوآنزیمها، مانند فلاوین مونونوکلئوتید (FMN)، فلاوین آدنین دینوکلئوتید (FAD)، تیامین پیروفسفات (TPP) و تترا هیدروفولات (THF) از ویتامینها مشتق میشوند. این کوآنزیمها نمیتوانند توسط بدن طی فرایند سنتز نوپدید ساخته شوند و ترکیبات (ویتامینها) که از نزدیک مرتبط هستند باید از رژیم غذایی حاصل شود. گروههای شیمیایی حمل شده شامل موارد زیر هستند:
- یون هیدرید (-H)، که توسط +NAD یا NADP حمل شده است.
- گروه فسفات، توسط آدنوزین تریفسفات حمل شده است.
- گروه استیل، توسط کوآنزیم آ حمل شده است.
- گروههای فرمیل، متیل یا متیل، توسط اسید فولیک حمل شده است؛ و
- گروه متیل، توسط اس-آدنوزیل متیونین حمل شده است.[۵۳]
از آنجا که کوآنزیمها به عنوان یک نتیجه از عمل آنزیم شیمیایی تغییر مییابند، در نظر گرفتن کوآنزیمها به عنوان یک کلاس خاص از سوبستراها، یا سوبستراهای دوم مفید است که برای بسیاری از آنزیمهای مختلف مشترک است. به عنوان مثال، حدود ۱۰۰۰ آنزیم شناخته شده است که از کوآنزیم NADH استفاده میکنند.[۵۴]
کوآنزیمها معمولاً بهطور مداوم بازسازی میشوند و غلظت آنها در سطح ثابت داخل سلول حفظ میشود. به عنوان مثال، NADPH از طریق مسیر فسفات پنتوز و اس-آدنوزیل متیونین توسط متیونین آدنوزیلترانسفراز بازسازی میشود. این بازسازی مداوم یعنی مقادیر کمی از کوآنزیمها میتوانند بسیار فشرده استفاده شوند. به عنوان مثال، بدن انسان هر روز وزن خود را در ATP تغییر میدهد.[۵۵]
Remove ads
ترمودینامیک
خلاصه
دیدگاه
مانند همه کاتالیزورها، آنزیمها موقعیت تعادل شیمیایی واکنش را تغییر نمیدهند. در حضور آنزیم، واکنش در همان جهت که آنزیم نیز حضور ندارد انجام میشود فقط حضور آنزیم موجب میشود که با سرعت بیشتری انجام شود.[۱۵] : 8.2.3 به عنوان مثال، انیدراز کربنیک بسته به غلظت واکنش دهندههای آن، واکنش آن را از هر جهت تغییر میدهد:[۵۶]
-
(in tissues; high CO2 concentration)
()
-
(in lungs; low CO2 concentration)
()

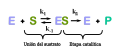
میزان واکنش بستگی به انرژی فعالسازی مورد نیاز برای تشکیل حالت گذار دارد که پس از آن در محصولات فروپاشی میشود. آنزیمها با کاهش انرژی حالت گذار، سرعت واکنش را افزایش میدهند. اول، اتصال یک مجموعه پیچیده آنزیم-سوبسترا کم انرژی (ES) را تشکیل میدهد. دوم، آنزیم وضعیت انتقال را به گونهای تثبیت میکند که در مقایسه با واکنش غیرقابل تجزیه (ES ‡) به انرژی کمتری برای رسیدن به آن نیاز دارد. سرانجام، کمپلکس آنزیم-محصول (EP) برای انتشار محصولات جدا میشود.[۱۵] : 8.3
آنزیمها میتوانند دو یا چند واکنش ایجاد کنند، بهطوری که میتوان از یک واکنش ترمودینامیکی مطلوب برای «رانش» ترمودینامیکی نامطلوب استفاده کرد بهطوری که انرژی ترکیبی محصولات پایینتر از سوبستراها باشد. به عنوان مثال، هیدرولیز ATP اغلب برای هدایت سایر واکنشهای شیمیایی استفاده میشود.[۵۷]
Remove ads
سینتیک
خلاصه
دیدگاه
مکانیسم یک واکنش شیمیایی با و بدون کاتالیز آنزیمی. آنزیم (E) به سوبسترا (S) اتصال مییابد تا فراورده (P) تولید گردد.
منحنی اشباع یک واکنش آنزیمی که رابطهٔ میان غلظت سوبسترا و سرعت واکنش را نشان میدهد.
سینتیک آنزیم بررسی چگونگی اتصال آنزیمها به سوبستراها و تبدیل آنها به محصولات است.[۵۸] دادههای نرخ استفاده شده در آنالیزهای سینتیکی معمولاً از سنجش آنزیمی به دست میآیند. در سال ۱۹۱۳ لیونور میکائلیس و ماد منتن نظریه کمی از سینتیک آنزیم را مطرح کردند که از آن به عنوان سینتیک میکائلیس–منتن یاد میشود.[۵۹] سهم عمده میکائلیس و منتن در فکر کردن به واکنشهای آنزیمی در دو مرحله بود. در حالت اول، سوبسترا برگشتپذیر به آنزیم متصل میشود، و کمپلکس آنزیم-سوبسترا را تشکیل میدهد که به افتخار آنها مجموعه کمپلکس میکائلیس و منتن نامیده میشود. سپس آنزیم مرحله شیمیایی واکنش را کاتالیز میکند و محصول را آزاد میکند. این کار توسط جرج ادوارد بریگز و جان هالدین توسعه یافت. آنها معادلات سینتیک را بهدست آوردند که امروزه هنوز هم کاربرد گستردهای دارند.[۶۰]
میزان آنزیم به شرایط محلول و غلظت سوبسترا بستگی دارد. برای پیدا کردن حداکثر سرعت یک واکنش آنزیمی، غلظت سوبسترا افزایش مییابد تا اینکه یک مقدار ثابت در شکلگیری محصول مشاهده شود که در منحنی اشباع مقابل نشان داده شده است. با افزایش غلظت سوبسترا، بیشتر و بیشتر آنزیم آزاد به کمپلکس substrate-bound ES ES تبدیل میشود و اشباع رخ میدهد. در ماکزیمم سرعت واکنش (V Max) آنزیم، تمام سایتهای فعال آنزیم به سوبسترا متصل شده و مقدار کمپلکس ES همان مقدار کل آنزیم است.[۱۵] : 8.4
V max تنها یکی از چند پارامتر مهم سینتیکی است. مقدار بستر مورد نیاز برای دستیابی به میزان واکنش خاص نیز مهم است که توسط ثابت سینتیک میکائلیس–منتن (Km) که غلظت بستر مورد نیاز یک آنزیم برای رسیدن به نیمی از سرعت واکنش حداکثر (V max) آن است، داده شده است. بهطور کلی، هر آنزیم دارای یک KM ویژه برای یک بستر مشخص است. یکی دیگر از ثابتهای مفید، kcat است که به آن عدد گردش نیز گفته میشود و تعداد مولکولهای بستر است که توسط یک سایت فعال در هر ثانیه اداره میشود.[۱۵] : 8.4
کارایی یک آنزیم را میتوان بر حسب kcat/Km بیان کرد که ثابت ویژه نیز نامیده میشود و ثابت سرعت را برای همه مراحل واکنش را شامل میشود. از آنجا که ثابت ویژه هم میل ترکیبی و هم توانایی کاتالیزوری را بازتاب میدهد، برای مقایسه آنزیمهای مختلف با یکدیگر یا همان آنزیم با لایههای مختلف مفید است. حداکثر نظری برای ثابت ویژه را حد انتشار مینامند که حدود 108 تا 109 (M−1 s−1) است. در این مرحله، هر برخورد آنزیم با بستر آن منجر به کاتالیز میشود و سرعت تشکیل محصول با سرعت واکنش محدود نمیشود بلکه با سرعت انتشار محدود میشود. آنزیمهای دارای این ویژگی را آنزیم کاملاً کاتالیزوری[t] یا از نظر جنبشی کامل مینامند. نمونه این نوع آنزیمها تریوز فسفات ایزومراز، کربنیک آنهیدراز، استیلکولیناستراز، کاتالاز، فوماراز، بتالاکتاماز و سوپراکسید دیسموتاز هستند. : 8.4.2 تغییر و تبدیل این نوع آنزیمها میتواند به چندین میلیون واکنش در ثانیه برسد. : 9.2 اما بیشتر آنزیمها کاملاً کاتالیزوری نیستند: مقادیر متوسط مقدار و به ترتیب حدود و است.[۶۱]
سینتیک میکائلیس–منتن به قانون فعالیت جرمی[u] متکی است، که از مفروضات واپخش آزاد و برخورد تصادفی از ترمودینامیک ناشی میشود. بسیاری از فرایندهای بیوشیمیایی یا سلولی به دلیل ازدحام ماکرومولکولی[v] و حرکت مولکولی محدود، از این شرایط بهطور قابل توجهی منحرف میشوند.[۶۲] اخیراً، با گسترش نمونه کمپلکس سعی در اصلاح این اثرات دارند.[۶۳]
۲. واکنشهای مرتبه صفر و شرایط مورد نیاز واکنشهای مرتبه صفر زمانی رخ میدهند که سرعت واکنش مستقل از غلظت سوبسترا باشد. این حالت معمولاً زمانی مشاهده میشود که غلظت سوبسترا بسیار بیشتر از غلظت آنزیم باشد.[۶۴]
آنزیمها با کاهش انرژی فعالسازی، سرعت واکنشهای بیوشیمیایی را افزایش میدهند. مکانیسم عملکرد آنها شامل تشکیل کمپلکس آنزیم-سوبسترا و تولید محصولات نهایی است.[۶۵]
در شرایطی که سوبسترا در مقادیر اضافی وجود دارد، سرعت واکنش مستقیماً با غلظت آنزیم متناسب است. این رابطه خطی اساس بسیاری از آزمایشهای آنزیمی را تشکیل میدهد.[۶۶]
مدل مایکلیس-منتن سینتیک آنزیمی را در شرایط استاندارد توصیف میکند، در حالی که مدل هیل برای آنزیمهای آلوستریک با همکاری بین زیرواحدها مناسب است.[۶۷]
بازدارندههای آنزیمی به سه دسته تقسیم میشوند:
- رقابتی: با سوبسترا برای اتصال به جایگاه فعال رقابت میکنند.
- غیررقابتی: به قسمت دیگری از آنزیم متصل میشوند.
- نارقابتی: فقط به کمپلکس آنزیم-سوبسترا متصل میشوند.[۶۸]
روشهای اندازهگیری فعالیت آنزیمی:
- طیفسنجی: اندازهگیری تغییرات جذب نور.
- فلورومتری: استفاده از خاصیت فلورسانس.
- الکتروشیمیایی: تشخیص تغییرات پتانسیل اکسیداسیون-احیا.[۶۹]
اندازهگیری فعالیت آنزیمهای خاص در خون برای تشخیص بیماریها استفاده میشود:
کبدی: ALT, AST
قلبی: CK-MB, Troponin
پانکراس: آمیلاز، لیپاز[۷۰]
با استفاده از مهندسی پروتئین، آنزیمهایی با ویژگیهای بهبودیافته تولید میشوند که در صنایع غذایی، دارویی و بیوتکنولوژی کاربرد دارند.[۷۱]
مطالعه سینتیک آنزیمی نقش مهمی در بیوشیمی، پزشکی و صنعت ایفا میکند. درک دقیق این مفاهیم به بهینهسازی واکنشهای آنزیمی و توسعه روشهای تشخیصی و درمانی کمک میکند.[۷۲]
آنزیمهای آلوستریک با اتصال مولکولهای تنظیمی در جایگاههای غیرفعال، فعالیت کاتالیتیکی خود را تغییر میدهند. این مکانیسم نقش کلیدی در مسیرهای متابولیکی مانند گلیکولیز دارد.[۷۳]
برخی آنزیمها مانند فسفوفروکتوکیناز-۱ در گلیکولیز به عنوان نقاط کنترل سرعت عمل میکنند. این آنزیمها اغلب محل تنظیم هورمونی و متابولیکی هستند.[۷۴]
روشهای مدرن تعیین ساختار آنزیمها: - کریستالوگرافی اشعه ایکس - میکروسکوپ الکترونی کرایو - طیفسنجی NMR این روشها به درک رابطه ساختار-عملکرد آنزیمها کمک شایانی کردهاند.[۷۵]
آنزیمهایی مانند آسپاراژیناز در درمان سرطان خون و الگلوکرازیداز در درمان بیماری گوچر استفاده میشوند. این آنزیمها با مهندسی دقیق برای کاهش عوارض جانبی بهینهسازی شدهاند.[۷۶]
نانوزیمها نانوذراتی با فعالیت آنزیممانند هستند که پایداری بالاتر و هزینه تولید کمتری نسبت به آنزیمهای طبیعی دارند.[۷۷]
این آنزیمها در شرایط شدید مانند دمای بسیار بالا یا pHهای اسیدی/بازی فعالیت دارند و در صنایع مختلف کاربردهای ارزشمندی دارند.[۷۸]
در سلول، آنزیمهای مرتبط با یک مسیر متابولیکی اغلب به صورت کمپلکسهای چندآنزیمی سازماندهی میشوند که کارایی واکنشها را افزایش میدهد.[۷۹]
شبیهسازیهای کوانتومی به درک دقیق مکانیسمهای کاتالیتیکی در سطح اتمی کمک میکنند.[۸۰]
با استفاده از روشهای طراحی محاسباتی، میتوان آنزیمهای کاملاً جدید با فعالیتهای کاتالیتیکی نوظهور ایجاد کرد.[۸۱]
Remove ads
بازداری
خلاصه
دیدگاه
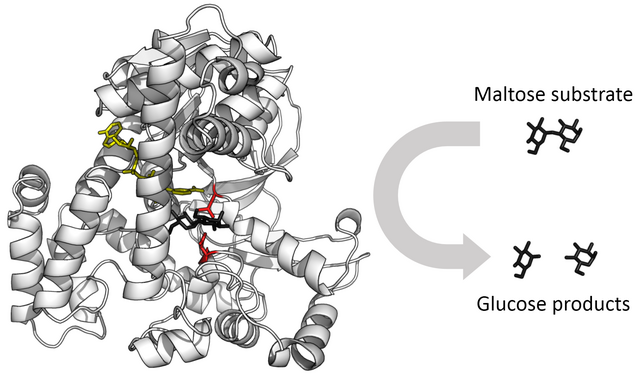
جایگاه اتصالی آنزیم که معمولاً به سوبسترا میچسبد، میتوان در عین حال، به بازدارنده رقابتی متصل شود که اجازه نمیدهد سوبسترا به آنزیم وصل شود. به عنوان مثال، داروی متوترکسات که یک بازدارندهٔ رقابتی است به آنزیم دی هیدروفولات ردوکتاز چسبیده و به اسید فولیک اجازهٔ اتصال نمیدهد.[۸۲] در این تصویر، جایگاه اتصال آبی، بازدارندهٔ رقابتی سبز، و سوبسترا مشکی است. (پیدیبی 4QI9)
کوآنزیم اسید فولیک (چپ) و داروی ضد سرطان متوترکسات (راست) بهلحاظ ساختاری بسیار شبیه به هم هستند (اختلافشان با رنگ سبز نمایش داده شده است). در نتیجه، داروی متوترکسات، بازدارندهٔ رقابتی بسیاری از آنزیمهایی است که از فولات استفاده میکنند.
میزان سرعت واکنش آنزیم به وسیله انواع مختلفی از مهارکنندههای آنزیم قابل کاهش است. بازدارندههای آنزیمی عوامل مولکولی هستند که با کاتالیزوز تداخل پیدا کرده و واکنشهای آنزیمی را آهسته یا متوقف میکنند. بازدارندهها به صورت برگشتپذیر یا برگشتناپذیر هستند. بازدارندههای برگشتپذیر عبارتند از:[۸۳] : 73–74
برگشتپذیر
رقابتی
یک بازدارندهٔ رقابتی به خاطر تشابه در هندسه مولکولی یا سوبسترا برای جایگاه فعال آنزیم رقابت میکند با اشغال جایگاه فعال توسط بازدارنده از اتصال سوبسترا با آنزیم ممانعت میکند. مهارکننده (Competitive inhibition) و سوبسترا نمیتوانند همزمان با آنزیم متصل شوند.[۸۴] اغلب مهار کنندههای رقابتی کاملاً شبیه سوبسترا واقعی آنزیم هستند. به عنوان مثال، داروی متوترکسات یک مهار کننده رقابتی آنزیم دی هیدروفولات ردوکتاز است که باعث کاهش دی هیدروفولات به تتراهیدروفولات میشود.[۸۲] شباهت بین ساختارهای دی هیدروفولات و این دارو در شکل نشان داده شده است. با غلظت زیاد سوبسترا میتوان بر این نوع مهارکننده غلبه کرد. در برخی موارد، مهارکننده میتواند به سایتی غیر از محل اتصال سوبسترا معمولی وصل شود و یک اثر آلوستریک برای تغییر شکل محل اتصال معمولی اعمال کند.[۸۵]
نارقابتی
مهارکننده غیر رقابتی (Non-competitive inhibition) به مکانی غیر از محل اتصال سوبسترا متصل میشود. سوبسترا هنوز هم با تمایل معمول آن متصل میشود و از این رو Km یکسان باقی میماند. با این حال بازدارنده بازده کاتالیزوری آنزیم را کاهش میدهد بهطوری که V max کاهش مییابد. برخلاف مهار رقابتی، نمیتوان با غلظت زیاد سوبسترا بر مهار غیر رقابتی سوبسترا غلبه کرد. مهار آنزیم انولاز در مسیر گلیکولیز توسط یون فلوئور نوعی از مهار غیر رقابتی است.[۸۳] : 76–78
بیرقابتی
مهارکننده بدون رقابت (Uncompetitive inhibitor) نمیتواند تنها به مجموعه آنزیم سوبسترا وصل شود، از این رو، این نوع مهارکنندهها در غلظت بالای سوبسترا مؤثر هستند. در حضور مهارکننده، مجموعه آنزیم-سوبسترا غیرفعال است.[۸۳] : 78 این نوع مهار نادر است. یک بازدارندهٔ نارقابتی در مکانی غیر از سوبسترا به آنزیم متصل شده و برخلاف مهارکنندهٔ رقابتی تنها به کمپلکس ES متصل میشود.[۸۶]
آمیخته
یک مهار کننده مخلوط (Mixed inhibition) به یک سایت آلوستریک متصل میشود و اتصال سوبسترا و بازدارنده روی یکدیگر تأثیر میگذارند. عملکرد آنزیم هنگام اتصال به بازدارنده کاهش مییابد اما از بین نمیرود. این نوع بازدارندهها از معادله میکائلیس–منتن پیروی نمیکنند.[۸۳]: 76–78
برگشتناپذیر
یک بازدارنده برگشتناپذیر، آنزیم را معمولاً با ایجاد پیوند کووالانسی به پروتئین بهطور دائمی غیرفعال میکند.[۸۷] پنیسیلین[۸۸] و آسپرین داروهای رایجی هستند که به این روش عمل میکنند.[۸۹]
کارکرد
در بسیاری از جانداران، بازدارندهها ممکن است به عنوان بخشی از یک مکانیسم بازخورد عمل کنند. اگر یک آنزیم بیش از حد یک ماده در ارگانیسم تولید کند، ممکن است آن ماده به عنوان یک بازدارنده برای آنزیم در ابتدای مسیر تولیدکننده آن عمل کند و باعث کند شدن تولید ماده در صورت وجود مقدار کافی شود که نوعی بازخورد منفی است. مسیرهای متابولیکی عمده مانند چرخه اسید سیتریک از این مکانیسم استفاده میکنند.[۱۵]: 17.2.2
از آنجا که بازدارندهها عملکرد آنزیمها را تعدیل میکنند، اغلب به عنوان دارو استفاده میشوند. بسیاری از این داروها بازدارندههای قابل برگشت رقابتی هستند که شبیه سوبسترا بومی آنزیم هستند، مشابه متوترکسات که در بالا اشاره شد، سایر نمونههای معروف شامل استاتینهایی است که برای درمان کلسترول بالا استفاده میشود،[۹۰] و بازدارندههای پروتئاز که برای درمان عفونتهای ویروسی مانند ویروس HIV استفاده میشود.[۹۱] یک نمونه معمول از یک بازدارنده برگشتناپذیر که به عنوان دارو استفاده میشود، آسپرین یا استیلسالیسیلیک اسید است که آنزیمهای COX-1 و COX-2 را که پروستاگلاندین پیام رسان التهاب را مهار میکنند.[۸۹] دیگر بازدارندههای آنزیم سموم هستند. به عنوان مثال، سیانور یک مهارکننده آنزیم برگشتناپذیر است که با مس و آهن در محل فعال آنزیم سیتوکروم اکسیداز سی ترکیب شده و از تنفس سلولی جلوگیری میکند.[۹۲]
- انواع بازداری انزیم
- یک بازدارنده رقابتی بهطور برگشت پذیر به محل فعال آنزیم متصل میشود و از اتصال بستر جلوگیری میکند. به لطف رقابت بین بستر و بازدارنده برای محل فعال ، میتوان سرعت واکنش را کنترل کرد. در مهار غیر رقابتی ، بازدارنده با بستر سایت فعال رقابت نمیکند ، اما در جای دیگر متصل میشود ، منجر به تشکیل یک مجموعه غیر فعال میگردد.
- کوآنزیم NADH متصل به سیتوکروم B5 ردوکتاز
- بازدارندههای رقابتی ، آنزیم را بهطور برگشت پذیر متصل میکنند و از اتصال به بستر جلوگیری میکنند. از طرف دیگر اتصال به بستر از اتصال بازدارنده جلوگیری میکند.
- بازدارندههای غیررقابتی سایتهای جایگزین را به محلی که بستر را متصل میکند متصل میکنند. اتصال این مهارکنندهها ، ایجاد تغییرات ساختاری مانند جلوگیری از ورود بستر یا تولید دفع آن است.
Remove ads
تثبیت آنزیم
خلاصه
دیدگاه
آنزیمها غالباً در بسترهای بیاثر و نامحلول تثبیت میشوند که به دلیل قابلیت استفاده مجدد چند برابر، کارایی آنها را افزایش میدهند. خواص آنزیمهای تثبیتشده به روش تثبیت و نوع پایه بستگی دارد. انتخاب پایه معمولاً مربوط به سازگاری زیستی، پایداری شیمیایی و حرارتی، عدم انحلالپذیری در شرایط واکنش، قابلیت بازسازی و استفاده مجدد آسان و همچنین بازده هزینه است.[۹۳]
اکثر آنزیمها نسبتاً ناپایدار هستند و هزینههای تولید و جداسازی بالایی دارند و این یک نقطه ضعف را نشان میدهد که بازیابی آنزیمهای فعال در مخلوط واکنش پس از استفاده از نظر فنی بسیار دشوار است.[۹۴] آنزیمهای تثبیتشده مورد توجه بسیاری قرار گرفته که مایلند از فناوری تثبیت آنزیم برای اهداف خاص در بخشهای پزشکی و صنعتی استفاده کنند.[۹۵] اصطلاح «آنزیمهای تثبیتشده» به آنزیمهایی گفته میشود که از نظر فیزیکی به تکیهگاههای جامد خاص متصل شده و بنابراین محدود شدهاند و میتوانند بهطور مکرر و مداوم با حفظ فعالیتهای کاتالیزوری خود مورد استفاده قرار گیرند.[۹۶]
در سالهای اخیر، بهطور موازی با درک مکانیسمهای بیوسنتز آنزیمی، بهرهوری آنزیمی از طریق بهبود فناوری مهندسی ژنتیک، فناوری کشت میکروبی در حال رشد است. استفاده از آنزیم تثبیتشده در بیوتکنولوژی دارای مزایایی است.[۹۷] معرفی کاتالیزورهای آنزیمی تثبیتشده، عملکرد فنی فرایندهای صنعتی را بسیار بهبود بخشیده و در نتیجه راندمان و بهرهوری اقتصادی را افزایش داده است. آنزیمهای تثبیتشده معمولاً پایدارتر از آنزیمهای متحرک هستند، میتوان با حذف آنزیم از محلول واکنش، سرعت واکنش را کنترل کرد. یک مزیت این فناوری جداسازی آسان آنزیم از محصول است تا بتوان از آلودگی جلوگیری کرد. همچنین، استفاده از آنزیم تثبیتشده امکان ایجاد یک سیستم واکنش چندآنزیمی را فراهم میکند. طی دهههای گذشته، مطالعات بیوشیمیایی و بیوفیزیکی به منظور افزایش پایداری و فعالیت آنزیمها از طریق تثبیت آنزیمها، بهطور فعال انجام شده است.[۹۸]
الکترود آنزیمی
این بخش نیازمند گسترش است میتوانید با افزودن به آن کمک کنید. |
الکترود آنزیمی یک مبدل شیمیایی کوچک است که با ترکیب یک روش الکتروشیمیایی با فعالیت آنزیم بی حرکت کار میکند. برای نمونه از گلوکز اکسیداز تثبیت شده روی ژل برای اندازهگیری غلظت گلوکز در محلولهای بیولوژیکی و در بافتهای آزمایشگاهی استفاده میکند.[۹۹]
آنزیمها اجزای اساسی کاتالیزوری زیستشناسی هستند و آنزیمهای فعال اکسیداسیون ردوکس را در سطوح الکترود جذب میکنند و امکان جستجوی مستقیم عملکرد آنها را فراهم میکند. از طریق اندازهگیریهای الکتروشیمیایی استاندارد، فعالیت کاتالیزوری، برگشتپذیری و پایداری، پتانسیل کوفاکتورهای فعال ردوکس و سرعت انتقال الکترون بین سطحی را میتوان به راحتی اندازه گرفت. تحقیقات مکانیکی در مورد نرخ بالای الکتروکاتالیستی و انتخاب آنزیمها ممکن است از طراحی الکتروکاتالیستهای مولکولی و ناهمگن مصنوعی الهام بگیرد. تحقیقات الکتروشیمیایی آنزیمها همچنین به درک ما از فعالیت آنها در محیط بیولوژیکی و چرایی تکامل آنها در ساختار و عملکرد فعلی کمک میکند. با این حال، آرایه متداول تکنیکهای الکتروشیمیایی (به عنوان مثال، ولتامتری و کرونوآمپومتری) به تنهایی یک تصویر محدود از رابط آنزیم-الکترود را ارائه میدهد.[۱۰۰]
در حسگرهای زیستی و سلولهای سوخت زیستی، اغلب سرعت انتقال الکترون بین سطح آنزیم و الکترود برای بهبود عملکرد دستگاهها (حساسیت یا توان خروجی) مطلوب است. سه استراتژی مهم در دسترس برای بهبود عملکرد الکترودهای اصلاح شده با آنزیم: استفاده از مهندسی پروتئین، پلیمرهای طراح (designer polymers) و نانومواد است. مهندسی پروتئین یا پروتئینهای تشکیل دهنده عناصر بیوکاتالیستی امکان تنظیم ثبات، فعالیت و ویژگی آنها را فراهم میکند. همچنین میتواند باعث تغییر کارایی بی حرکتی آنزیم شود (به عنوان مثال جذب در مقابل بیحرکتی کووالانسی). اگر انتقال مستقیم الکترون مطلوب نباشد، ممکن است بتوان پلیمرهایی را در سیستم وارد کرد که انتقال الکترون را به سطح الکترود یا از آن واسطه میکنند. اخیراً پیشرفت چشمگیری در طراحی پلیمرها برای اصلاح الکترودها، از جمله پلیمرهای منقوش مولکولی و پلیمرهای پاسخ دهنده، حاصل شده است. سومین عنصری که میتواند در الکترودها گنجانده شود، ذرات نانو است. این نانومواد میتوانند به عنوان داربست از طریق جذب یا واکنش شیمیایی با گروههای عاملی، افزایش سطح و مقاومت الکترود، عناصر بیولوژیکی را بی حرکت کنند. انبوهی از نانومواد به عنوان بخشی از جدیدترین الکترودهای اصلاح شده با آنزیم، از جمله گرافن، نانولولههای کربنی، نانوذرات فلزی، سیلیسها و چارچوبهای فلزی - آلی در حال آزمایش است. بعضی از اینها همچنین میتوانند به عنوان نانوسیم طراحی شوند تا بتوانند انتقال مستقیم الکترون از نقاط فعال دیستال را در آنزیمها انجام دهند یا کوتاه کنند.[۱۰۱]
- زیست حسگر گلوکز
- زیست حسگر خودکار
- زیست ابرخازن خود شارژ
Remove ads
عاملهای اثرگذار بر فعالیت آنزیم
خلاصه
دیدگاه
این بخش نیازمند گسترش است میتوانید با افزودن به آن کمک کنید. |
این بخش به هیچ منبع و مرجعی استناد نمیکند. |
از آنجا که آنزیمها از پروتئین تشکیل شدهاند، عملکرد آنها نسبت به تغییر در بسیاری از عوامل شیمیایی فیزیکی مانند pH، دما، غلظت بستر و غیره حساس است.
غلظت آنزیم
به منظور بررسی اثر افزایش غلظت آنزیم بر میزان واکنش، بستر باید در مقدار اضافی وجود داشته باشد. به عنوان مثال، واکنش باید مستقل از غلظت بستر باشد.[۱۰۲]
هرگونه تغییر در مقدار محصول تشکیل شده طی یک دوره زمانی مشخص به سطح آنزیم موجود بستگی خواهد داشت.[۱۰۳]
گفته میشود این واکنشها «مرتبه صفر» هستند زیرا سرعتها از غلظت بستر مستقل نیستند و برابر با بعضی از ثابتهای k هستند.[۱۰۴]
شکلگیری محصول با سرعتی خطی با زمان پیش میرود. افزودن بستر بیشتر به افزایش نرخ کمک نمیکند.[۱۰۵]
در سینتیک مرتبه صفر، اجازه دادن به آزمایش برای مدت زمان دو برابر منجر به دو برابر مقدار محصول میشود.[۱۰۶]
مقدار آنزیم موجود در یک واکنش با فعالیتی که کاتالیز میکند اندازهگیری میشود. رابطه بین فعالیت و غلظت تحت تأثیر بسیاری از عوامل مانند دما، pH و غیره قرار دارد.[۱۰۷]
یک آزمایش آنزیم باید طوری طراحی شود که فعالیت مشاهده شده متناسب با مقدار آنزیم موجود باشد تا غلظت آنزیم تنها عامل محدود کننده باشد.[۱۰۸]
وقتی واکنش مرتبه صفر به صورت مطلوب است.[۱۰۹]
برای اندازهگیری ایدهآل فعالیت آنزیم، اندازهگیریها باید در آن قسمت از منحنی انجام شود که واکنش مرتبه صفر است.[۱۱۰]
یک واکنش به احتمال زیاد در ابتدا مرتب صفر است زیرا غلظت بستر در آن زمان بیشترین است.[۱۱۱]
برای اطمینان از اینکه یک واکنش مرتبه صفر است، باید چندین اندازهگیری غلظت محصول (یا بستر) انجام شود.[۱۱۲]
در شرایطی که غلظت بستر بسیار بیشتر از غلظت آنزیم باشد، واکنش ابتدا به صورت خطی (مرتبه صفر) پیش میرود تا زمانی که غلظت بستر به حدی کاهش یابد که دیگر در مقادیر اضافی نباشد.[۱۱۳]
این تغییر از سینتیک مرتبه صفر به سینتیک مرتبه اول (وابسته به غلظت بستر) به عنوان «نقطه انتقال» شناخته میشود و برای تعیین پارامترهای سینتیکی مانند Km و Vmax مفید است.[۱۱۴]
در مطالعات آنزیمی، استفاده از بازدارندهها میتواند به شناسایی مکانیسم کاتالیزوری آنزیم کمک کند. بازدارندههای رقابتی باعث افزایش ظاهری Km میشوند، در حالی که بازدارندههای غیررقابتی Vmax را کاهش میدهند.[۱۱۵]
تأثیر دما بر فعالیت آنزیم معمولاً با مدل آرنیوس توصیف میشود، اما در دمای بسیار بالا، دناتوراسیون آنزیم منجر به کاهش سریع فعالیت میشود.[۱۱۶]
بهطور مشابه، pH بهینه آنزیم نشاندهنده تعادل بین یونیزاسیون گروههای آمینواسیدی در جایگاه فعال و پایداری ساختاری آنزیم است.[۱۱۷]
برای آنزیمهای آلواستریک، سینتیک سیگموئیدی (غیر-مایکلیس-منتنی) مشاهده میشود، که نشاندهنده همکاری بین زیرواحدهای آنزیم است.[۱۱۸]
غلظت بستر
بهطور تجربی نشان داده شده است که اگر مقدار آنزیم ثابت نگه داشته شود و سپس غلظت بستر به تدریج افزایش یابد، سرعت واکنش افزایش مییابد تا زمانی که به حداکثر برسد. پس از این مرحله، افزایش غلظت بستر باعث افزایش سرعت (دلتا A / دلتا T) نمیشود. این نظریه وجود دارد که وقتی این حداکثر سرعت حاصل شد، آنزیم موجود به ES، کمپلکس بستر آنزیمی تبدیل شده است.
اثر دما
مانند اکثر واکنشهای شیمیایی، با افزایش دما سرعت واکنش کاتالیزور آنزیمی افزایش مییابد. ده درجه سانتیگراد افزایش دما فعالیت اکثر آنزیمها را ۵۰ تا ۱۰۰ درصد افزایش میدهد. تغییرات دمای واکنش به اندازه ۱ یا ۲ درجه ممکن است تغییرات ۱۰ تا ۲۰٪ را در نتایج ایجاد کند. در مورد واکنشهای آنزیمی، این واقعیت پیچیده است که بسیاری از آنزیمها تحت تأثیر دماهای بالا قرار دارند.
سرعت واکنش با افزایش دما به حداکثر افزایش مییابد، سپس با افزایش بیشتر دما بهطور ناگهانی کاهش مییابد. از آنجا که بیشتر آنزیمهای حیوانی در دمای بالاتر از ۴۰ درجه سانتیگراد به سرعت دناتوره میشوند، بیشترین تعیین آنزیمها تا حدودی زیر آن دما انجام میشود.
در طی یک دوره زمانی، آنزیمها حتی در دماهای متوسط غیرفعال میشوند. ذخیره آنزیمها در دمای ۵ درجه سانتیگراد یا کمتر معمولاً مناسبترین است. بعضی از آنزیمها در اثر انجماد فعالیت خود را از دست میدهند.
- نمودار اثر دما
اثر pH
مقادیر pH بسیار زیاد یا پایین بهطور کلی باعث از دست رفتن فعالیت اکثر آنزیمها میشود. pH همچنین عاملی در پایداری آنزیمها است. همانند فعالیت، برای هر آنزیم نیز منطقه ای از پایداری بهینه pH وجود دارد. همانطور که جدول نشان داده شده، مقدار مطلوب pH از یک آنزیم به آنزیم دیگر بسیار متفاوت خواهد بود
جدول زیر pH مناسب را برای آنزیمهای مختلف نشان میدهد.[۱۱۹]
اثر فعالسازها
Remove ads
کارکرد زیستی
خلاصه
دیدگاه
آنزیمها کاربردهای گستردهای در اندامهای زنده دارند. آنها برای ترارسانی پیام و تنظیم فعالیتهای سلول ضروری اند؛ از جمله مهمترین آنزیمها در تنظیم سلول میتوان به کیناز و فسفاتاز اشاره کرد.[۱۲۰] آنزیمها در ایجاد حرکت در ماهیچهها هم مؤثرند آنها با کمک میوزین و آبکافت ایتیپیایز در ماهیچهها کشش ایجاد میکنند. علاوه بر این آنزیمها در انتقال مواد در پیرامون سلول و جزئی از اسکلت سلولی اهمیت دارند.[۱۲۱] دیگر ایتیپیایزها در غشاء سلول، ناقلهای یونی اند که در فرایند انتقال فعال سلولی درگیرند. آنزیمها در جانوران کاربردهایی با نمود بیرونی هم دارند برای نمونه در فرایند ایجاد نور در کرمهای شبتاب آنزیمها نقش اساسی دارند.[۱۲۲] ویروسها هم ممکن است برای آلوده کردن سلول از آنزیم استفاده کنند مانند آنزیم اینتگراز و آنزیم رونوشتبردار معکوس در HIV یا مانند آنزیمهای نورآمینیداز در آنفلوانزا که در انتشار ویروس کاربرد دارند.[۱۲۳]
یکی از کاربردهای مهم آنزیمها در دستگاه گوارش حیوانات است. آنزیمهایی مانند آمیلاز و پروتئاز به ترتیب مولکولهای بزرگ مانند نشاسته و پروتئین را میشکنند تا برای بدن قابل جذب شوند. برای نمونه مولکول نشاسته برای جذب بسیار بزرگ است اما آنزیمها آن را به مولکولهای کوچکتری مانند مالتوز و بعد گلوکز میشکند و آن را قابل جذب میکند. هر آنزیمی برای شکستن مولکول خاصی کاربرد دارد برای نمونه پستانداران گیاهخوار که رژیم ویژهٔ گیاهخواری دارند از آنزیم سلولاز برای شکستن فیبر گیاهان استفاده میکنند.[۱۲۴]
سوختوساز

چندین آنزیم میتوانند با ترتیب خاصی با هم کار کنند و مسیرهای سوختوساز را بسازند.[۱۵]: 30.1 در یک مسیر سوختوساز، یک آنزیم، محصول آنزیمی دیگر را میگیرد و از آن به عنوان بستر استفاده میکند؛ پس از واکنش فروکافتی، محصول به دست آمده به آنزیمی دیگر سپرده میشود. گاهی بیش از یک آنزیم در فروکافت یک واکنش نقش دارند و با هم به صورت موازی اثر میگذارند؛ البته در این حالت تنظیمات پیچیده تری در واکنش وارد میشود.[۱۲۵]
آنزیمها تصمیم میگیرند در جریان مسیرهای سوختوساز هر بار چه گامی باید برداشته شود بدون آنزیمها سوختوساز با همین ترتیبی که صورت میگیرد هرگز پیش نخواهد رفت و نمیتواند نیازهای سلول را برطرف کند. بیشتر مسیرهای سوختوساز مرکزی، چند گام کلیدی دارند که معمولاً توسط آنزیمهایی انجام میشود که فعالیت شان، هیدرولیزِ آدنوزین تریفسفات را دربر میگیرد. چون این واکنش انرژی بسیار زیادی ایجاد میکند و واکنشهای دیگری که برای انجام به انرژی نیاز دارند با این انرژی به دست آمده از هیدرولیز، جفت میشوند به این ترتیب زنجیره ای از واکنشهای سوخت و سازی مرتبط با هم، در بدن صورت میگیرد.[۱۵]: 30.1
کنترل فعالیت
پنج روش اصلی وجود دارد که فعالیت آنزیم در سلول کنترل میشود.[۱۵]: 30.1.1
تنظیم
آنزیمها میتوانند توسط مولکولهای دیگر فعال یا مهار شوند. به عنوان مثال، محصول (های) نهایی یک مسیر متابولیکی اغلب مهارکننده یکی از اولین آنزیمهای مسیر (معمولاً اولین مرحله برگشتناپذیر به نام مرحله متعهد) است، بنابراین مقدار محصول نهایی ساخته شده توسط مسیرها را تنظیم میکند. چنین مکانیزم نظارتی مکانیزم بازخورد منفی نامیده میشود، زیرا مقدار محصول نهایی تولید شده توسط غلظت خود تنظیم میشود.[۱۲۶]: 141–48 مکانیسم بازخورد منفی میتواند بهطور مؤثری میزان سنتز متابولیتهای میانی را با توجه به نیاز سلولها تنظیم کند. این امر به تخصیص مؤثر مواد و صرفه جویی در انرژی کمک میکند و از تولید بیش از حد محصولات نهایی جلوگیری میکند. مانند سایر دستگاههای هموستاتیک ، کنترل عملکرد آنزیمی به حفظ یک محیط داخلی پایدار در موجودات زنده کمک میکند.[۱۲۶]: 141
پیرایش پساترجمهای
نمونههایی از پیرایش پساترجمهای شامل فسفوریلاسیون، میریستویلاسیون (Myristoylation) و گلیکوزیلاسیون است.[۱۲۶]: 149–69 به عنوان مثال، در پاسخ به انسولین، فسفوریلاسیون آنزیمهای متعدد، از جمله گلیکوژن سنتاز (Glycogen synthase)، به کنترل سنتز یا تخریب گلیکوژن کمک میکند و به سلول اجازه میدهد تا به تغییرات قند خون پاسخ دهد.[۱۲۷] نمونه دیگری ازپیرایش پساترجمهای، تجزیه زنجیره پلی پپتیدی است. کیموتریپسین، یک پروتئاز گوارشی، به صورت غیرفعال به عنوان کیموتریپسینوژن (Chymotrypsinogen) در پانکراس تولید میشود و به این شکل به معده، جایی که فعال میشود ، منتقل میشود که باعث میشود آنزیم قبل از ورود به روده لوزالمعده یا سایر بافتها را هضم کند. این نوع پیش ساز غیرفعال یک آنزیم به عنوان زیموژن[۱۲۶]: 149–53 یا پروآنزیم شناخته میشود.
تعداد
تولید آنزیم (رونویسی و ترجمه ژنهای آنزیم) میتواند توسط یک سلول در پاسخ به تغییرات محیط سلول افزایش یا کاهش یابد. به این شکل از تنظیم ژن، القاکننده آنزیم گفته میشود. به عنوان مثال، ممکن است باکتریها در برابر آنتیبیوتیکهایی مانند پنی سیلین مقاوم شوند زیرا آنزیمهایی به نام بتا لاکتامازها القا میشوند که حلقه مهم بتا-لاکتام را در مولکول پنی سیلین هیدرولیز میکنند.[۱۲۸] مثال دیگر از آنزیمهای موجود در کبد به نام سیتوکروم پی ۴۵۰ اکسیداز است که در متابولیسم دارو (en:Drug metabolism) مهم هستند. القا یا مهار این آنزیمها میتواند باعث تداخل دارویی شود. سطح آنزیم همچنین میتواند با تغییر در میزان تخریب آنزیم تنظیم شود.[۱۵]: 30.1.1 نقطه مقابل القای آنزیم، سرکوب آنزیم (Enzyme repressor) است.
توزیع زیریاختهای
آنزیمها را میتوان به صورت مسیرهای متابولیکی مختلف در محفظههای مختلف سلولی (en:Cellular compartment) وجود دارد تقسیمبندی کرد. به عنوان مثال، اسیدهای چرب توسط یک مجموعه آنزیم در سیتوزول، شبکه آندوپلاسمی و گلژی سنتز میشوند و توسط مجموعه دیگری از آنزیمها به عنوان منبع انرژی در میتوکندری، از طریق اکسیداسیون β استفاده میشوند.[۱۲۹] علاوه بر این ، انتقال (en:Protein targeting) آنزیم به بخشهای مختلف ممکن است درجه پروتوندهی (به عنوان مثال، سیتوپلاسم خنثی و لیزوزوم اسیدی) یا حالت اکسیداتیو (به عنوان مثال، اکسید کننده پریپلاسم یا کاهش سیتوپلاسم) را تغییر دهد که به نوبه خود بر فعالیت آنزیم تأثیر میگذارد. در مقابل تقسیم به اندامکهای متصل به غشا، محلی سازی آنزیم درون سلولی نیز ممکن است از طریق پلیمریزاسیون آنزیمها در رشتههای سیتوپلاسمی ماکرومولکولی تغییر کند.[۱۳۰][۱۳۱]
عضو ویژه
در یوکاریوتهای چند سلولی، سلولها در اندامها و بافتهای مختلف الگوهای مختلف بیان ژن را دارند و بنابراین مجموعههای مختلفی از آنزیمها (معروف به ایزوزیمها) را برای واکنشهای متابولیکی در دسترس دارند که مکانیزمی را برای تنظیم متابولیسم کلی ارگانیسم فراهم میکند. به عنوان مثال، هگزوکیناز، اولین آنزیم در مسیر گلیکولیز، دارای فرم خاصی به نام گلوکوکیناز است که در کبد و پانکراس بیان میشود و میل کمتری به گلوکز دارد اما نسبت به غلظت گلوکز حساسیت بیشتری دارد.[۱۳۲] این آنزیم در حس کردن قند خون و تنظیم تولید انسولین نقش دارد.[۱۳۳]
دخالت در بیماری

از آنجا که کنترل دقیق فعالیت آنزیم برای همایستایی ضروری است، هرگونه سو عملکرد (جهش، تولید بیش از حد، تولید کم یا حذف) آنزیم حیاتی منفرد میتواند منجر به یک اختلال ژنتیکی شود. بدعمل کردن فقط یک نوع آنزیم از هزاران نوع موجود در بدن انسان میتواند کشنده باشد. مثالی از یک بیماری ژنتیکی کشنده به دلیل کمبود آنزیم، بیماری تی-سکس است که در آن بیماران فاقد آنزیم هگزوزامینیداز (Hexosaminidase) هستند.[۱۳۴][۱۳۵]
یکی از نمونههای کمبود آنزیم رایجترین نوع فنیل کتونوری است. بسیاری از جهشهای مختلف اسید آمینه در آنزیم فنیل آلانین هیدروکسیلاز، که در اولین مرحله تخریب فنیلآلانین را کاتالیز میکند، منجر به تجمع فنیل آلانین و محصولات مرتبط میشود. برخی از جهشها در محل فعال قرار دارند و بهطور مستقیم اتصال و کاتالیز را مختل میکنند، اما بسیاری از آنها از محل فعال دور هستند و با بیثبات سازی ساختار پروتئین یا تأثیر بر اولیومریاسیون صحیح، فعالیت را کاهش میدهند.[۱۳۶][۱۳۷] در صورت عدم درمان این بیماری، میتواند منجر بهکمتوانی ذهنی شود. مثال دیگر کمبود سودوکولین استراز (Pseudocholinesterase deficiency) است که در آن توانایی بدن در تجزیه داروهای کولین استر مختل میشود.[۱۳۸] از تجویز خوراکی آنزیمها میتوان برای درمان برخی از کمبودهای آنزیم عملکردی مانند نارسایی لوزالمعده (Pancreatic insufficiency)[۱۳۹] و عدم تحمل لاکتوز استفاده کرد.[۱۴۰]
همچنین کارکرد نادرست آنزیم میتواند باعث بیماری، ناشی از جهشهای ژرمینال (Germline mutation) در ژنهای کد کننده آنزیمهای ترمیم کننده DNA است شوند. نقص در این آنزیمها باعث سرطان میشود زیرا سلولها کمتر قادر به اصلاح جهش در ژنوم خود هستند. این امر باعث تجمع آهسته جهشها و در نتیجه ایجاد سرطان میشود. نمونه ای از این سندرم سرطان ارثی گزرودرما پیگمنتوزوم است که باعث ایجاد سرطان پوست در پاسخ به حداقل قرار گرفتن در معرض نور فرابنفش میشود.[۱۴۱]
Remove ads
فرگشت
خلاصه
دیدگاه
مشابه پروتئینهای دیگر، آنزیمها با گذشت زمان از طریق جهشها و واگرایی توالی تغییر میکنند. با توجه به نقش اصلی آنها در متابولیسم ، تکامل آنزیم نقش اساسی در سازگاری دارد؛ بنابراین پرسشی اساسی مطرح است که چگونه آنزیمها میتوانند فعالیت آنزیمی خود را در کنار هم تغییر دهند. بهطور کلی پذیرفته شده است که بسیاری از فعالیتهای جدید آنزیم از طریق تکثیر ژن و جهش نسخههای تکراری تکامل یافتهاند اگرچه تکامل نیز میتواند بدون تکثیر انجام شود. یک نمونه از آنزیمی که فعالیت خود را تغییر داده است اجداد متیونیل آمینوپپتیداز (MAP) و کراتین آمیدوهیدرولاز (کراتینیناز) است که به وضوح همولوگ هستند اما واکنشهای بسیار متفاوت را کاتالیز میکنند (MAP موجب حذف متیونین آمینو ترمینال در پروتئینهای جدید میشود، در حالی که کراتین را به سمت سارکوزین و اوره هیدرولیز میکند). افزون بر این، MAP وابسته به یون فلزی است در حالی که کراتیناز نیست، از این رو این ویژگی نیز با گذشت زمان از بین رفته است.[۱۴۲] تغییرات کوچک فعالیت آنزیمی در بین آنزیمها بسیار متداول است. بهطور خاص، ویژگی اتصال سوبسترا به راحتی و به سرعت با تغییر اسیدهای آمینه تک در پاکتهای اتصال دهنده سوبسترا خود تغییر میکند که اغلب در کلاسهای اصلی آنزیم مانند کینازها مشاهده میشود.[۱۴۳]
امروزه تکامل مصنوعی (in vitro) برای اصلاح فعالیت آنزیم یا ویژگی کاربردهای صنعتی مورد استفاده قرار میگیرد.
کاربردهای صنعتی
خلاصه
دیدگاه
در صورت نیاز به کاتالیزورهای بسیار خاص، آنزیمها در صنایع شیمیایی و سایر کاربردهای صنعتی مورد استفاده قرار میگیرند. بهطور کلی آنزیمها در تعداد واکنشی که برای کاتالیز کردن و همچنین عدم ثبات آنها در حلالهای آلی و در دماهای بالا وجود دارد، محدود هستند. به عنوان یک نتیجه، مهندسی پروتئین یک زمینه فعال از تحقیقات است و شامل تلاش برای ایجاد آنزیمهای جدید با خواص جدید، چه از طریق طراحی منطقی و چه از طریق تکامل هدایت شده یا آزمایشگاهی است.[۱۴۴] این تلاشها با موفقیت شروع شده است و اکنون چند آنزیم برای کاتالیز واکنشهایی که در طبیعت وجود ندارد، طراحی شده است.[۱۴۵]
آنزیمهای بی حرکت در تولید مواد غذایی و کالاهای مختلف از جمله تولید طعم دهندهها، شربتها، قنادیها، صنایع لبنی، نوشیدنیهای الکلی و میوه ای، مخمرهای آشپزی و هیدرولیزهای لاکتوز آب پنیر نقش سودمندی و گستردهای در صنایع غذایی دارند. کاربرد آنزیمهای بی حرکت در صنایع لبنی بسیار مهم است.[۱۴۶] بسیاری برخی افراد از عدم تحمل لاکتوز رنج میبرند و نمیتوانند شیر را مصرف کنند. این مشکل را میتوان با استفاده از لاکتاز بی حرکت، که هیدرولیز لاکتوز را کاتالیز میکند، برای تولید شیر بدون لاکتوز حل کرد. آنزیمهای بی حرکت نیز برای شفاف سازی آب میوه و رفع تلخی از آب مرکبات استفاده میشود.[۱۴۶][۱۴۷] یکی دیگر از کاربردهای اصلی آنزیمهای بی حرکت، استفاده از آنها به عنوان حسگرهای زیستی برای تعیین محتوای اجزای مختلف و کنترل کیفیت محصولات است.[۱۴۸] از آنزیمهای بی حرکت در بستهبندی مواد غذایی نیز استفاده میشود، که کاربردی چشمگیر برای افزایش ماندگاری و بهبود کیفیت غذای بستهبندی شده است.[۱۴۹]
کاربرد آنها همچنین شامل تولید بیودیزل، سلولهای سوخت زیستی، پلی استر، مواد کاهش دهنده ریز آلایندهها و اسیدهای آمینه است.[۱۵۰][۱۵۱] چند نمونه از آنزیمهای بی حرکت در این بررسی گزارش شده است.
مهندسی آنزیم
مهندسی آنزیم یا مهندسی پروتئین فرایند طراحی پروتئینها یا آنزیمها با تغییر توالی اسیدهای آمینه از طریق جهش DNA نوترکیب است. انقلاب مستقیم و طراحی منطقی دو تکنیک مورد استفاده در مهندسی آنزیم یا طراحی پروتئین در روند کشف دارو هستند.
آنزیمها پروتئین هستند، مهندسی آنزیم بخشی از فعالیت بزرگ مهندسی پروتئین است. مهندسی آنزیم با استفاده از فناوری DNA نوترکیب تغییرات دلخواه را در توالی اسیدهای آمینه آنزیمها معرفی میکند.
آنزیم مصنوعی (زیمواره)
آنزیم مصنوعی یک مولکول آلی مصنوعی یا آلی است که برخی از عملکردهای آنزیم را بازآفرینی میکند. نانوزیمها نانومواد با ویژگیهای آنزیمی مانند ذاتی هستند که طی دهه گذشته به دلیل توانایی در رفع محدودیتهای آنزیمهای طبیعی از جمله پایداری کم، هزینه زیاد و ذخیرهسازی دشوار، در حال رشد بودهاند.[۱۶۹][۱۷۰] آنها بهطور گستردهای برای کاربردهای مختلف، از جمله سنجش زیستی، تصویربرداری از بدن، تشخیص تومور و درمان، ضدعفونی کردن مورد کاوش قرار گرفتهاند.[۱۷۱][۱۷۲][۱۷۳][۱۷۴][۱۷۵] فعالیت کاتالیستی این نانوآنزیم ۷۰ برابر بیشتر از کاتالیست Pt/C است.[۱۷۶] آنها بهطور خاص میتوانند بسترهای آنزیمهای طبیعی را تحت شرایط فیزیولوژیکی با مکانیسم و سینتیک کاتالیزوری مشابه کاتالیز کنند. در مقایسه با آنزیمهای طبیعی، نانوزیمها مزایای منحصر به فردی از جمله فعالیت کاتالیزوری بالا، هزینه کم، ثبات بالا، تولید آسان انبوه و فعالیت قابل تنظیم را نشان میدهند. علاوه بر این، نانوزیمها به عنوان نوع جدیدی از آنزیمهای مصنوعی، نه تنها دارای فعالیت کاتالیزوری شبیه آنزیم هستند، بلکه ویژگیهای فیزیکوشیمیایی منحصر به فرد نانومواد مانند خواص نوری، حرارتی فوقالعاده و فلورسانس را نیز نشان میدهند.[۱۷۷]
در کنار توسعه سریع و درک روزافزون علم نانو و فناوری نانو، پیشبینی میشود که آنها جایگزین مستقیم آنزیمهای سنتی شوند. در سال ۲۰۰۷، اولین شواهد مبنی بر اینکه نانوذرات Fe3O4 (NP) دارای فعالیت ذاتی تقلید کننده پراکسیداز هستند گزارش شد. تاکنون صدها نانومواد که فعالیت کاتالیزوری پراکسیداز، اکسیداز، کاتالاز، هالوپراکسیداز، گلوتاتیون پراکسیداز، اوریکاز را تقلید میکنند، پیدا شده است. طیف وسیعی از نانومواد که بهطور همزمان فعالیت شبیهسازی دو یا چند آنزیمی را نشان میدهند نیز گزارش شده است. برای نمونهل، نانوذرات Fe3O4 با توجه به pH مجل واکنش فعالیتهای شبه پراکسیداز و کاتالاز از خود نشان میدهند و نانوذرات آبی پروس (Prussian blue NPs) بهطور همزمان دارای فعالیت شبه پراکسیداز، کاتالاز و سوپراکسید دیسموتاز هستند. با ظهور مفهوم جدید «نانوزیمولوژی» (nanozymology)، نانوزیمها اکنون به یک زمینه جدید در حال ظهور تبدیل شدهاند که فناوری نانو و زیستشناسی را به هم متصل میکند.[۱۷۸]
آنزیمشناسی مولکولی و هدفهای دارویی
نگارخانه
- چاقی میتواند ناشی از عملکرد نامناسب آنزیمها باشد
- زنجیرههای نشاسته توسط آلفا آمیلاز به قندهای کوتاه تری تجزیه میشوند
- فرایند مالتسازی اغلب برای تولید الکل صورت میگیرد و دلیل آن تبدیل کردن نشاسته به قند ساده میباشد تا برای مخمر قابل استفاده گردد
- از لیپاز در تولید پنیر روکفور برای سرعت اماده سازی آنها استفاده میشود.
- کوآنزیم NADH متصل به سیتوکروم B5 ردوکتاز
- ایده مدل «پیوست سه نقطه ای». اتمها یا گروههای اتمها در مولکول بستر (S) ، با اتصال به مکانهای مکمل روی مولکول آنزیم (E) (به عنوان مکانهای صفحه نشان داده میشوند) ، فقط یک اتصال ممکن دارند. واکنش میتواند به اتمهای متصل در a و b محدود شود ، حتی اگر اتمها (یا گروههای اتمها) ۱ و ۴ یکسان باشند.
- مدل سایت فعال آنیدراز کربنیک. سه بقایای هیستیدین (آبی) و یک گروه هیدروکسیل هماهنگ کننده یون روی ، که یک عامل مشترک این آنزیم است ، قابل مشاهده است
- مسیرهای اصلی متابولیک داخل سلولی
- RuBisCO از اکتامرهای هترودیمر زیر سیستمهای بزرگ و کوچک تشکیل شده است (برای هر زیر سیستم کدگذاری رنگی شده است
- آنزیم ۶-فسفوفروکتوکیناز ، که دارای سایتهای مدولاسیون آلوستریک است
- منحنی اشباع یک واکنش آنزیمی که رابطه بین غلظت بستر و سرعت واکنش را نشان میدهد
- هذلولی اشباع
جستارهای وابسته
- فهرست آنزیمها
- آنزیمهای صنعتی
- بانکهای اطلاعاتی آنزیم
- BRENDA
- EXPASy
- IntEnz
- دانش نامه ژن و ژنوم کیوتو
- MetaCyc
واژهنامه
منابع
خواندن بیشتر
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads


![{\displaystyle {\mathrm {CO} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}\mathrel {\xrightarrow {\text{Carbonic anhydrase}} } {}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {CO} {\vphantom {A}}_{\smash[{t}]{3}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/cb4c8837b26e96fe552c17d863f93e0618cd998b)
![{\displaystyle {\mathrm {CO} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}\mathrel {\xleftarrow {\text{Carbonic anhydrase}} } {}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {CO} {\vphantom {A}}_{\smash[{t}]{3}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/618e95485aa1c3c44a29c557ac448ae5b544ff07)