بالاترین سوالات
زمانبندی
چت
دیدگاه
روی
از ویکیپدیا، دانشنامه آزاد
Remove ads
روی یک عنصر شیمیایی با نماد شیمیایی Zn و عدد اتمی ۳۰ است. این عنصر در دمای اتاق اندکی شکننده است و در صورت حذف اکسیداسیون، ظاهری براق و خاکستری متمایل به نقرهای دارد. روی نخستین عنصر در گروه ۱۲ جدول تناوبی است. از برخی جهات، روی از نظر شیمیایی به منیزیم شباهت دارد؛ هر دو عنصر تنها یک عدد اکسایش معمول (+۲) دارند و یونهای Zn2+ و Mg2+ دارای اندازهای مشابه هستند.[الف] روی بیست و چهارمین عنصر فراوان در پوسته زمین است و پنج ایزوتوپ پایدار دارد. رایجترین کانسنگ روی، اسفالریت (بلاند روی) است که یک سولفید روی معدنی محسوب میشود. بزرگترین معدنهای قابل بهرهبرداری آن در استرالیا، آسیا و ایالات متحده قرار دارند. فرایند پالایش روی شامل شناورسازی کف، تشویه، و متالورژی استخراجی نهایی با استفاده از الکتریسیته (الکترو وینینگ) است.
روی یک عنصر کممقدار ضروری برای انسانها،[۲][۳][۴] حیوانات،[۵] گیاهان،[۶] و میکروبها[۷] است و برای رشد پیش از تولد و پس از تولد لازم است.[۸] پس از آهن، روی دومین فلز کممقدار فراوان در بدن انسان است و تنها فلزی است که در تمام آنزیمها حضور دارد.[۶][۴] روی همچنین یک عنصر غذایی ضروری برای رشد مرجانها است، زیرا به عنوان یک کوفاکتور مهم برای بسیاری از آنزیمها عمل میکند.[۹]
کمبود روی حدود دو میلیارد نفر را در کشورهای در حال توسعه تحت تأثیر قرار داده و با بسیاری از بیماریها مرتبط است.[۱۰] در کودکان، کمبود روی باعث تأخیر در رشد، بلوغ دیررس، افزایش حساسیت به عفونت و اسهال میشود.[۸] آنزیمهایی که یک اتم روی در مرکز واکنشپذیر خود دارند، مانند الکل دهیدروژناز در انسان در بیوشیمی گستردهاند.[۱۱] مصرف بیش از حد روی میتواند موجب آتاکسی، لتارژی و کمبود مس شود. در زیستبومهای دریایی، بهویژه در مناطق قطبی، کمبود روی میتواند موجب کاهش حیات جوامع اولیه جلبکی شود و در نتیجه، ساختارهای تغذیهای پیچیده دریایی را بیثبات کرده و بر تنوع زیستی اثر بگذارد.[۱۲]
برنج, یک آلیاژ از مس و روی در نسبتهای مختلف، از اوایل هزاره سوم پیش از میلاد در منطقه دریای اژه و نواحی که امروزه شامل عراق، امارات متحده عربی، قالمیقستان، ترکمنستان و گرجستان میشود، مورد استفاده قرار گرفته است. در هزاره دوم پیش از میلاد، این آلیاژ در مناطقی که امروزه شامل غرب هند، ازبکستان، ایران، سوریه، عراق و اسرائیل است، کاربرد داشته است.[۱۳][۱۴][۱۵] تولید فلز روی در مقیاس وسیع تا قرن دوازدهم در هند صورت نگرفت، هرچند که این فلز برای رومیان و یونانیان باستان شناخته شده بود.[۱۶] معادن راجستان شواهدی قطعی از تولید روی را از قرن ششم پیش از میلاد ارائه دادهاند.[۱۷] قدیمیترین شواهد از وجود روی خالص از منطقه زاوار در راجستان به اوایل قرن نهم میلادی بازمیگردد، زمانی که فرایند تقطیر برای تولید روی خالص مورد استفاده قرار گرفت.[۱۸]
کیمیاگران روی را در هوا میسوزاندند تا آنچه را که «روی اکسید» یا «برف سفید» مینامیدند، تولید کنند. این عنصر احتمالاً توسط کیمیاگر پاراسلسوس با اقتباس از واژه آلمانی Zinke (به معنی دندانه یا شاخه) نامگذاری شده است. شیمیدان آلمانی آندرئاس زیگیسموند مارگراف در سال ۱۷۴۶ به کشف روی خالص نسبت داده میشود. پژوهشهای لوییجی گالوانی و آلساندرو ولتا در سال ۱۸۰۰ ویژگیهای الکتروشیمیایی روی را آشکار کردند. گالوانیزهکردن آهن (گالوانیزه گرم) برای مقاومت در برابر خوردگی، مهمترین کاربرد روی محسوب میشود. سایر کاربردها شامل استفاده در باتری روی–کربن، ریختهگری قطعات کوچک غیرسازهای و آلیاژهایی مانند برنج است. ترکیبات مختلف روی نیز از جمله کربنات روی و گلوکونات روی (به عنوان مکملهای غذایی)، کلرید روی (در دئودورانتها)، پیریتیون روی (در شامپو ضدشوره)، سولفید روی (در رنگهای شبتاب) و دیمتیل روی یا دیاتیلروی در آزمایشگاههای شیمی بهطور گستردهای مورد استفاده قرار میگیرند.
Remove ads
ویژگیها
خلاصه
دیدگاه
خواص فیزیکی
روی فلزی براق با تهرنگ مایل به آبی و دارای خاصیت دیامغناطیس است،[۱۹] اگرچه بیشتر انواع تجاری این فلز سطحی کدر دارند.[۲۰] چگالی آن کمی کمتر از آهن است و دارای ساختار بلوری ششوجهی تحریفشدهای از نوع شبکه کریستالی هگزاگونال فشرده است که در آن هر اتم دارای شش همسایه نزدیک (با فاصله ۲۶۵٫۹ پیکومتر) در یک صفحه و شش همسایه دیگر در فاصلهای بیشتر (۲۹۰٫۶ پیکومتر) است.[۲۱]
این فلز در بیشتر دماها سخت و شکننده است اما بین ۱۰۰ تا ۱۵۰ درجه سلسیوس نرم و چکشخوار میشود.[۱۹][۲۰] بالاتر از ۲۱۰ درجه سلسیوس، مجدداً شکننده شده و در اثر ضربه پودر میشود.[۲۲] روی رسانایی الکتریکی متوسطی دارد.[۱۹]
نقطه ذوب روی ۴۱۹٫۵ درجه سلسیوس و نقطه جوش آن ۹۰۷ درجه سلسیوس است.[۲۳] این فلز کمترین نقطه ذوب را در میان فلزات بلوک جدول تناوبی، به جز جیوه و کادمیم، دارد. به همین دلیل، روی، کادمیم و جیوه معمولاً مانند سایر فلزات واسطه در بلوک d در نظر گرفته نمیشوند.[۲۳]
بسیاری از آلیاژها از جمله برنج حاوی روی هستند. دیگر فلزاتی که مدتهاست آلیاژهای دوتایی با روی تشکیل دادهاند عبارتاند از: آلومینیم، آنتیموان، بیسموت، طلا، آهن، سرب، جیوه، نقره، قلع، منیزیم، کبالت، نیکل، تلوریم و سدیم.[۲۴]
هرچند نه روی و نه زیرکونیم خاصیت فرومغناطیس ندارند، اما آلیاژ آنها، ZrZn
2، در دماهای پایینتر از ۳۵ کلوین رفتار فرومغناطیسی از خود نشان میدهد.[۱۹]
پیدایش
روی تقریباً ۷۵ بخش (۰٫۰۰۷۵٪) از پوسته را تشکیل میدهد و از این نظر، بیستوچهارمین عنصر فراوان در پوسته زمین است.[۲۵] همچنین غلظت آن در منظومه شمسی به ۳۱۲ بخش در میلیون (ppm) میرسد و از این لحاظ، بیستودومین عنصر فراوان در منظومه شمسی است.[۲۶] مقدار معمول غلظت زمینهای روی در محیط بهطور معمول از ۱ میکروگرم بر متر مکعب در جو، ۳۰۰ میلیگرم بر کیلوگرم در خاک، ۱۰۰ میلیگرم بر کیلوگرم در گیاهان، ۲۰ میکروگرم بر لیتر در آب شیرین و ۵ میکروگرم بر لیتر در آب دریا تجاوز نمیکند.[۲۷] این عنصر معمولاً در ارتباط با سایر فلزات پایه مانند مس و سرب در کانسنگها یافت میشود.[۲۸]
روی یک عنصر گلداشمیت محسوب میشود، به این معنی که بیشتر در ترکیب با گوگرد و دیگر کالکوژنهای سنگین یافت میشود تا با کالکوژن سبکتری مانند اکسیژن یا عناصر الکترونگاتیوتر غیر کالکوژن مانند هالوژنها. سولفیدها هنگام سرد شدن پوسته زمین در شرایط اکسایش-کاهش جو اولیه زمین تشکیل شدند.[۲۹]اسفالریت، که گونهای از روی سولفید است، مهمترین کانسنگ استخراجی روی بهشمار میآید، زیرا کنسانتره آن حاوی ۶۰ تا ۶۲ درصد روی است.[۲۸]
دیگر کانیهای حاوی روی شامل اسمیت زونیت (کربنات روی)، همی مورفیت (سیلیکات روی)، وورتزیت (نوعی دیگر از سولفید روی) و گاهی هیدروزنسیت (کربنات روی بازی) هستند.[۳۰] بهجز وورتزیت، سایر این کانیها در نتیجه هوازدگی سولفیدهای روی اولیه تشکیل شدهاند.[۲۹]
کل منابع شناساییشده روی در جهان حدود ۱٫۹ تا ۲٫۸ میلیارد تن برآورد شده است.[۳۱][۳۲] ذخایر بزرگی از این عنصر در استرالیا، کانادا و ایالات متحده وجود دارد، اما بیشترین ذخایر آن در ایران قرار دارد.[۲۹][۳۳][۳۴]
آخرین برآورد از ذخایر پایه روی، ذخایری که معیارهای فیزیکی مشخصی را برای استخراج و تولید دارا هستند در سال ۲۰۰۹ انجام شد و مقدار آن حدود ۴۸۰ میلیون تن محاسبه شد.[۳۵] ذخایر روی بهعنوان کانسارهایی شناخته میشوند که از نظر اقتصادی برای استخراج مناسباند و عواملی مانند موقعیت، عیار، کیفیت و مقدار در زمان ارزیابی ذخایر در نظر گرفته میشوند. از آنجا که اکتشاف و توسعه معادن یک فرایند مداوم است، مقدار ذخایر روی عدد ثابتی نیست و پایداری تأمین این فلز را نمیتوان صرفاً بر اساس عمر معادن موجود تخمین زد. این مفهوم با دادههای سازمان زمینشناسی ایالات متحده آمریکا (USGS) تأیید میشود که نشان میدهد علیرغم افزایش ۸۰ درصدی تولید روی تصفیهشده بین سالهای ۱۹۹۰ تا ۲۰۱۰، مدتزمان بقای ذخایر روی تغییری نکرده است. در مجموع، تا سال ۲۰۰۲ حدود ۳۴۶ میلیون تن روی استخراج شده و پژوهشگران تخمین میزنند که بین ۱۰۹ تا ۳۰۵ میلیون تن از این فلز در حال استفاده است.[۳۶][۳۷][۳۸]

ایزوتوپها
پنج ایزوتوپ پایدار از روی در طبیعت یافت میشود که در میان آنها، 64Zn با فراوانی ۴۹٫۱۷٪، رایجترین ایزوتوپ است.[۳۹][۴۰] سایر ایزوتوپهای پایدار موجود در طبیعت شامل 66
Zn (۲۷٫۷۳٪)، 67
Zn (۴٫۰۴٪)، 68
Zn (۱۸٫۴۵٪) و 70
Zn (۰٫۶۱٪) هستند.[۴۰]
چندین ایزوتوپ پرتوزا از روی نیز شناسایی شدهاند. پایدارترین ایزوتوپ پرتوزای روی، 65
Zn است که نیمهعمری برابر با ۲۴۳٫۶۶ روز دارد. پس از آن، 72
Zn با نیمهعمر ۴۶٫۵ ساعت قرار دارد.[۳۹] همچنین، روی دارای ۱۰ ایزومر هستهای است که در میان آنها، 69mZn با نیمهعمر ۱۳٫۷۶ ساعت، پایدارترین ایزومر هستهای محسوب میشود.[۳۹] در این نامگذاری، شاخص «m» نشاندهندهٔ شبهپایداری این ایزوتوپ است. هستهٔ یک ایزوتوپ شبهپایدار در حالت برانگیخته قرار دارد و با انتشار یک فوتون به شکل پرتو گاما به حالت پایه بازمیگردد. ایزوتوپ 61
Zn دارای سه حالت شبهپایدار است، درحالیکه 73
Zn دارای دو حالت شبهپایدار است.[۴۱] ایزوتوپهای 65
Zn, 71
Zn, 77
Zn و 78
Zn هر یک تنها یک حالت شبهپایدار دارند.[۳۹]
رایجترین واپاشی پرتوزا در ایزوتوپهای پرتوزای روی با عدد جرمی کمتر از ۶۶، گیراندازی الکترون است. در این فرایند، محصول واپاشی یک ایزوتوپ از عنصر مس خواهد بود:[۳۹]
رایجترین نوع واپاشی در ایزوتوپهای پرتوزای روی با عدد جرمی بیشتر از ۶۶، واپاشی بتا (β−) است که منجر به تولید یک ایزوتوپ از گالیم میشود:[۳۹]
- n
30Zn → n
31Ga + e−
+ ν
e
Remove ads
ترکیبات و شیمی
خلاصه
دیدگاه
واکنشپذیری
روی دارای آرایش الکترونی [Ar]4s23d10 است و در گروه ۱۲ جدول تناوبی جدول تناوبی قرار دارد. این عنصر یک فلز با واکنشپذیری متوسط و یک عامل کاهنده قوی است؛[۴۲] در سری واکنشپذیری، واکنشپذیری آن با منگنز قابل مقایسه است.[۴۳] سطح فلز خالص روی بهسرعت دچار تیرگی شده و در نهایت با واکنش با کربن دیاکسید موجود در هوا، یک لایه محافظ غیرفعالسازی از هیدروزنسیت پایه، Zn
5(OH)
6(CO3)
2، تشکیل میدهد.[۴۴]
روی در هوا با شعلهای درخشان به رنگ سبز مایل به آبی میسوزد و دودهای روی اکسید منتشر میکند.[۴۵] این عنصر بهراحتی با اسیدها، قلیاها و سایر نافلزات واکنش میدهد.[۴۶] روی بسیار خالص در دمای اتاق فقط بهآرامی با اسیدها واکنش نشان میدهد.[۴۵] اما اسیدهای قوی مانند هیدروکلریک اسید یا سولفوریک اسید میتوانند لایهٔ غیرفعال را از بین ببرند و در نتیجه واکنش با اسید، هیدروژن آزاد میشود.[۴۵]
شیمی روی شباهتهایی با فلزات انتهایی ردیف اول عناصر واسطه، از جمله نیکل و مس، دارد[۴۷] و همچنین با برخی از عناصر گروه اصلی نیز مشابه است. تقریباً تمام ترکیبات روی دارای عدد اکسایش +۲ هستند.[۴۸] در این ترکیبات، الکترونهای لایهٔ s بیرونی از دست میروند و یک یون روی با پیکربندی الکترونی [Ar]3d10 باقی میماند.[۴۹] این لایهٔ d داخلی که کاملاً پر است، معمولاً در پیوندهای شیمیایی شرکت نمیکند و این موضوع باعث میشود ترکیبات روی دیامغناطیس و اغلب بیرنگ باشند.[۴۷] در محلولهای آبی، کمپلکس هشتوجهی [Zn(H
2O)6]2+
گونهٔ غالب است.[۵۰]
شعاع یونی روی و منیزیم تقریباً یکسان است؛ بنابراین برخی از نمکهای معادل دارای همان ساختار بلوری هستند،[۵۱] و در شرایط دیگر که شعاع یونی یک عامل تعیینکننده است، شیمی روی شباهت زیادی به شیمی منیزیم دارد.[۴۵] در مقایسه با فلزات واسطه، روی تمایل دارد پیوندهایی با درجه بالاتر از پیوند کووالانسی ایجاد کند. کمپلکسهای شیمیایی با نیتروژن و گوگرد پایداری بیشتری دارند.[۴۷] کمپلکسهای روی عمدتاً ۴- یا ۶- پیوند داتیو دارند، اگرچه کمپلکسهای ۵-وجهی نیز شناخته شدهاند.[۴۵]
سایر حالتهای اکسایش تنها در شرایط فیزیکی غیرعادی امکانپذیرند و تنها حالات اکسایش مثبت اثباتشده برای روی +۱ و +۲ هستند.[۴۸] رانش آفتکش ترکیب روی با روی کلرید در دماهای بالاتر از ۲۸۵ °C نشاندهنده تشکیل Zn
2Cl
2 است که یک ترکیب روی با حالت اکسایش +۱ محسوب میشود.[۴۵] محاسبات نشان میدهند که تشکیل ترکیب روی با عدد اکسایش +۴ بعید است.[۵۲] پیشبینی میشود که Zn(III) در حضور آنیونهای سهگانه بسیار الکترونگاتیو وجود داشته باشد،[۵۳][۵۴] اما همچنان تردیدهایی دربارهٔ این احتمال وجود دارد.[۵۵]
ترکیبات روی(I)
ترکیبات روی(I) بسیار نادرند. یون [Zn2]2+ با تشکیل یک شیشه زرد دیامغناطیس از حل کردن روی فلزی در ZnCl2 مذاب مورد بررسی قرار گرفته است.[۵۶] هسته [Zn2]2+ مشابه کاتیون [Hg2]2+ در ترکیبات جیوه(I) است. ماهیت دیامغناطیس این یون، ساختار دیمر آن را تأیید میکند. نخستین ترکیب روی(I) حاوی پیوند Zn–Zn، دکامتیلدیزینکوسن، در سال ۲۰۰۴ گزارش شد.[۵۷]
ترکیبات روی (II)

3CO
2)
2

ترکیبات دوتایی روی برای بیشتر شبهفلزها و تمامی نافلزها بهجز گازهای نجیب شناخته شدهاند. اکسید روی (روی اکسید) پودری سفید است که در محلولهای آبی خنثی تقریباً نامحلول است، اما آمفوتر بوده و در محلولهای بازی و اسیدی قوی حل میشود.[۴۵] سایر کالکوژنیدها مانند سولفید روی، سلنید روی و تلورید روی در صنایع الکترونیکی و نوری کاربردهای متنوعی دارند.[۵۸]
ترکیبات روی با گروه نیتروژن شامل نیترید روی، فسفید روی، آرسنید روی (Zn
3As
2) و آنتیمونید روی نیز شناخته شدهاند.[۵۹][۶۰] پراکسید روی (پراکسید روی)، هیدرید روی (روی هیدرید) و کاربید روی (ZnC
2) نیز در این دسته جای میگیرند.[۶۱]
از بین چهار هالید اصلی، فلورید روی بیشترین خاصیت یونی را دارد، درحالیکه سایرین از جمله کلرید روی، برمید روی و یدید روی دارای نقطه ذوب نسبتاً پایینتری هستند و پیوندهای کووالانسی بیشتری دارند.[۶۲]
در محلولهای بازی ضعیف حاوی Zn2+
، هیدروکسید روی به صورت یک رسوب سفید رنگ تشکیل میشود. در محیطهای قلیایی قویتر، این هیدروکسید در قالب یونهای زینکات [Zn(OH)4]2−
حل میشود.[۴۵]
برخی دیگر از ترکیبات معدنی رایج روی شامل نیترات روی، کلرات روی، سولفات روی، فسفات روی، مولیبدات روی، سیانید روی، آرسنیت روی (Zn(AsO2)
2)، آرسنات روی (Zn(AsO4)
2·8H
۲O) و کرومات روی هستند. کرومات روی یکی از معدود ترکیبات رنگی روی محسوب میشود.[۶۳][۶۴]
ترکیبات آلی روی
ترکیبات آلی روی شامل پیوندهای کووالانسی بین روی و کربن هستند. دیاتیلروی یکی از معرفهای مهم در شیمی آلی است. این ترکیب نخستین بار در سال ۱۸۴۸ از واکنش روی و اتیل یدید گزارش شد و اولین ترکیب شناختهشده حاوی یک پیوند سیگما بین فلز و کربن بود.[۶۵]
آزمایش شناسایی روی
کاغذ کبالتوسیانید (آزمایش رینمان برای شناسایی روی) بهعنوان یک معرف شیمیایی برای روی استفاده میشود. برای تهیه این کاغذ، ۴ گرم K
3Co(CN)
6 و ۱ گرم KClO
3 در ۱۰۰ میلیلیتر آب حل میشوند. سپس کاغذ در این محلول غوطهور شده و در دمای ۱۰۰ درجه سانتیگراد خشک میشود. اگر یک قطره از نمونه آزمایشی روی کاغذ خشک چکانده شده و حرارت داده شود، تشکیل یک دیسک سبز نشاندهنده حضور روی است.[۶۶]
Remove ads
تاریخچه
خلاصه
دیدگاه
استفاده در دوران باستان

شواهد مختلفی از استفاده از روی ناخالص در دوران باستان یافت شده است. سنگ معدن روی هزاران سال پیش از کشف این عنصر بهصورت مستقل، برای ساخت برنج (آلیاژ مس و روی) بهکار میرفت. نمونههایی از برنج متعلق به سدههای چهاردهم تا دهم پیش از میلاد در یهودیه کشف شده که حاوی ۲۳٪ روی است.[۱۴]
دانش تولید برنج تا قرن هفتم پیش از میلاد به یونان باستان رسید، اما گونههای کمی از آن ساخته میشد.[۱۵] همچنین، زیورآلاتی ساختهشده از آلیاژهایی که ۸۰ تا ۹۰ درصد آنها روی بوده و حاوی سرب، آهن، آنتیموان و فلزات دیگر نیز بودهاند، یافت شدهاند که قدمتی ۲۵۰۰ ساله دارند.[۲۸] یک پیکرهٔ فلزی که احتمالاً متعلق به دوران ماقبل تاریخ است و ۸۷٫۵٪ آن از روی تشکیل شده، در یک محوطهٔ باستانشناسی در داکیه کشف شده است.[۶۷]
استرابون در قرن اول پیش از میلاد، با نقلقول از اثر گمشدهای متعلق به تئوپومپ مورخ قرن چهارم پیش از میلاد، از «قطرات نقرهٔ کاذب» یاد میکند که با مس ترکیب شده و برنج را میسازند. این احتمالاً به مقادیر اندک روی اشاره دارد که بهعنوان محصول جانبی فرایند استخراج سولفیدهای فلزی تولید میشده است.[۶۸] در آن زمان، روی باقیمانده در کورههای ذوب معمولاً بیارزش تلقی میشد و دور ریخته میشد.[۶۹]
ساخت برنج در روم باستان حدود ۳۰ پیش از میلاد شناخته شده بود.[۷۰] رومیها برنج را از طریق حرارت دادن پودر کالامین (سیلیکات یا کربنات روی) همراه با زغال چوب و مس در یک بوتهٔ ذوب تولید میکردند.[۷۰] محصول نهایی که بهعنوان برنج کالامین شناخته میشد، سپس به شکلهای مختلف ریختهگری یا چکشکاری میشد و در ساخت جنگافزارها مورد استفاده قرار میگرفت.[۷۱] برخی سکههای ضربشدهٔ رومی در دوران مسیحی حاوی این نوع برنج هستند.[۷۲]
قدیمیترین قرصهای دارویی شناختهشده از کربناتهای روی، هیدروزینسیت و اسمیتسونیت ساخته شده بودند. این قرصها برای درمان عفونتهای چشمی استفاده میشدند و در لاشهٔ کشتی رومی Relitto del Pozzino که در سال ۱۴۰ پیش از میلاد غرق شده بود، یافت شدهاند.[۷۳][۷۴]
لوح زینک برن یک پلاک نیایشی متعلق به گال روم است که از آلیاژی ساخته شده که عمدتاً حاوی زینک است.[۷۵]
در چراک سامهیتا، که تصور میشود بین ۳۰۰ تا ۵۰۰ میلادی نگاشته شده باشد،[۷۶] به فلزی اشاره شده که هنگام اکسید شدن، مادهای به نام پوشپانجان تولید میکند که گمان میرود همان اکسید زینک باشد.[۷۷]
معدنهای زینک در زوار، نزدیک اودیپور در هند، از زمان امپراتوری مائوریا (حدود ۳۲۲ تا ۱۸۷ پیش از میلاد) فعال بودهاند. با این حال، شواهد نشان میدهد که ذوب زینک فلزی در این منطقه احتمالاً از حدود قرن دوازدهم میلادی آغاز شده است.[۷۸][۷۹]
یک برآورد نشان میدهد که این منطقه بین قرنهای دوازدهم تا شانزدهم میلادی، حدود یک میلیون تُن زینک فلزی و اکسید زینک تولید کرده است.[۳۰] برآوردی دیگر مقدار کل تولید زینک فلزی را در این بازه، حدود ۶۰٬۰۰۰ تُن تخمین میزند.[۷۸]
کتاب راسراتنا ساموچایا، که حدوداً در قرن سیزدهم میلادی نوشته شده است، به دو نوع کانی حاوی زینک اشاره دارد: یکی برای استخراج فلز و دیگری برای کاربردهای دارویی.[۷۹]
مطالعات اولیه و نامگذاری
زینک بهطور مشخص بهعنوان یک فلز تحت نام یاسادا یا جاسادا در فرهنگنامه پزشکی منسوب به شاه هندو، مداناپالا (از دودمان تاکا) که حدود سال ۱۳۷۴ نوشته شده، شناخته شده است.[۸۰]
ذوب و استخراج زینک ناخالص از طریق احیای کالمین (کانی حاوی زینک) با استفاده از پشم و سایر مواد آلی، در قرن سیزدهم در هند انجام شد.[۱۹][۸۱]
چینیها تا قرن هفدهم با این روش آشنا نشدند.[۸۱]

کیمیاگران زینک فلزی را در هوا میسوزاندند و اکسید حاصل را روی یک کندانسور جمعآوری میکردند. برخی کیمیاگران این اکسید را lana philosophica (لاتین: "پشم فیلسوف") مینامیدند، زیرا بهشکل تودههای پشمی جمع میشد. برخی دیگر، آن را شبیه برف سفید میدانستند و nix album (لاتین: "برف سفید") نامگذاری کردند.[۸۲]
نام این فلز احتمالاً برای نخستین بار توسط پاراسلسوس، کیمیاگر سوئیسی-آلمانی، در قرن شانزدهم در کتاب Liber Mineralium II با عناوین "zincum" یا "zinken" ثبت شد.[۸۱][۸۳]
این واژه احتمالاً از کلمه آلمانی zinke مشتق شده و بهمعنی «دندانمانند، نوکتیز یا دندانهدار» است، زیرا بلورهای زینک دارای ظاهری سوزنیشکل هستند.[۸۴]
همچنین، zink میتواند بهمعنی «مشابه قلع» باشد، زیرا با واژه آلمانی zinn که به معنای قلع است، مرتبط است.[۸۵]
احتمال دیگری این است که این واژه از کلمه فارسی سنگ seng بهمعنی سنگ مشتق شده باشد.[۸۶]
این فلز همچنین با نامهای قلع هندی، توتانگو، کالمین و اسپینتر شناخته میشد.[۲۸]
متالورژیست آلمانی آندریاس لیباویوس در سال ۱۵۹۶ مقدار مشخصی از مادهای به نام "calay" (برگرفته از واژه مالایی یا هندی برای قلع) را دریافت کرد. این ماده از یک کشتی تجاری پرتغالی که در نزدیکی ساحل مالابار توقیف شده بود، بهدست آمد.[۸۷]
لیباویوس خواص این نمونه را توصیف کرد که احتمالاً زینک بوده است. در قرون هفدهم و اوایل هجدهم، زینک بهطور منظم از شرق به اروپا وارد میشد،[۸۱] اما گاهی قیمت آن بسیار بالا بود.[ب]
جداسازی

فلز روی در هند در حدود سال ۱۳۰۰ میلادی جدا شد.[۸۸][۸۹][۹۰] قبل از جدا شدن آن در اروپا، در حدود سال ۱۶۰۰ میلادی از هند وارد میشد.[۹۱] واژهنامه عمومی «Postlewayt»، که اطلاعات فنی در اروپا را ارائه میدهد، روی روی از سال ۱۷۵۱ ذکر نکرده بود، اما این عنصر قبل از آن مورد مطالعه قرار گرفته بود.[۷۹][۹۲]
متالورژیست فلمنکی P. M. de Respour گزارش داد که در سال ۱۶۶۸ فلز روی را از اکسید روی استخراج کرده است.[۳۰] تا شروع قرن ۱۸، Étienne François Geoffroy توصیف کرد که چگونه اکسید روی به صورت بلورهای زرد بر روی میلههای آهنی که بالای سنگ معدن روی ذوب میشد، متراکم میشود.[۳۰] در بریتانیا، گفته میشود که جان لین آزمایشهایی برای ذوب روی انجام داده است که احتمالاً در لندور انجام شده است، پیش از ورشکستگی او در 1726.[۹۳]
در سال ۱۷۳۸ در بریتانیا، ویلیام چمپیون یک فرایند برای استخراج روی از کالامین در کورهای به سبک عمودی قرع ثبت اختراع کرد.[۹۴] تکنیک او شباهت به روشی داشت که در معادن روی زوار در راجستان استفاده میشد، اما شواهدی وجود ندارد که نشان دهد او از شرق بازدید کرده است.[۹۱] فرایند چمپیون تا سال ۱۸۵۱ استفاده میشد.[۸۱]
شیمیدان آلمانی آندرئاس زیگیسموند مارگراف معمولاً به عنوان اولین فردی شناخته میشود که روی خالص را در غرب جدا کرده است، حتی اگر شیمیدان سوئدی آنتون فون سواب چهار سال قبل از او روی را از کالامین تقطیر کرده باشد.[۸۱] در آزمایش او در سال ۱۷۴۶، مارگراف مخلوطی از کالامین و زغالسنگ را در یک ظرف بسته بدون مس حرارت داد تا فلزی بهدستآورد.[۹۵][۶۹] این روش تا سال ۱۷۵۲ بهطور تجاری عملی شد.[۹۶]
کارهای بعدی

برادر ویلیام چمپیون، جان، در سال ۱۷۵۸ یک فرایند را برای تکلیس سولفید روی به اکسیدی که در فرایند رتورت قابل استفاده باشد ثبت اختراع کرد.[۲۸] قبل از این، تنها کالامین میتوانست برای تولید روی استفاده شود. در سال ۱۷۹۸، یوهان کریستین روبِرگ فرایند ذوب را بهبود بخشید و اولین کوره رتورت افقی را ساخت.[۹۷] ژان-ژاک دانیل دونی نوع دیگری از کوره ذوب روی افقی را در بلژیک ساخت که قادر به پردازش بیشتر روی بود.[۸۱]
پزشک ایتالیایی لوییجی گالوانی در سال ۱۷۸۰ کشف کرد که اتصال طناب نخاعی یک قورباغه تازه کالبدشکافی شده به یک ریل آهنی متصل به یک قلاب برنجی باعث تکان خوردن پای قورباغه میشود.[۹۸] او به اشتباه فکر کرد که توانسته است قابلیتی در اعصاب و عضلات برای تولید الکتریسیته کشف کند و اثر آن را «الکتریسیته حیوانی» نامید.[۹۹] سلول گالوانی و فرایند گالوانیزهکردن هر دو به افتخار لوییجی گالوانی نامگذاری شدند و کشفیات او راه را برای اختراع باتری، گالوانیزهکردن و حفاظت کاتدی هموار کرد.[۹۹]
دوست گالوانی، آلساندرو ولتا، تحقیقات خود را ادامه داد و در سال ۱۸۰۰ پیل ولتایی را اختراع کرد.[۹۸] پیل ولتا از یک سری صفحات مس و روی ساده شده تشکیل شده بود که بهوسیله یک الکترولیت به هم متصل بودند. با قرار دادن این واحدها بهصورت سری، پیل ولتا (یا "باتری") بهطور کلی ولتاژ بالاتری داشت که استفاده از آن راحتتر از سلولهای تک بود. الکتریسیته تولید میشود زیرا پتانسیل ولتا بین دو صفحه فلزی باعث میشود که الکترونها از روی به مس منتقل شوند و روی را خورده کنند.[۹۸]
ویژگی غیرمغناطیسی روی و عدم رنگ آن در محلول باعث شد که کشف اهمیت آن در بیوشیمی و تغذیه تا سال ۱۹۴۰ به تأخیر بیفتد.[۱۰۰] این وضعیت در سال ۱۹۴۰ تغییر کرد زمانی که کربنیک آنهیدراز، آنزیمی که دیاکسید کربن را از خون پاک میکند، نشان داده شد که روی در جایگاه فعال آن وجود دارد.[۱۰۰] آنزیم هضمی کربوکسیپپتیداز در سال ۱۹۵۵ بهعنوان دومین آنزیم شناختهشده حاوی روی معرفی شد.[۱۰۰]
Remove ads
تولید
خلاصه
دیدگاه
استخراج و فرآوری




۲۷°۵۷′۱۷″ جنوبی ۰۱۶°۴۶′۰۰″ شرقی

۲۷°۴۹′۰۹″ جنوبی ۰۱۶°۳۶′۲۸″ شرقی
روی چهارمین فلز پرمصرف در جهان پس از آهن، آلومینیم و مس است و تولید سالانه آن حدود ۱۳ میلیون تن برآورد میشود.[۳۱] بزرگترین تولیدکننده روی در جهان نیراستار است، که از ادغام شرکت استرالیایی اوز مینرالز و شرکت بلژیکی یومیکور تشکیل شده است.[۱۰۳] حدود ۷۰٪ از روی جهان از استخراج معادن تأمین میشود، در حالی که ۳۰٪ باقیمانده از بازیافت روی ثانویه به دست میآید.[۱۰۴]
روی خالص تجاری با نام Special High Grade یا SHG شناخته میشود و دارای خلوص ۹۹٫۹۹۵٪ است.[۱۰۵]
در سراسر جهان، ۹۵٪ از روی جدید از ذخایر معدنی سولفید استخراج میشود که در آن اسفالریت (ZnS) تقریباً همیشه با سولفیدهای مس، سرب و آهن همراه است.[۱۰۶]: 6 معادن روی در سراسر جهان پراکنده هستند، اما مناطق اصلی استخراج در چین، استرالیا و پرو قرار دارند. در سال ۲۰۱۴، چین ۳۸٪ از تولید جهانی روی را به خود اختصاص داده بود.[۳۱]
فلز روی با استفاده از متالورژی استخراجی تولید میشود.[۱۰۷]: 7 سنگ معدن ابتدا بهطور دقیق آسیاب میشود و سپس با استفاده از شناورسازی کف، مواد معدنی از گانگ (بر اساس خاصیت آبگریزی) جدا شده و کنسانتره سولفید روی به دست میآید.[۱۰۷]: 16 این کنسانتره معمولاً حاوی حدود ۵۰٪ روی، ۳۲٪ گوگرد، ۱۳٪ آهن و ۵٪ SiO
2 است.[۱۰۷]: 16
در فرایند تشویه، کنسانتره سولفید روی به اکسید روی تبدیل میشود:[۱۰۶]
دیاکسید گوگرد حاصل از این فرایند برای تولید اسید سولفوریک استفاده میشود که در فرایند لیچینگ ضروری است. اگر ذخایر معدنی از نوع کربنات روی، سیلیکات روی یا گاهنیت باشند (مانند ذخیره Skorpion Zinc در نامیبیا)، مرحله تشویه قابل حذف است.[۱۰۸]
برای فرآوری بیشتر، دو روش اصلی استفاده میشود: پیرومتالورژی و الکترووینینگ. در روش پیرومتالورژی، اکسید روی با کربن یا منوکسید کربن در دمای حدود ۹۵۰ درجه سلسیوس (۱٬۷۴۰ درجه فارنهایت) کاهش مییابد و به فلز روی تبدیل میشود. این فلز سپس به صورت بخار روی تقطیر شده و از سایر فلزاتی که در این دما فرار نیستند، جدا میشود.[۱۰۹] بخار روی در یک کندانسور جمعآوری میشود.[۱۰۶] معادلات زیر این فرایند را توصیف میکنند:[۱۰۶]
در الکترووینینگ، روی از کنسانتره سنگ معدن توسط سولفوریک اسید شسته شده و ناخالصیها رسوب میکنند:[۱۱۰]
در نهایت، روی از طریق برقکافت کاهش مییابد.[۱۰۶]
اسید سولفوریک دوباره احیا شده و به مرحله شستوشو بازگردانده میشود.
هنگامی که مواد اولیه گالوانیزهشده به یک کوره قوس الکتریکی تغذیه میشوند، روی از گرد و غبار حاصل از طریق چندین فرایند، بهویژه فرایند ولز (که تا سال ۲۰۱۴ حدود ۹۰٪ بازیابی روی را شامل میشد) استخراج میشود.[۱۱۱]
تأثیرات زیستمحیطی
تصفیه سنگهای معدنی سولفیدی روی، حجم زیادی دیاکسید گوگرد و بخار کادمیم تولید میکند. سرباره و سایر پسماندهای حاصل از ذوب حاوی مقادیر قابل توجهی فلزات هستند. بین سالهای ۱۸۰۶ تا ۱۸۸۲، حدود ۱٫۱ میلیون تن روی فلزی و ۱۳۰ هزار تن سرب در شهرهای بلژیکی کلمی و پلومبیر استخراج و ذوب شد.[۱۱۲]
زبالههای عملیات استخراج قدیمی همچنان روی و کادمیم را به محیط اطراف نشت میدهند و رسوبات رودخانه Geul حاوی مقادیر قابلتوجهی از این فلزات هستند.[۱۱۲]
حدود دو هزار سال پیش، انتشار سالانه روی ناشی از استخراج و ذوب معادل ۱۰ هزار تن بود. این مقدار از ۱۸۵۰ میلادی حدود ۱۰ برابر افزایش یافت و در دهه ۱۹۸۰ به اوج خود یعنی ۳٫۴ میلیون تن در سال رسید. سپس در دهه ۱۹۹۰ به ۲٫۷ میلیون تن در سال کاهش یافت، اما یک مطالعه در سال ۲۰۰۵ نشان داد که میزان روی در تروپوسفر قطب شمال کاهش مورد انتظار را نشان نمیدهد. نسبت انتشار روی ناشی از فعالیتهای انسانی در مقایسه با منابع طبیعی ۲۰ به ۱ است.[۶]
میزان روی در رودخانههایی که از مناطق صنعتی و معدنی عبور میکنند، ممکن است تا ۲۰ ppm باشد.[۱۱۳] با این حال، تصفیه فاضلاب این میزان را تا حد زیادی کاهش میدهد. به عنوان نمونه، تصفیه در حوضه راین سطح روی را به ۵۰ ppb رسانده است.[۱۱۳]
غلظتهای روی حتی به مقدار ۲ ppm نیز میتواند بر مقدار اکسیژنی که ماهیها میتوانند در خون خود حمل کنند، تأثیر منفی بگذارد.[۱۱۴]
آلودگی خاک ناشی از استخراج، پالایش یا کوددهی با لجنهای حاوی روی میتواند منجر به غلظت چندین گرم روی در هر کیلوگرم خاک خشک شود. سطح روی بالاتر از ۵۰۰ ppmدر خاک، جذب سایر مواد مغذی معدنی مانند آهن و منگنز را در گیاهان مختل میکند. برخی نمونههای خاک دارای غلظت روی بین ۲۰۰۰ ppm تا ۱۸۰٬۰۰۰ ppm (معادل ۱۸٪) گزارش شدهاند.[۱۱۳]
Remove ads
کاربردها
خلاصه
دیدگاه
کاربردهای عمدهٔ روی شامل موارد زیر است، درصدها برای ایالات متحده ذکر شدهاند:[۱۱۷]
- گالوانیزهکردن (۵۵٪)
- برنج و برنز (۱۶٪)
- سایر آلیاژها (۲۱٪)
- متفرقه (۸٪)
ضد خوردگی و باتریها


روی معمولاً بهعنوان عاملی ضد خوردگی مورد استفاده قرار میگیرد،[۱۱۸] و گالوانیزهکردن (پوشش دادن آهن یا فولاد با روی) رایجترین روش آن است. در سال ۲۰۰۹، در ایالات متحده ۵۵٪ یا ۸۹۳٬۰۰۰ تن فلز روی برای گالوانیزهکردن مصرف شد.[۱۱۷]
روی نسبت به آهن یا فولاد واکنشپذیری بیشتری دارد و بنابراین تقریباً تمامی اکسایش موضعی را جذب میکند تا زمانی که کاملاً خورده شود.[۱۱۹] لایهای محافظ از اکسید و کربنات (Zn
5(OH)
6(CO
3)
2)) هنگام خوردگی روی تشکیل میشود.[۱۲۰] این لایه حتی در صورت خراشیدهشدن نیز محافظت را حفظ میکند، اما در طول زمان بهدلیل خوردگی تدریجی روی، تخریب میشود.[۱۲۰] روی بهصورت الکتروشیمیایی یا بهعنوان روی مذاب با استفاده از گالوانیزه گرم یا اسپری کردن اعمال میشود. گالوانیزهکردن در نردههای زنجیری، گاردریلها، پلهای معلق، تیرهای روشنایی، سقفهای فلزی، مبدلهای حرارتی و بدنهٔ خودروها کاربرد دارد.[۱۲۱]
واکنشپذیری نسبی روی و قابلیت آن در جذب اکسایش باعث میشود که بهعنوان یک آند گالوانی در حفاظت کاتدی (CP) مؤثر باشد. بهعنوان مثال، حفاظت کاتدی یک خط لولهٔ مدفون را میتوان با اتصال آندهایی از جنس روی به لوله تأمین کرد.[۱۲۰] در این حالت، روی بهعنوان آند (ترمینال منفی) عمل کرده و با خوردگی تدریجی، جریان الکتریکی را به خط لولهٔ فولادی منتقل میکند.[۱۲۰][پ] روی همچنین برای حفاظت کاتدی فلزاتی که در معرض آب دریا قرار دارند، استفاده میشود.[۱۲۲] یک دیسک روی که به سکان آهنی یک کشتی متصل است، بهتدریج خورده میشود، در حالی که سکان سالم میماند.[۱۱۹] بههمین ترتیب، یک شاخهٔ روی که به پروانهٔ کشتی یا محافظ فلزی کیل متصل است، حفاظت موقتی را فراهم میکند.
با داشتن پتانسیل الکترود استاندارد (SEP) برابر با ۰٫۷۶− ولت، روی بهعنوان مادهٔ آند برای باتریها بهکار میرود. (عنصر واکنشپذیرتر لیتیم (SEP ۳٫۰۴− V) بهعنوان آند در باتری لیتیمی استفاده میشود). روی پودری بههمین منظور در باتری قلیایی استفاده میشود و محفظهٔ (که بهعنوان آند نیز عمل میکند) باتری روی–کربن از ورق روی ساخته میشود.[۱۲۳][۱۲۴] روی بهعنوان آند یا سوخت در باتری روی-هوا/سلول سوختی نیز کاربرد دارد.[۱۲۵][۱۲۶][۱۲۷] باتری روی-سریم باتری جریان نیز بر پایهٔ یک نیمسلول منفی روی عمل میکند.[۱۲۸]
آلیاژها
یکی از آلیاژهای پرکاربرد روی، برنج است که در آن مس با ۳ تا ۴۵ درصد روی، بسته به نوع برنج، آلیاژ میشود.[۱۲۰] برنج بهطور کلی از مس شکلپذیرتر و قویتر بوده و مقاومت بهتری در برابر خوردگی دارد.[۱۲۰] این ویژگیها، آن را برای استفاده در تجهیزات ارتباطی، سختافزار، سازهای موسیقی و شیرآلات آب مناسب ساختهاند.[۱۲۰]

دیگر آلیاژهای پرکاربرد روی شامل ورشو، فلز ماشینتحریر، لحیم نرم و آلومینیومی، و برخی انواع برنز تجاری هستند.[۱۹] روی همچنین در ارگهای لولهای مدرن، جایگزین آلیاژ سنتی سرب و قلع در لولهها شده است.[۱۲۹] آلیاژهایی با ۸۵ تا ۸۸ درصد روی، ۴ تا ۱۰ درصد مس و ۲ تا ۸ درصد آلومینیوم، در برخی انواع یاتاقانهای ماشینآلات استفاده محدودی دارند. از سال ۱۹۸۲، روی فلز اصلی در سکههای یک سنتی آمریکا (پنی) بوده است.[۱۳۰] در این سکهها، هسته رویی با لایه نازکی از مس پوشیده میشود تا ظاهر مسی داشته باشند. در سال ۱۹۹۴، ۳۳٬۲۰۰ تن روی برای تولید ۱۳٫۶ میلیارد سکه یک سنتی در ایالات متحده مصرف شد.[۱۳۱]
آلیاژهای روی با مقادیر اندک مس، آلومینیوم و منیزیم در ریختهگری تحت فشار و ریختهگری چرخشی بهویژه در صنایع خودروسازی، الکتریکی و سختافزار کاربرد دارند.[۱۹] این آلیاژها با نام تجاری Zamak به بازار عرضه میشوند.[۱۳۲] نمونهای از این آلیاژها، روی-آلومینیوم است که بهدلیل نقطه ذوب پایین و گرانروی کم، امکان تولید قطعات کوچک و پیچیده را فراهم میکند. دمای پایین کار با این آلیاژ منجر به سرد شدن سریع قطعات ریختهگری شده و افزایش سرعت تولید میشود.[۱۹][۱۳۳]
آلیاژ دیگری با نام تجاری Prestal، شامل ۷۸٪ روی و ۲۲٪ آلومینیوم است و گزارش شده که تقریباً به استحکام فولاد اما به نرمی پلاستیک است.[۱۹][۱۳۴] این خاصیت، به آن امکان ابرمومسانی میدهد، بهطوری که میتوان آن را با قالبهایی از جنس سرامیک و سیمان شکلدهی کرد.[۱۹]
آلیاژهای مشابه با افزودن مقادیر کمی سرب میتوانند بهصورت ورق نورد سرد تولید شوند. یک آلیاژ حاوی ۹۶٪ روی و ۴٪ آلومینیوم برای ساخت قالبهای سنبه-ماتریس در تولیدات کمتیراژ، که استفاده از قالبهای فلزی آهنی پرهزینه خواهد بود، به کار میرود.[۱۳۵] در نمای ساختمانها، پوشش بام و سایر کاربردهای ورقکاری که نیاز به کشش عمیق، رولفرمینگ یا خمکاری دارند، از آلیاژهای روی-تیتانیوم-مس استفاده میشود.[۱۳۶] روی خالص برای این فرایندها بیش از حد شکننده است.[۱۳۶]
بهعنوان جایگزینی برای سرب، روی بهدلیل چگالی بالا، قیمت پایین و قابلیت کار آسان، در وزنههایی مانند وزنههای ماهیگیری، تعادل تایرخودرو و چرخ لنگر استفاده میشود.[۱۳۷][۱۳۸]
آلیاژ کادمیوم-روی-تلورید (CZT) یکنیمهرسانای پیشرفته است که میتواند در آرایههایی مشابه مدارهای مجتمع ساخته شود و برای آشکارسازی پرتو گاما بهکار رود.[۱۳۹]
سایر کاربردهای صنعتی
بیش از یکچهارم از کل تولید روی در ایالات متحده در سال ۲۰۰۹ در ترکیبات روی مصرف شد؛[۱۱۷] ترکیباتی که بهطور گسترده در صنعت کاربرد دارند. اکسید روی بهعنوان یک رنگدانه سفید در رنگها و بهعنوان فروکافت در تولید لاستیک برای پخش گرما استفاده میشود. همچنین، اکسید روی از پلیمرهای لاستیکی و پلاستیکها در برابر فرابنفش (UV) محافظت میکند.[۱۲۱] ویژگیهای نیمرسانای اکسید روی، آن را در ساخت وریستورها و محصولات فتوکپی مفید ساخته است.[۱۴۰] همچنین، چرخه روی–اکسید روی یک فرایند ترموشیمیایی دو مرحلهای بر پایه روی و اکسید روی برای تولید هیدروژن است.[۱۴۱]
کلرید روی معمولاً به چوب افزوده میشود تا بهعنوان پیشگیرنده آتش عمل کند[۱۴۲] و در برخی موارد بهعنوان ماده نگهدارنده چوب به کار میرود.[۱۴۳] این ترکیب در تولید سایر مواد شیمیایی نیز کاربرد دارد.[۱۴۲] دیمتیل روی (Zn(CH3)
2) در فرآیندهای سنتز آلی به کار گرفته میشود.[۱۴۴] سولفید روی (ZnS) در رنگدانههای تابناک، مانند عقربههای ساعت، صفحههای پرتو ایکس، صفحهنمایشهای تلویزیونی و رنگهای شبتاب استفاده میشود.[۱۴۵] بلورهای ZnS در لیزرهایی که در محدوده فروسرخ طیف الکترومغناطیسی کار میکنند، کاربرد دارند.[۱۴۶] همچنین، سولفات روی بهعنوان یک ماده شیمیایی در رزانهها و رنگدانهها کاربرد دارد.[۱۴۲] پیریتیون روی نیز در رنگهای ضد خزه و جلبک مورد استفاده قرار میگیرد.[۱۴۷]
پودر روی گاهی بهعنوان سوخت موشک در راکتهای مدل به کار میرود.[۱۴۸] ترکیبی فشرده از ۷۰٪ روی و ۳۰٪ گوگرد در صورت احتراق، واکنش شیمیایی شدیدی ایجاد میکند.[۱۴۸] این واکنش، سولفید روی تولید میکند و در عین حال، مقدار زیادی گاز داغ، گرما و نور آزاد میشود.[۱۴۸]
ورق فلزی روی بهعنوان یک پوشش بادوام برای سقفها، دیوارها و پیشخوانها استفاده میشود. این کاربرد بهویژه در بیستروها و بارهای صدف رایج است. یکی از ویژگیهای این نوع پوشش، فرایند اکسایش-کاهش آن است که با گذشت زمان، سطح آن را به یک پتینه آبی-خاکستری تبدیل میکند و همچنین مستعد خراشیدگی است.[۱۴۹][۱۵۰][۱۵۱][۱۵۲]
روی-۶۴ (64
Zn)، ایزوتوپ فراوان روی، بهشدت در برابر فعالسازی نوترونی حساس است و از طریق تبدیل هستهای به 65
Zn، یک ایزوتوپ بسیار پرتوزا با نیمهعمر ۲۴۴ روز، تبدیل میشود که پرتو گامای شدیدی منتشر میکند. به همین دلیل، اکسید روی مورد استفاده در راکتورهای هستهای بهعنوان عامل ضد خوردگی، پیش از مصرف از 64
Zn تهی میشود که این فرایند به نام اکسید روی تهیشده شناخته میشود.
به همین علت، روی بهعنوان یک ماده بمب نمکی در جنگافزار هستهای پیشنهاد شده است (هرچند که کبالت بهعنوان یک گزینه شناختهشدهتر در این زمینه مطرح است). در این روش، یک لایه از 64
Zn تحت تأثیر شار شدید نوترونی پرانرژی ناشی از انفجار یک سلاح گرماهستهای قرار میگیرد و مقدار زیادی از 65
Zn تولید میکند که بهطور چشمگیری رادیواکتیویته بارش هستهای سلاح را افزایش میدهد. بااینحال، تاکنون هیچ گزارشی مبنی بر ساخت، آزمایش یا استفاده از چنین سلاحی وجود ندارد.[۱۵۳]
65
Zn بهعنوان نشانگذاری ایزوتوپی برای مطالعه سایش آلیاژهای حاوی روی و بررسی مسیر و نقش روی در موجودات زنده مورد استفاده قرار میگیرد.[۱۵۴]
ترکیبات دیتیوکاربامات روی بهعنوان قارچکش در کشاورزی استفاده میشوند که ازجمله آنها میتوان به زینیب، متیرام، پروپینب و زیرام اشاره کرد.[۱۵۵] ناپنتات روی بهعنوان ماده نگهدارنده چوب کاربرد دارد.[۱۵۶] همچنین ترکیب ZDDP در روغن موتور بهعنوان افزودنی ضد سایش برای قطعات فلزی استفاده میشود.[۱۵۷]
شیمی آلی روی
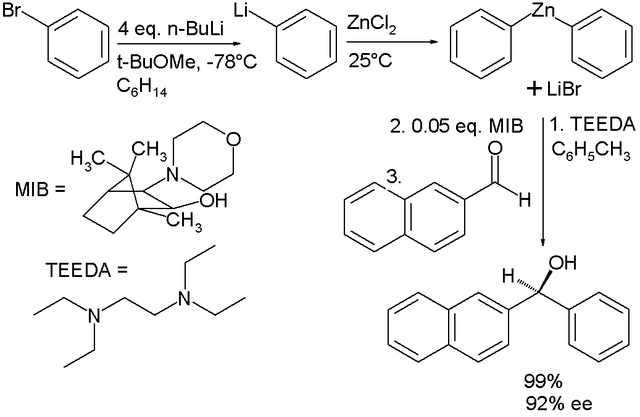
ترکیبات آلی روی شاخهای از شیمی است که به مطالعه ترکیبات حاوی پیوندهای کربن-روی میپردازد و شامل بررسی خواص فیزیکی، روشهای سنتز و واکنشهای شیمیایی این ترکیبات میشود. بسیاری از ترکیبات آلی روی از نظر تجاری اهمیت دارند.[۱۵۹][۱۶۰][۱۶۱][۱۶۲] کاربردهای مهم این ترکیبات شامل:
- واکنش فرانکلند-دوپا که در آن یک اگزالات استر (ROCOCOOR) با یک هالوآلکان R'X، روی و هیدروکلریک اسید واکنش داده و استرهای α-هیدروکسیکربوکسیلیک RR'COHCOOR را تشکیل میدهد.[۱۶۳][۱۶۴]
- ترکیبات آلی روی (ارگانوزینکها) دارای واکنشپذیری مشابه واکنشگر گرینیارد هستند اما بهطور قابل توجهی کمتر هستهدوست بوده و گرانتر و دشوارتر برای کار هستند. این ترکیبات معمولاً به عنوان عوامل افزودنی هستهدوست برای الکتروندوستهایی مانند آلدئید استفاده شده و سپس به الکل کاهش مییابند. برخی از ترکیبات تجاری موجود شامل دیمتیل روی، دیاتیلروی و دیفنیلروی هستند. مشابه واکنشگر گرینیارد، ترکیبات آلی روی اغلب از ترکیبات ارگانوبرومین سنتز میشوند.
روی در کاتالیز در سنتز آلی بهطور گسترده مورد استفاده قرار گرفته است، از جمله در سنتز نامتقارن که جایگزینی ارزان و در دسترس برای کمپلکسهای فلزات گرانبها محسوب میشود. نتایج کمی (بازده و افزایش انانتیومری) حاصل از کاتالیزورهای روی کیرال میتواند با فلزاتی مانند پالادیم، روتنیم و ایریدیوم قابل مقایسه باشد.[۱۶۵]
مکمل غذایی


در اغلب مکملهای روزانه تکقرصی که بدون نسخه عرضه میشوند، روی در اشکالی مانند اکسید روی، استات روی، گلوکونات روی یا کلات آمینواسیدی روی گنجانده میشود.[۱۶۶][۱۶۷]
بهطور کلی، مصرف مکمل روی در مناطقی با خطر بالای کمبود این ماده معدنی (مانند کشورهای با درآمد کم و متوسط) توصیه میشود.[۱۶۸] هرچند که سولفات روی به عنوان یکی از رایجترین اشکال مورد استفاده است، اما گزینههایی مانند سیترات، گلوکونات و پیکولینات روی نیز به دلیل جذب بهتر نسبت به اکسید روی مطرح هستند.[۱۶۹]
گاستروانتریت
روی یک درمان ارزان و مؤثر برای اسهال در کودکان کشورهای در حال توسعه محسوب میشود. در هنگام اسهال، سطح روی در بدن کاهش مییابد و جبران آن با یک دوره درمانی ۱۰ تا ۱۴ روزه میتواند مدت و شدت اپیزودهای اسهالی را کاهش داده و احتمالاً تا سه ماه از بروز مجدد آن جلوگیری کند.[۱۷۰] گاستروانتریت با مصرف روی بهشدت کاهش مییابد، که احتمالاً به دلیل تأثیر مستقیم ضدمیکروبی یونهای آن در لوله گوارش یا جذب روی و ترشح مجدد آن از سلولهای ایمنی (همه گرانولوسیتها روی ترشح میکنند) یا هر دو عامل است.[۱۷۱][۱۷۲]
سرماخوردگی
مکملهای روی (که معمولاً شامل استات روی یا گلوکونات روی و قرص گلو هستند) یک گروه از مکملهای غذایی طبیعی هستند که معمولاً برای درمان الگو:No selflink استفاده میشوند.[۱۷۳] شواهد نشان میدهند که روی نمیتواند از بروز سرماخوردگی جلوگیری کند اما ممکن است مدت زمان آن را کاهش دهد، بدون اینکه تأثیر قابل توجهی بر شدت علائم داشته باشد.[۱۷۴][۱۷۵] عوارض جانبی مصرف مکملهای روی شامل طعم بد و تهوع میباشد.[۱۷۳] استفاده از افشانه بینی حاوی روی با آنوسمی (بیحسی بینی) مرتبط است؛[۱۷۳] بنابراین در ژوئن ۲۰۰۹، سازمان غذا و دارو (USFDA) هشدار داد که مصرف افشانههای بینی حاوی روی متوقف شود.[۱۷۳]
راینوویروس – شایعترین بیماری ویروسی در انسانها – علت اصلی سرماخوردگی است.[۱۷۶] مکانیسم اثر فرضی که توسط آن روی میتواند شدت و/یا مدت زمان علائم سرماخوردگی را کاهش دهد، شامل سرکوب التهاب بینی و مهار مستقیم راینوویروس و همانندسازی ویروسی آن در مخاط بینی میباشد.[۱۷۳]
یک بررسی از کتابخانه کاکرین در سال ۲۰۲۴ نشان داد که شواهد کمی وجود دارد که نشان دهد روی از سرماخوردگی جلوگیری میکند یا شدت علائم را کاهش میدهد، اگرچه ممکن است مدت زمان علائم را بهطور مختصر کوتاه کند. قرصهای لوژانگ روی با کاهش مدت زمان سرماخوردگی همراه بود، اما شواهد موجود با قطعیت کم بود و در مطالعات مختلف تفاوتهایی داشت.[۱۷۴]
یک بررسی در سال ۲۰۲۲ مشاهده کرد که قرصهای لوژانگ روی ممکن است مدت زمان سرماخوردگی را کاهش دهند، اما تأثیر آن بر شدت علائم و پیشگیری از سرماخوردگی کم بود. این بررسی تأکید کرد که اثر روی بستگی به مدت زمان اولیه سرماخوردگی داشت، به طوری که در سرماخوردگیهای طولانیتر کاهش بیشتری در مدت زمان مشاهده شد.[۱۷۵]
یک مرور سیستماتیک و متاآنالیز در سال ۲۰۲۱ بر روی عفونتهای دستگاه تنفسی نشان داد که روی بهطور مختصر شدت علائم را در روز سوم کاهش داد و مدت زمان بیماری را حدود دو روز کوتاهتر کرد، اگرچه شواهد با قطعیت پایین تا بسیار پایین بود. روی مزیت اندکی در پیشگیری از عفونتها داشت و با افزایش خطر عوارض جانبی خفیف مانند تهوع و تحریک همراه بود.[۱۷۷]
افزایش وزن
کمبود روی ممکن است منجر به کاهش اشتها شود.[۱۷۸] استفاده از روی در درمان بیاشتهایی از سال ۱۹۷۹ پیشنهاد شده است. حداقل ۱۵ آزمایش بالینی نشان دادهاند که روی باعث بهبود افزایش وزن در بیماران مبتلا به بیاشتهایی میشود. یک مطالعه در سال ۱۹۹۴ نشان داد که روی نرخ افزایش شاخص توده بدنی را در درمان بیاشتهایی عصبی دو برابر میکند. کمبود سایر مواد مغذی مانند تیروزین، تریپتوفان و تیامین ممکن است به پدیدهای تحت عنوان «سوءتغذیه القاشده توسط سوءتغذیه» کمک کند.[۱۷۹] یک فراتحلیل از ۳۳ مطالعه مداخلهای در مورد مکملهای روی و تأثیر آن بر رشد کودکان در کشورهای مختلف نشان داد که مکمل روی بهتنهایی تأثیر آماری معناداری بر رشد خطی و افزایش وزن بدن دارد، که نشان میدهد کمبود سایر مواد مغذی که ممکن است وجود داشته باشند، عامل اصلی تأخیر رشد نیستند.[۱۸۰]
سایر موارد
افرادی که مکملهای روی مصرف میکنند، ممکن است پیشرفت تباهی لکه زرد را کند کنند.[۱۸۱] مکمل روی یک درمان مؤثر برای آکرودرماتیت آنتروپاتیک است، یک اختلال ژنتیکی که جذب روی را تحت تأثیر قرار میدهد و پیشتر برای نوزادان مبتلا کشنده بود.[۷۰] کمبود روی با اختلال افسردگی عمده (MDD) مرتبط است و مکملهای روی ممکن است درمان مؤثری باشند.[۱۸۲] روی ممکن است به افراد کمک کند تا بهتر بخوابند.[۴]
استفاده موضعی
داروی موضعی روی شامل محصولاتی است که برای استفاده روی پوست طراحی شدهاند، معمولاً به شکل روی اکسید. روی اکسید بهطور کلی توسط FDA به عنوان یک ماده ایمن و مؤثر شناخته میشود.[۱۸۳] و به عنوان یک ماده بسیار پایدار در برابر نور شناخته میشود.[۱۸۴] روی اکسید یکی از رایجترین مواد فعال است که در ضدآفتابها برای کاهش آفتابسوختگی فرموله میشود.[۷۰] با استفاده از مقدار نازک آن روی ناحیه پوشک نوزاد (الگو:میاندوراه) در هر بار تعویض پوشک، میتوان از ادرار سوختگی نوزادان جلوگیری کرد.[۷۰]
زینک کلاته در خمیر دندانها و دهانشویهها برای جلوگیری از بدبویی دهان استفاده میشود؛ زینک سیترات به کاهش تجمع جرم دندان (تارتار) کمک میکند.[۱۸۵][۱۸۶]
پیریتیون روی بهطور گستردهای در شامپوها برای جلوگیری از شوره سر استفاده میشود.[۱۸۷]
استفاده موضعی از روی همچنین نشان داده شده است که بهطور مؤثر تبخال دستگاه تناسلی را درمان کرده و دورههای بهبودی آن را طولانیتر میکند.[۱۸۸]
Remove ads
نقش زیستی
خلاصه
دیدگاه
روی یک عنصر ضروری کممقدار برای انسانها،[۲][۳][۴] و سایر جانوران،[۵] برای گیاهان[۶] و برای میکروبها است.[۷] روی برای عملکرد بیش از ۳۰۰ آنزیم و ۱۰۰۰ فاکتور رونویسی ضروری است،[۴] و در متالوتیونئینها ذخیره و انتقال مییابد.[۱۸۹][۱۹۰] این عنصر دومین فلز کممقدار در بدن انسان پس از آهن است و تنها فلزی است که در تمام آنزیمها حضور دارد.[۶][۴]
در پروتئینها، یونهای روی اغلب به زنجیرههای جانبی اسید آمینههای اسید آسپارتیک، گلوتامیک اسید، سیستئین و هیستیدین متصل میشوند. توصیف نظری و محاسباتی این اتصال روی در پروتئینها (همچنین فلزات انتقالی دیگر) دشوار است.[۱۹۱]
تقریباً ۲–۴ گرم روی در بدن انسان توزیع شده است.[۱۹۲] بیشتر روی در مغز، عضلات، استخوانها، کلیه و کبد قرار دارد، با بیشترین غلظتها در پروستات و بخشهایی از چشم.[۱۹۳] منی بهویژه غنی از روی است، که عامل کلیدی در عملکرد پروستات و رشد اندام جنسی است.[۱۹۴]
تعادل روی در بدن عمدتاً توسط روده کنترل میشود. در اینجا، ZIP4 و بهویژه TRPM7 با جذب روی از روده که برای بقا پس از تولد ضروری است، مرتبط هستند.[۱۹۵][۱۹۶]
در انسانها، نقشهای زیستی روی در تمامی فرآیندهای زیستی وجود دارد.[۸][۳] این عنصر با «مجموعه وسیعی از لیگاندهای آلی» تعامل دارد،[۸] و نقشهایی در متابولیسم RNA و DNA، ترارسانی، و بیان ژن ایفا میکند. همچنین در تنظیم آپوپتوز دخالت دارد. یک مرور در سال ۲۰۱۵ نشان داد که حدود ۱۰٪ از پروتئینهای انسانی (~۳۰۰۰ پروتئین) روی را متصل میکنند،[۱۹۷] علاوه بر صدها پروتئین دیگر که به حمل و نقل و جابهجایی روی میپردازند؛ یک مطالعه مشابه درونرایانهای در گیاه رشادی گوشموشی ۲۳۶۷ پروتئین مرتبط با روی را یافت.[۶]
در مغز، روی در وزیکولهای سیناپسی خاص ذخیره میشود که توسط گلوتاماترژیک نورونها صورت میگیرد و میتواند تحریکپذیری نورونی را تنظیم کند.[۳][۴][۱۹۸] روی نقش کلیدی در انعطافپذیری سیناپسی و بهدنبال آن در یادگیری ایفا میکند.[۳][۱۹۹] همایستایی روی همچنین نقش حیاتی در تنظیم عملکرد دستگاه عصبی مرکزی دارد.[۳][۱۹۸][۴] اختلال در همایستایی روی در دستگاه عصبی مرکزی که منجر به افزایش غلظتهای سیناپسی روی میشود، به نظر میرسد که باعث سمیتعصبی از طریق استرس اکسیداتیو میتوکندری (برای مثال، با اختلال در برخی آنزیمهای مرتبط با زنجیره انتقال الکترون، از جمله complex I، complex III، و α-ketoglutarate dehydrogenase)، اختلال در همایستایی کلسیم، excitotoxicity نورونهای گلوتاماترژیک، و مداخله در ترارسانی دروننورونی گردد.[۳][۲۰۰] L- و D-histidine فرایند جذب روی را در مغز تسهیل میکنند.[۲۰۱] SLC30A3 به عنوان اصلیترین حامل روی در همایستایی روی مغزی شناخته میشود.[۳]
آنزیمها


روی یک اسید و باز لوییس کارآمد است، که آن را به یک عامل کاتالیزگر مفید در هیدروکسیلدار کردن و سایر واکنشهای آنزیمی تبدیل میکند.[۲۰۲] این فلز همچنین موقعیت هندسی انعطافپذیری دارد که به پروتئینهای استفادهکننده از آن اجازه میدهد تا به سرعت ساختار پروتئین خود را تغییر داده و واکنشهای زیستی را انجام دهند.[۲۰۳] دو مثال از آنزیمهای حاوی روی کربنیک آنهیدراز و کربوکسیپپتیداز هستند که برای فرآیندهای تنظیم کربن دیاکسید (CO
2) و هضم پروتئینها حیاتیاند.[۲۰۴]
در خون مهرهداران، کربنیک آنهیدراز CO
2 را به بیکربنات تبدیل میکند و همین آنزیم بیکربنات را به CO
2 تبدیل کرده و برای دفع از ریهها به خارج میفرستد.[۲۰۵] بدون این آنزیم، این تبدیل حدود یک میلیون بار کندتر انجام میشود[۲۰۶] در پیاچ نرمال خون ۷ یا نیاز به پیاچ ۱۰ یا بیشتر خواهد داشت.[۲۰۷] کربنیک آنهیدراز غیرمرتبط β در گیاهان برای تشکیل برگ، سنتز ایندول-۳-استیک اسید (آوکسین) و تخمیر الکلی مورد نیاز است.[۲۰۸]
کربوکسیپپتیداز پیوندهای پپتیدی را در حین هضم پروتئینها میشکند. یک پیوند داتیو بین پپتید انتهایی و گروه C=O متصل به روی تشکیل میشود، که به کربن بار مثبت میدهد. این کمک میکند تا یک آبگریزی در نزدیکی روی در آنزیم ایجاد شود که بخش غیر قطبی پروتئینی که در حال هضم است را جذب میکند.[۲۰۴]
سیگنالدهی
روی به عنوان یک پیامرسان شناخته شده است که قادر به فعال کردن مسیرهای سیگنالدهی میباشد. بسیاری از این مسیرها نیروی محرکه رشد غیرطبیعی سرطان هستند. این مسیرها میتوانند از طریق حملکنندههای روی هدفگیری شوند.[۲۰۹]
پروتئینهای دیگر
روی نقش ساختاری خالص در انگشت رویها، پیچها و خوشهها ایفا میکند.[۲۱۰] انگشتهای روی بخشی از برخی فاکتور رونویسیها هستند، که پروتئینهایی هستند که در هنگام تکثیر و رونویسی دیانای توالیهای اسید نوکلئیک را شناسایی میکنند. هر یک از نه یا ده یون Zn2+
در یک انگشت روی به حفظ ساختار انگشت کمک میکند با اتصال هماهنگ به چهار آمینو اسید در فاکتور رونویسی.[۲۰۶]
در پلاسمای خون، روی به آلبومین (۶۰٪، با تمایل کم) و ترانسفرین (۱۰٪) متصل است و حمل میشود.[۱۹۲] از آنجا که ترانسفرین همچنین آهن را حمل میکند، مقادیر زیاد آهن جذب روی را کاهش میدهد و برعکس. یک تضاد مشابه با مس وجود دارد.[۲۱۱] غلظت روی در پلاسمای خون نسبت به مصرف روی نسبتاً ثابت میماند.[۲۰۲] سلولهای غده بزاقی، پروستات، سیستم ایمنی و روده از پیامرسانی سلولی برای ارتباط با سایر سلولها استفاده میکنند.[۲۱۲]
روی ممکن است در ذخایر متالوتیونئین در میکروارگانیسمها یا در روده یا کبد حیوانات نگهداری شود.[۲۱۳] متالوتیونئین در سلولهای روده قادر است جذب روی را تا ۱۵–۴۰٪ تنظیم کند.[۲۱۴] با این حال، مصرف ناکافی یا بیش از حد روی میتواند مضر باشد؛ مصرف زیاد روی بهویژه جذب مس را مختل میکند زیرا متالوتیونئین هر دو فلز را جذب میکند.[۲۱۵]
پروتئین حملکننده دوپامین انسانی حاوی یک جایگاه اتصال لیگاند خارجی روی است که با اتصال روی، بازجذب دوپامین را مهار کرده و آمفتامین-هادی افزایش دوپامین را تقویت میکند برونتنی.[۲۱۶][۲۱۷][۲۱۸] پروتئین حملکننده سروتون انسانی و پروتئین حملکننده نوراپینفرین حاوی سایتهای اتصال روی نیستند.[۲۱۸] برخی از دست ئیاف پروتئینهای متصل به کلسیم مانند S100 یا NCS-1 همچنین قادر به اتصال به یونهای روی هستند.[۲۱۹]
تغذیه
توصیههای غذایی
مؤسسه پزشکی ایالات متحده (IOM) نیازمندیهای میانگین تخمینی (EARs) و میزانهای توصیه شده رژیم غذایی (RDAs) برای روی را در سال ۲۰۰۱ بهروزرسانی کرد. EARهای کنونی برای زنان و مردان بالای ۱۴ سال به ترتیب ۶٫۸ و ۹٫۴ میلیگرم در روز هستند. RDAs به ترتیب ۸ و ۱۱ میلیگرم در روز است. RDAs بالاتر از EARها هستند تا مقادیر مورد نیاز افرادی که نیاز بیشتری دارند را پوشش دهند. RDA برای بارداری ۱۱ میلیگرم در روز است و برای شیردهی ۱۲ میلیگرم در روز. برای نوزادان تا ۱۲ ماه، RDA برابر با ۳ میلیگرم در روز است. برای کودکان ۱ تا ۱۳ ساله، RDA از ۳ تا ۸ میلیگرم در روز بسته به سن افزایش مییابد. در خصوص ایمنی، IOM حد مجاز مصرف رژیم غذایی (ULs) را برای ویتامینها و مواد معدنی زمانی که شواهد کافی موجود باشد، تعیین میکند. در مورد روی، UL بزرگسالان ۴۰ میلیگرم در روز است که شامل مواد غذایی و مکملها میشود (برای کودکان کمتر است). مجموعاً EARها، RDAs, AIs و ULها بهعنوان مراجع مصرف رژیم غذایی (DRIs) شناخته میشوند.[۲۰۲]
سازمان ایمنی غذایی اروپا (EFSA) مجموعه اطلاعات فوق را بهعنوان «مراجع تغذیهای جمعیت» معرفی میکند، با «میزان مصرف جمعیت مرجع» (PRI) به جای RDA و «نیازمندی میانگین» به جای EAR. AI و UL به همان روش در ایالات متحده تعریف میشوند. برای افراد بالای ۱۸ سال، محاسبات PRI پیچیده است، زیرا EFSA مقادیر بالاتری را در صورتی که محتوای فیتیک اسید در رژیم غذایی افزایش یابد، تعیین کرده است. برای زنان، PRIها از ۷٫۵ تا ۱۲٫۷ میلیگرم در روز تغییر میکند و برای مردان این محدوده از ۹٫۴ تا ۱۶٫۳ میلیگرم در روز است. این PRIها از RDAهای ایالات متحده بالاتر هستند.[۲۲۰] EFSA همان سؤال ایمنی را بررسی کرده و UL خود را ۲۵ میلیگرم در روز تعیین کرده است که بسیار کمتر از مقدار ایالات متحده است.[۲۲۱]
برای مقاصد برچسبگذاری مواد غذایی و مکملهای رژیمی در ایالات متحده، مقدار موجود در یک وعده بهصورت درصدی از ارزش روزانه (%DV) بیان میشود. برای برچسبگذاری روی، ۱۰۰٪ از ارزش روزانه معادل ۱۵ میلیگرم بود، اما در تاریخ ۲۷ مه ۲۰۱۶ به ۱۱ میلیگرم اصلاح شد.[۲۲۲][۲۲۳] جدول مقادیر قبلی و جدید روزانه بزرگسالان در مقدار مواد مغذی مورد نیاز روزانه آورده شده است.
مصرف غذایی

محصولات حیوانی مانند گوشت، ماهی، صدف، پرندگان، تخممرغ و لبنیات حاوی روی هستند. غلظت روی در گیاهان با سطح خاک متغیر است. با وجود میزان کافی روی در خاک، گیاهان غذایی که بیشترین مقدار روی را دارند شامل گندم (جنین و سبوس) و انواع دانهها هستند که شامل کنجد، شقایق، یونجه، celery و خردل میشود.[۲۲۴] روی همچنین در لوبیا، فندقی, بادام، غله کامل، تخمکدو، تخمه آفتابگردان و انگورفرنگی سیاه یافت میشود.[۲۲۵]
منابع دیگر شامل مواد غذایی تقویت شده و مکملهای غذایی طبیعی به شکلهای مختلف هستند. یک مرور در سال ۱۹۹۸ نتیجه گرفت که اکسید روی، یکی از رایجترین مکملها در ایالات متحده، و کربنات روی تقریباً نامحلول بوده و به سختی در بدن جذب میشوند.[۲۲۶] این مرور مطالعاتی را ارجاع داد که نشان میدهند غلظت روی پلاسما در افرادی که اکسید روی و کربنات روی مصرف کردهاند کمتر از کسانی بود که روی استات و نمکهای سولفات را مصرف کردهاند.[۲۲۶] برای تقویت مواد غذایی، با این حال، یک مرور در سال ۲۰۰۳ استفاده از غلات (حاوی اکسید روی) به عنوان منبعی ارزان و پایدار که به راحتی جذب میشود را به عنوان جایگزینی برای شکلهای گرانتر پیشنهاد کرد.[۲۲۷] یک مطالعه در سال ۲۰۰۵ نشان داد که ترکیبات مختلف روی، از جمله اکسید و سولفات، هیچ تفاوت معناداری در جذب نشان ندادند زمانی که به عنوان تقویتکننده به تورتیلاهای ذرت اضافه شدند.[۲۲۸]
کمبود
تقریباً دو میلیارد نفر در کشورهای در حال توسعه دچار کمبود روی هستند. گروههای در معرض خطر شامل کودکان در کشورهای در حال توسعه و سالمندان مبتلا به بیماریهای مزمن هستند.[۱۰] در کودکان، این مشکل باعث افزایش عفونتها و اسهال میشود و سالانه به مرگ حدود ۸۰۰٬۰۰۰ کودک در سراسر جهان منجر میشود.[۸] سازمان بهداشت جهانی استفاده از مکملهای روی را برای سوءتغذیه شدید و اسهال توصیه میکند.[۲۲۹] مکملهای روی کمک به پیشگیری از بیماریها و کاهش مرگ و میر، بهویژه در میان کودکانی که وزن تولد پایین یا رشد کند دارند، میکند.[۲۲۹] با این حال، مکملهای روی نباید به تنهایی مصرف شوند، زیرا بسیاری از افراد در کشورهای در حال توسعه دچار کمبودهای متعدد هستند و روی با سایر ریزمغذیها تداخل دارد.[۲۳۰] در حالی که کمبود روی معمولاً به دلیل مصرف ناکافی غذا است، میتواند با سوء جذب، آکرودرماتیت آنتروپاتیک، بیماری کبد مزمن، بیماری کلیوی مزمن، کمخونی داسیشکل، دیابت، بدخیمی و دیگر بیماریهای مزمن مرتبط باشد.[۱۰]
در ایالات متحده، یک نظرسنجی فدرال در مورد مصرف مواد غذایی نشان داد که میانگین مصرف روی برای زنان و مردان بالای ۱۹ سال به ترتیب ۹٫۷ و ۱۴٫۲ میلیگرم در روز است. برای زنان، ۱۷٪ کمتر از مقدار مورد نیاز (EAR) مصرف میکنند و برای مردان این رقم ۱۱٪ است. این درصدها با افزایش سن افزایش مییابد.[۲۳۱] آخرین بهروزرسانی منتشر شده از این نظرسنجی (NHANES 2013–2014) میانگینهای کمتری را گزارش کرده است – ۹٫۳ و ۱۳٫۲ میلیگرم در روز – که باز هم با افزایش سن مصرف کاهش مییابد.[۲۳۲]
علائم کمبود خفیف روی بسیار متنوع هستند.[۲۰۲] نتایج بالینی شامل کاهش رشد، اسهال، ناتوانی جنسی و بلوغ جنسی تأخیر یافته، طاسی، ضایعات چشمی و پوستی، کاهش اشتها، تغییرات در شناخت، اختلال در عملکرد ایمنی، اختلال در استفاده از کربوهیدراتها و تراتوژن بودن تولید مثل است.[۲۰۲] کمبود روی موجب کاهش ایمنی میشود،[۲۳۳] اما روی اضافی نیز چنین اثری دارد.[۱۹۲]
با وجود نگرانیهایی که وجود دارد،[۲۳۴] گیاهخواران و وگانهای غربی به اندازه گوشتخواران از کمبود آشکار روی رنج نمیبرند.[۲۳۵] منابع عمده گیاهی روی شامل لوبیاهای خشک پخته شده، سبزیجات دریایی، غلات غنیشده، محصولات سویا، مغزها، نخود و دانهها هستند.[۲۳۴] با این حال، فیتیک اسید موجود در بسیاری از غلات کامل و فیبرها ممکن است جذب روی را مختل کند و اثرات مصرف کمروی هنوز بهطور کامل شناخته نشده است. چنگالش فیتیک اسید که در دانهها و غلات سبوس یافت میشود، میتواند باعث سوء جذب روی شود.[۱۰] برخی شواهد نشان میدهند که ممکن است به مقدار بیشتر از نیاز روزانه آمریکا (۸ میلیگرم در روز برای زنان بالغ؛ ۱۱ میلیگرم در روز برای مردان بالغ) برای افرادی که رژیم غذایی غنی از فیتات دارند، مانند برخی از گیاهخواران، نیاز باشد.[۲۳۴] دستورالعملهای سازمان ایمنی غذایی اروپا (EFSA) سعی دارند این نیاز را با توصیه به مصرف بالاتر روی برای افرادی که مصرف فیتات بیشتری دارند، جبران کنند.[۲۲۰] این ملاحظات باید در برابر کمبود نشانگرهای زیستی کافی روی متعادل شود، زیرا پرکاربردترین شاخص، روی پلاسمایی، حساسیت و ویژگی ضعیفی دارد.[۲۳۶]
ترمیم خاک
گونههایی از هدر معمولی, خلنگ و سیاهگیله میتوانند در خاکهای حاوی فلز روی رشد کنند، زیرا انتقال یونهای سمی توسط عملکرد قارچهای میکوریزای اریکوئیدی مهار میشود.[۲۳۷]
کشاورزی
کمبود روی به نظر میرسد که رایجترین کمبود ریزمغذی در گیاهان زراعی باشد؛ این کمبود بهویژه در خاکهای با pH بالا شایع است.[۲۳۸] خاکهای کمبود روی در حدود نیمی از اراضی کشاورزی ترکیه و هند، یکسوم چین و بیشتر استرالیا غربی یافت میشود. واکنشهای قابل توجهی به کوددهی روی در این مناطق گزارش شده است.[۶] گیاهانی که در خاکهای کمبود روی رشد میکنند، بیشتر مستعد ابتلا به بیماریها هستند. روی بهطور عمده از طریق فرسایش سنگها به خاک اضافه میشود، اما انسانها روی را از طریق احتراق سوختهای فسیلی، ضایعات معادن، کودهای فسفاته، سموم (فسفید روی), سنگ آهک، کود حیوانی، لجن فاضلاب و ذرات حاصل از سطوح گالوانیزه به خاک میافزایند. روی اضافی برای گیاهان سمی است، هرچند مسمومیت با روی بهطور گستردهتری مشاهده نمیشود.[۶]
Remove ads
ایمنی و احتیاط
خلاصه
دیدگاه
مسمومیت
اگرچه روی یک نیاز اساسی برای سلامتی است، میزان بیش از حد آن میتواند مضر باشد. جذب بیش از حد روی، جذب مس و آهن را سرکوب میکند.[۲۱۵] یون آزاد روی در محلول برای گیاهان، بیمهرگان و حتی ماهیهای مهرهدار سمی است.[۲۳۹] مدل فعالیت یون آزاد بهطور گستردهای در ادبیات علمی شناخته شده است و نشان میدهد که حتی مقادیر مول یون آزاد میتواند برخی ارگانیسمها را بکشد. یک مثال اخیر نشان داد که ۶ میکرومول قادر به کشتن ۹۳٪ از تمام دافنی در آب است.[۲۴۰]
یون آزاد روی یک اسید و باز لوییس قوی است تا جایی که باعث خوردگی میشود. اسید معده حاوی هیدروکلریک اسید است که در آن روی فلزی به راحتی حل میشود و کلرید روی خورنده تولید میکند. بلعیدن یک سکه آمریکایی پس از سال ۱۹۸۲ (۹۷٫۵٪ روی) میتواند باعث آسیب به پوشش معده از طریق حلالیت بالای یون روی در محیط اسیدی معده شود.[۲۴۱]
شواهد نشان میدهد که افرادی که روزانه ۱۰۰–۳۰۰ میلیگرم روی مصرف میکنند، ممکن است دچار کمبود مس شوند. یک آزمایش در سال ۲۰۰۷ مشاهده کرد که مردان مسنتر که روزانه ۸۰ میلیگرم مصرف میکردند، بیشتر از افرادی که دارونما مصرف میکردند، به دلیل عوارض ادراری در بیمارستان بستری شدند.[۲۴۲] سطوح ۱۰۰–۳۰۰ میلیگرم ممکن است با استفاده از مس و آهن تداخل داشته باشند یا اثرات منفی بر کلسترول بگذارند.[۲۱۵] میزان روی بیش از ۵۰۰ پیپیام در خاک با جذب دیگر فلزات ضروری مانند آهن و منگنز توسط گیاهان تداخل دارد.[۱۱۳] یک وضعیت به نام لرزش روی یا «لرز روی» میتواند ناشی از استنشاق بخارات روی هنگام لحیمکاری سخت یا جوشکاری مواد گالوانیزه باشد.[۱۴۵] روی یک ماده رایج در کرمهای دندان مصنوعی است که ممکن است بین ۱۷ تا ۳۸ میلیگرم روی در هر گرم داشته باشد. از استفاده بیش از حد این محصولات ممکن است منجر به معلولیت و حتی مرگ شود.[۲۴۳]
سازمان غذا و دارو ایالات متحده آمریکا (FDA) اعلام کرده است که روی میتواند باعث آسیب به گیرندههای عصبی در بینی شود و موجب نابویایی گردد. گزارشهایی از نابویایی در دهه ۱۹۳۰ نیز مشاهده شد زمانی که از ترکیبات روی برای پیشگیری از عفونتهای فلج اطفال استفاده شد که موفقیتآمیز نبود.[۲۴۴] در ۱۶ ژوئن ۲۰۰۹، افدیای دستور به حذف محصولات سرد نوشیدنی داخل بینی حاوی روی از قفسه فروشگاهها داد. FDA اعلام کرد که از دست دادن حس بویایی میتواند تهدیدکننده زندگی باشد زیرا افرادی که حس بویایی آنها آسیبدیده نمیتوانند نشت گاز یا دود را تشخیص دهند و همچنین نمیتوانند بفهمند که آیا غذا خراب شده است یا خیر قبل از خوردن آن.[۲۴۵]
تحقیقات اخیر نشان میدهد که ضدعفونیکننده موضعی پیریدیون روی یک محرک قوی برای پاسخ شوک حرارتی است که ممکن است با القای PARP و بحران انرژی وابسته به آن، به سلامت ژنوم آسیب وارد کند و در سلولهای پوست انسان مانند کراتینوسیتها و ملانوسیتها ایجاد مشکل کند.[۲۴۶]
در سال ۱۹۸۲، ضرابخانه ایالات متحده آمریکا شروع به ضرب سکههای پنی پوشش داده شده با مس اما عمدتاً حاوی روی کرد. سکههای روی خطر مسمومیت با روی را به همراه دارند که میتواند کشنده باشد. یک مورد گزارش شده از مصرف مزمن ۴۲۵ سکه (بیش از ۱ کیلوگرم روی) منجر به مرگ به دلیل سپتیسمی باکتریایی و قارچی دستگاه گوارش شد. بیمار دیگری که ۱۲ گرم روی مصرف کرده بود تنها دچار لتارژی و آتاکسی (عدم هماهنگی شدید حرکات عضلانی) شد.[۲۴۷] چندین مورد دیگر از مسمومیت با روی ناشی از بلع سکههای روی گزارش شده است.[۲۴۸][۲۴۹]
سکهها و دیگر سکههای کوچک گاهی توسط سگها بلعیده میشوند که نیاز به برداشتن اجسام خارجی توسط دامپزشک دارند. محتوای روی برخی سکهها میتواند باعث مسمومیت با روی شود که معمولاً در سگها از طریق کمخونی همولیتیک شدید و آسیب به کبد یا کلیه کشنده است؛ استفراغ و اسهال از علائم ممکن هستند.[۲۵۰] روی در طوطیها بسیار سمی است و مسمومیت میتواند اغلب کشنده باشد.[۲۵۱] مصرف آبمیوههایی که در قوطیهای گالوانیزه نگهداری میشوند، منجر به مسمومیتهای جمعی در طوطیها به دلیل مسمومیت با روی شده است.[۷۰]
Remove ads
جستارهای وابسته
پانویس
- این عناصر از گروههای فلزی متفاوتی هستند. به جدول تناوبی مراجعه کنید.
- یک کمپانی هند شرقی بریتانیا کشتیای حامل زینک تقریباً خالص از شرق را در سال ۱۷۴۵ در سواحل سوئد از دست داد.(Emsley 2001, p. ۵۰۲)
- جریان الکتریکی بهطور طبیعی بین روی و فولاد جریان مییابد، اما در برخی موارد از آندهای خنثی با منبع DC خارجی استفاده میشود.
منابع
کتابشناسی
پیوند به بیرون
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads




![{\displaystyle {2\,\mathrm {ZnS} {}+{}3\,\mathrm {O} {\vphantom {A}}_{\smash[{t}]{2}}{}\mathrel {\xrightarrow {\mathrm {t} {\vphantom {A}}^{o}} } {}2\,\mathrm {ZnO} {}+{}2\,\mathrm {SO} {\vphantom {A}}_{\smash[{t}]{2}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/686cb2d7d73dea23bc0e3431bfab4016d5fd71ed)

![{\displaystyle {\mathrm {ZnO} {}+{}\mathrm {CO} {}\mathrel {\xrightarrow {950{\vphantom {A}}^{o}\mathrm {C} } } {}\mathrm {Zn} {}+{}\mathrm {CO} {\vphantom {A}}_{\smash[{t}]{2}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/ab85d04dfa0b8e0280b72062a5ecbe660fd247b1)
![{\displaystyle {\mathrm {ZnO} {}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {SO} {\vphantom {A}}_{\smash[{t}]{4}}{}\mathrel {\longrightarrow } {}\mathrm {ZnSO} {\vphantom {A}}_{\smash[{t}]{4}}{}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/8dece6d8838ec01b21c572dbe4e3404d47f6aa05)
![{\displaystyle {2\,\mathrm {ZnSO} {\vphantom {A}}_{\smash[{t}]{4}}{}+{}2\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}\mathrel {\longrightarrow } {}2\,\mathrm {Zn} {}+{}\mathrm {O} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}2\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {SO} {\vphantom {A}}_{\smash[{t}]{4}}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/347f94534be68e78b991b2639b79b8b2f91b90a7)
