| n-butane |
|
|
 
Structure et représentations du n-butane. |
| Identification |
| Nom UICPA
|
butane
|
| Synonymes
|
n-butane
diéthyle
méthyléthylméthane.
|
| No CAS
|
106-97-8
|
| No ECHA
|
100.003.136 |
| No CE
|
203-448-7
|
| No RTECS
|
EJ4200000
|
| PubChem
|
7843
|
| SMILES
|
|
| InChI
|
InChI : vue 3D InChI =1/C4H10/c1-3-4-2/h3-4H2,1-2H3 |
| Apparence
|
gaz comprimé liquéfié, inodore, incolore[1].
|
| Propriétés chimiques |
| Formule
|
C4H10 [Isomères]
|
| Masse molaire[2]
|
58,122 2 ± 0,003 9 g/mol
C 82,66 %, H 17,34 %,
|
| Propriétés physiques |
| T° fusion
|
−138,29 °C[3]
|
| T° ébullition
|
−0,5 °C[3]
|
| Solubilité
|
61,2 mg l−1 (eau, 25 °C)[4]
|
| Paramètre de solubilité δ
|
13,9 MPa1/2 (25 °C)[5]
|
| Masse volumique
|
601,1 g l−1 (liquide, −0,5 °C)
2,709 g l−1 (gaz, 0 °C, 1 013 mbar)[3]
équation[6] : 
Masse volumique du liquide en kmol·m-3 et température en kelvins, de 134,86 à 425,12 K.
Valeurs calculées :
0,57324 g·cm-3 à 25 °C.
| T (K) |
T (°C) |
ρ (kmol·m-3) |
ρ (g·cm-3) |
|---|
| 134,86 |
−138,29 |
12,62 |
0,73351 |
| 154,21 |
−118,94 |
12,33412 |
0,7169 |
| 163,89 |
−109,26 |
12,18848 |
0,70843 |
| 173,56 |
−99,59 |
12,04073 |
0,69984 |
| 183,24 |
−89,91 |
11,89073 |
0,69112 |
| 192,91 |
−80,24 |
11,73834 |
0,68227 |
| 202,59 |
−70,56 |
11,5834 |
0,67326 |
| 212,26 |
−60,89 |
11,42572 |
0,6641 |
| 221,94 |
−51,21 |
11,26509 |
0,65476 |
| 231,61 |
−41,54 |
11,10129 |
0,64524 |
| 241,29 |
−31,86 |
10,93405 |
0,63552 |
| 250,96 |
−22,19 |
10,76308 |
0,62558 |
| 260,64 |
−12,51 |
10,58803 |
0,61541 |
| 270,31 |
−2,84 |
10,40851 |
0,60497 |
| 279,99 |
6,84 |
10,22405 |
0,59425 |
|
| T (K) |
T (°C) |
ρ (kmol·m-3) |
ρ (g·cm-3) |
|---|
| 289,67 |
16,52 |
10,03411 |
0,58321 |
| 299,34 |
26,19 |
9,83805 |
0,57182 |
| 309,02 |
35,87 |
9,63507 |
0,56002 |
| 318,69 |
45,54 |
9,42423 |
0,54776 |
| 328,37 |
55,22 |
9,20432 |
0,53498 |
| 338,04 |
64,89 |
8,97383 |
0,52159 |
| 347,72 |
74,57 |
8,73078 |
0,50746 |
| 357,39 |
84,24 |
8,47252 |
0,49245 |
| 367,07 |
93,92 |
8,19533 |
0,47634 |
| 376,74 |
103,59 |
7,89378 |
0,45881 |
| 386,42 |
113,27 |
7,55932 |
0,43937 |
| 396,09 |
122,94 |
7,17716 |
0,41716 |
| 405,77 |
132,62 |
6,71732 |
0,39043 |
| 415,44 |
142,29 |
6,09758 |
0,35441 |
| 425,12 |
151,97 |
3,927 |
0,22825 |
|

|
| T° d'auto-inflammation
|
365 °C[1]
|
| Point d’éclair
|
−60 °C[1]
|
| Limites d’explosivité dans l’air
|
1,8–8,4 %vol[1]
|
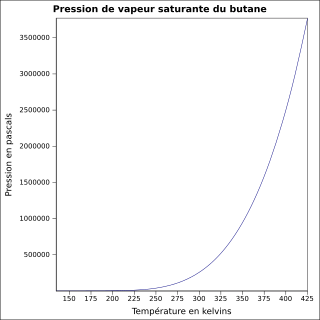
| Pression de vapeur saturante
|
2,081 bar à 20 °C
2,8 bar à 30 °C
4,9 bar à 50 °C[3]
équation[6] : 
Pression en pascals et température en kelvins, de 134,86 à 425,12 K.
Valeurs calculées :
243 680,17 Pa à 25 °C.
| T (K) |
T (°C) |
P (Pa) |
|---|
| 134,86 |
−138,29 |
0,674 |
| 154,21 |
−118,94 |
16,02 |
| 163,89 |
−109,26 |
57,09 |
| 173,56 |
−99,59 |
173,39 |
| 183,24 |
−89,91 |
460,98 |
| 192,91 |
−80,24 |
1 096,03 |
| 202,59 |
−70,56 |
2 370,82 |
| 212,26 |
−60,89 |
4 731,13 |
| 221,94 |
−51,21 |
8 810,3 |
| 231,61 |
−41,54 |
15 455,79 |
| 241,29 |
−31,86 |
25 745,49 |
| 250,96 |
−22,19 |
40 992,9 |
| 260,64 |
−12,51 |
62 741,91 |
| 270,31 |
−2,84 |
92 753,52 |
| 279,99 |
6,84 |
132 987,18 |
|
| T (K) |
T (°C) |
P (Pa) |
|---|
| 289,67 |
16,52 |
185 580,13 |
| 299,34 |
26,19 |
252 827,5 |
| 309,02 |
35,87 |
337 165,82 |
| 318,69 |
45,54 |
441 161,76 |
| 328,37 |
55,22 |
567 507,38 |
| 338,04 |
64,89 |
719 022,71 |
| 347,72 |
74,57 |
898 665,96 |
| 357,39 |
84,24 |
1 109 551,33 |
| 367,07 |
93,92 |
1 354 974,41 |
| 376,74 |
103,59 |
1 638 444,86 |
| 386,42 |
113,27 |
1 963 726,18 |
| 396,09 |
122,94 |
2 334 882,52 |
| 405,77 |
132,62 |
2 756 332,57 |
| 415,44 |
142,29 |
3 232 910,64 |
| 425,12 |
151,97 |
3 769 900
|
|
 |
| Point critique
|
151,85 °C
38,0 bar
0,255 l mol−1[7]
|
| Point triple
|
−138,55 °C
0,007 mbar[7]
|
| Vitesse du son
|
1 034 m s−1 (liquide, −0,5 °C)[8]
|
| Thermochimie |
| S0liquide, 1 bar
|
231 J mol−1 K−1[9]
|
| ΔfH0gaz
|
−125,6 kJ mol−1[10]
|
| ΔvapH°
|
22,389 kJ mol−1 à −1,1 °C[7]
|
| Cp
|
132,42 J mol−1 K−1 (liquide,−3,15 °C)
98,49 J mol−1 K−1 (gaz, 25 °C)[7]
équation[11] : 
Capacité thermique du gaz en J·mol-1·K-1 et température en kelvins, de 200 à 1 500 K.
Valeurs calculées :
100,589 J·mol-1·K-1 à 25 °C.
T
(K) |
T
(°C) |
Cp
 |
Cp
 |
|---|
| 200 |
−73,15 |
75 134 |
1 293 |
| 286 |
12,85 |
97 515 |
1 678 |
| 330 |
56,85 |
108 536 |
1 867 |
| 373 |
99,85 |
118 991 |
2 047 |
| 416 |
142,85 |
129 112 |
2 221 |
| 460 |
186,85 |
139 103 |
2 393 |
| 503 |
229,85 |
148 491 |
2 555 |
| 546 |
272,85 |
157 495 |
2 710 |
| 590 |
316,85 |
166 299 |
2 861 |
| 633 |
359,85 |
174 494 |
3 002 |
| 676 |
402,85 |
182 281 |
3 136 |
| 720 |
446,85 |
189 823 |
3 266 |
| 763 |
489,85 |
196 778 |
3 386 |
| 806 |
532,85 |
203 325 |
3 498 |
| 850 |
576,85 |
209 608 |
3 606 |
|
T
(K) |
T
(°C) |
Cp
 |
Cp
 |
|---|
| 893 |
619,85 |
215 352 |
3 705 |
| 936 |
662,85 |
220 714 |
3 797 |
| 980 |
706,85 |
225 821 |
3 885 |
| 1 023 |
749,85 |
230 460 |
3 965 |
| 1 066 |
792,85 |
234 770 |
4 039 |
| 1 110 |
836,85 |
238 863 |
4 110 |
| 1 153 |
879,85 |
242 581 |
4 174 |
| 1 196 |
922,85 |
246 048 |
4 233 |
| 1 240 |
966,85 |
249 369 |
4 290 |
| 1 283 |
1 009,85 |
252 427 |
4 343 |
| 1 326 |
1 052,85 |
255 339 |
4 393 |
| 1 370 |
1 096,85 |
258 207 |
4 442 |
| 1 413 |
1 139,85 |
260 946 |
4 490 |
| 1 456 |
1 182,85 |
263 666 |
4 536 |
| 1 500 |
1 226,85 |
266 481 |
4 585 |
|
|
| PCS
|
49,4 MJ kg−1[12]
|
| PCI
|
45,6 MJ kg−1[réf. souhaitée]
|
| Propriétés électroniques |
| 1re énergie d'ionisation
|
10,53 ± 0,10 eV (gaz)[13]
|
| Précautions |
| SGH[14],[15] |
  Danger H220 : Gaz extrêmement inflammable
Avec > 0,1 % de butadiène :
H220, H340 et H350H220 : Gaz extrêmement inflammable
H340 : Peut induire des anomalies génétiques (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger)
H350 : Peut provoquer le cancer (indiquer la voie d'exposition s'il est formellement prouvé qu'aucune autre voie d'exposition ne conduit au même danger)
|
| SIMDUT[16] |
 
A, B1, A : Gaz comprimé tension de vapeur absolue à 50 °C = 500 kPaB1 : Gaz inflammable limite inférieure d'inflammabilité = 1,9 % Divulgation à 1,0 % selon la liste de divulgation des ingrédients |
| NFPA 704 |
|
| Transport[3] |
Code Kemler :23 : gaz inflammable Numéro ONU :1011 : BUTANE Classe :2.1 Code de classification :2F : Gaz liquéfié, inflammable ; Étiquette : 2.1 2.1 : Gaz inflammables (correspond aux groupes désignés par un F majuscule); Code Kemler :23 : gaz inflammable Numéro ONU :1075 : GAZ DE PÉTROLE LIQUÉFIÉS ; ou GAZ LIQUÉFIÉS DE PÉTROLE Classe :2.1 Code de classification :2F : Gaz liquéfié, inflammable ; Étiquette : 2.1 2.1 : Gaz inflammables (correspond aux groupes désignés par un F majuscule); Code Kemler :23 : gaz inflammable Numéro ONU :1965 : HYDROCARBURES GAZEUX EN MÉLANGE LIQUÉFIÉ, N.S.A. Classe :2.1 Code de classification :2F : Gaz liquéfié, inflammable ; Étiquette : 2.1 2.1 : Gaz inflammables (correspond aux groupes désignés par un F majuscule); |
| Écotoxicologie |
| LogP
|
2,89[1]
|
| Seuil de l’odorat
|
bas : 1 262 ppm
haut : 5 048 ppm[17]
|
|
| Unités du SI et CNTP, sauf indication contraire. |
| modifier |


















