Top Qs
Chronologie
Chat
Contexte
Cérium
élément chimique de numéro atomique 58 et de symbole Ce De Wikipédia, l'encyclopédie libre
Remove ads
Le cérium est un élément chimique, de symbole Ce et de numéro atomique 58. Il fait partie de la famille des lanthanides.
Remove ads
Historique
Le cérium[a] a été identifié en 1803 par Martin Heinrich Klaproth et pratiquement en même temps par Jöns Jacob Berzelius et Wilhelm Hisinger. Son nom fait référence à la planète naine « Cérès » découverte en janvier 1801[6]. En 1825, il a été obtenu par Carl Gustav Mosander pour la première fois à l'état raisonnablement pur.
Isotopes
Le cérium naturel est composé de quatre isotopes : 136Ce, 138Ce, 140Ce et 142Ce.
Propriétés

Le cérium est un métal gris, le plus abondant du groupe des terres rares (abondance dans la nature de 48 ppm[7]).
À température ambiante, il est malléable et s'oxyde rapidement à l'air.
Propriétés chimiques
Comme les autres lanthanides, le cérium métal est un agent réducteur, ayant un potentiel de réduction standard de E⦵ = −2,34 V pour le couple Ce3+/Ce[8]. Il ternit à l'air, formant une couche d'oxyde passivante comme la rouille de fer. Un échantillon de un centimètre cube de cérium métallique se corrode complètement en environ un an. De façon plus spectaculaire, le cérium métallique peut être hautement pyrophorique[9] :
- Ce + O2 → CeO2
Étant hautement électropositif, le cérium réagit avec l'eau. La réaction est lente avec de l'eau froide mais s'accélère lorsque la température s'accroît, produisant de l'hydroxyde de cérium(III) et de l'hydrogène gazeux[10] :
- 2 Ce + 6 H2O → 2 Ce(OH)3 + 3 H2
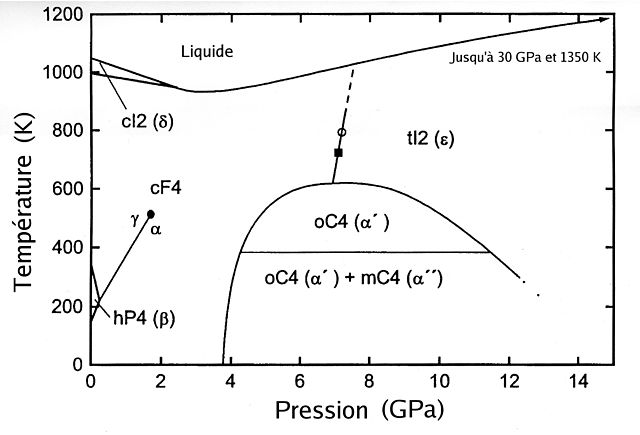
Phases du cérium pur
Résumé
Contexte
| Découvertes des terres rares. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diagrammes des découvertes des terres rares. Les dates entre parenthèses sont les dates d'annonces des découvertes[11]. Les branches représentent les séparations des éléments à partir d'un ancien (l'un des nouveaux éléments conservant le nom de l'ancien, sauf pour le didyme). |
Remove ads
Utilisations
- Pierre à briquet : le cérium entre dans la composition du mischmétal, base des pierres à briquet.
- Polissage du verre : le dioxyde de cérium (CeO2) est l'une des meilleures poudres de polissage du verre.
- Protection contre l'ionisation : les verres dopés à l'oxyde de cérium sont protégés contre l'effet de solarisation du rayonnement ultraviolet et la radioactivité qui provoquent un effet d'ionisation et brise les liaisons pontantes Si-O.
- Pots d'échappement : il est utilisé afin de diminuer les émissions nocives des moteurs Diesel (filtre à particules).
- Fours : il est utilisé (oxyde) dans le revêtement des fours « auto-nettoyants ».
- Elément d'alliage pour l'aluminium : les alliages d'aluminium contenant notamment du cérium sont notamment utilisés pour obtenir des alliages hautes performances (en particulier en termes de résistance à la rupture) adaptés à la fabrication additive[12].
- Manchon à incandescence : l'oxyde de cérium est imprégné dans une gaine de tissu combustible utilisée dans les lampes à pétrole sous pression, sous l'effet de la chaleur celui-ci brille fortement.
- Autres utilisations : utilisé comme colorant du verre, dans les luminophores pour tubes cathodiques et également pour améliorer l'absorption des rayons X par la dalle des mêmes tubes.
Remove ads
Usage médical
Le cérium est utilisé sous forme de nitrate de cérium (en) (quelques pourcents) dans certaines crèmes[b] ou dans des pansements (associé à la sulfadiazine argentique) pour soigner les brûlures graves[13]. En réaction au cérium, l'organisme produit des calcifications superficielles qui diminuent les possibilités de colonisation bactérienne et préviennent « la formation d’un tissu de granulation (limitation de la cicatrisation hypertrophique) dans les brûlures »[13].
Inoculé dans l'organisme, comme d'autres substances étrangères non dégradables, il peut induire un granulome ou une sarcoïdose, plus ou moins marquée selon le statut immunitaire de l'individu[13].
Remove ads
Toxicité, écotoxicité
Résumé
Contexte
Elles sont mal connues (écotoxicité surtout),
- l'IRSN a produit une fiche pédagogique sur le radioisotope[14].
- Dans un cas au moins, une patiente soignée par un pansement contenant de l'argent et du cérium après une brûlure grave a présenté une granulomatose au cérium[13].
- Les nanoparticules de dioxyde de cérium (NP CeO2) figurent dans la liste prioritaire des nanomatériaux manufacturés de l'OCDE devant faire l'objet d'une évaluation écotoxicologique. Des larves de chironome (Chironomus riparius) ont été exposées à des taux de 2,5, 25, 250 et 2500 mg de CeO2 NP/kg de sédiments ; l'absorption du produit (larves vivant dans le sédiment), le stress oxydatif, les effets génotoxiques in vivo et quelques autres paramètres biologiques ont été étudiés : on n'a pas détecté de mortalité significative chez C. riparius ni de signes de stress oxydant mais elle a montré que la larve absorbe ce produit et qu'il est génotoxique (dès avant 25 mg/kg de sédiments, et de manière corrélée à la concentration. Ce moustique n'est pas mis en danger aux doses environnementales attendues, mais « l'accumulation importante de NP de CeO2 par les larves de chironomidés peut présenter un risque par transfert trophique vers des organismes plus en amont de la chaîne alimentaire » concluent les auteurs [15]
Remove ads
Notes et références
Voir aussi
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads



