Complexo promotor da anafase
From Wikipedia, the free encyclopedia
Remove ads
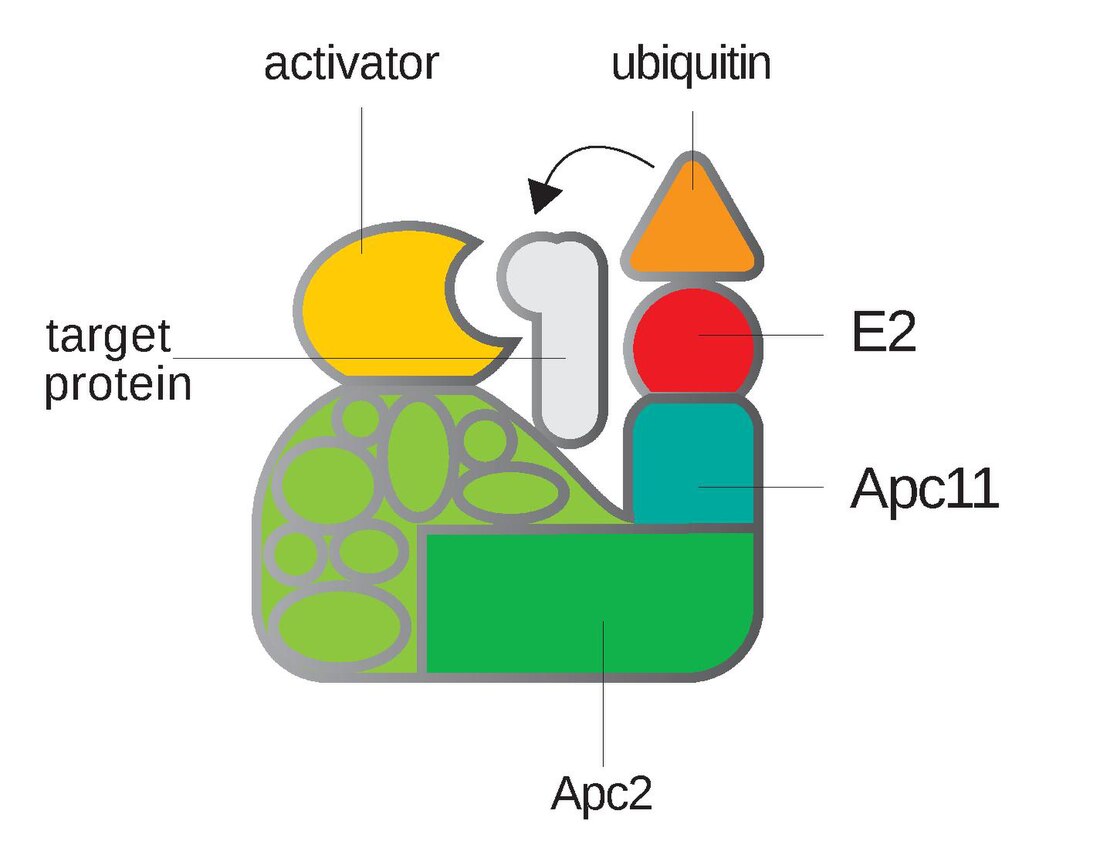
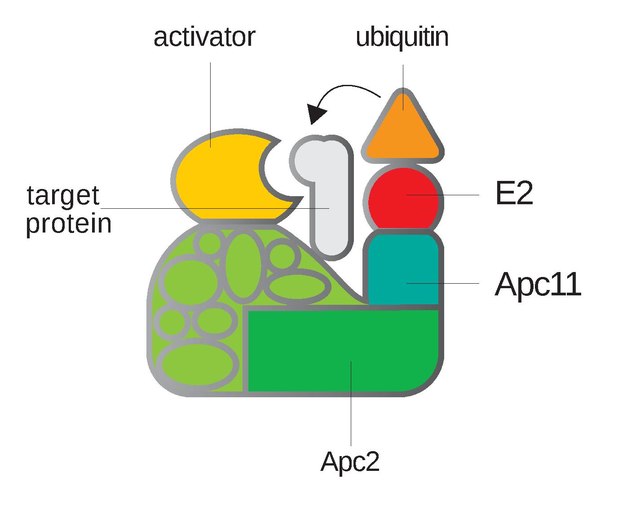
O complexo promotor da anafase ou ciclosoma, tamén chamado, polas súas siglas en inglés, APC ou APC/C (Anaphase-Promoting Complex/Cyclosome), é unha ubiquitina ligase E3 que marca proteínas diana do ciclo celular para a súa degradación no proteosoma de 26S. O APC/C é un complexo grande de 11 a 13 proteínas subunidade, entre as cales están unha culina (Apc2) e a subunidade RING (Apc11) similar ao SCF. Outras partes do APC/C teñen funcións descoñecidas mais están altamente conservadas.[1]
Para outras páxinas con títulos homónimos véxase: APC.
O descubrimento do APC/C (e do SCF) e o seu papel clave na regulación do ciclo celular eucariota estableceu a importancia da proteólise mediada pola ubiquitina na bioloxía celular. A ubiquitinación e a subseguinte degradación de proteínas polo proteosoma, unha vez que foi percibida como un sistema exclusivamente implicado en eliminar proteínas danadas da célula, é agora considerado un mecanismo regulatorio universal para a transdución de sinais, cuxa importancia se aproxima á da fosforilación de proteínas.
En 2014, mapouse o APC/C en 3D a unha resolución de menos dun nanómetro, o cal tamén serviu para decubrir a súa estrutura secundaria. Este descubrimento podería mellorar a nosa comprensión do cancro e revelar novos sitios de unión para futuros fármacos contra o cancro.[2][3]
Remove ads
Función

A principal función do APC/C é desencadear a transición desde a metafase á anafase ao etiquetar proteínas específicas para a súa degradación. As tres maiores dianas para a degradación do APC/C son a securina e as ciclinas S e M. A securina libera a separase, unha protease, cando se degrada. Despois, a separase desencadea o corte ou clivaxe da cohesina, o complexo proteico que une as cromátides irmás. Durante a metafase, as cromátides irmás están ligadas entre si por complexos de cohesina intactos. Cando a securina sofre ubiquitinación pola APC/C e libera a separase, a cal degrada a cohesina, as cromátides irmás quedan libres para moverse a polos opostos do fuso na anafase. O APC/C tamén ten como diana as ciclinas mitóticas para a súa degradación, o que ten como resultado a inactivación dos complexos M-CDK (quinase dependente de ciclina mitótica), promovendo a saída da mitose e a citocinese.[1]
A diferenza do SCF, unha serie de subunidades activadoras controlan o APC/C. Cdc20 e Cdh1 son dous activadores de especial importancia para o ciclo celular. Estas proteínas desencadean o APC/C contra conxuntos específicos de substratos en diferentes momentos do ciclo celular, o que fai que o ciclo avance. O APC/C tamén exerce un papel integral no mamtemento do metabolismo da cromatina, especialmente nas fases G1 e G0, e xoga un papel clave na fosforilación da histona H3 por medio da destrución da aurora A quinase.[4]
Os substratos críticos do APC/C parecen ser a securina e as ciclinas de tipo B. Isto está conservado entre os mamíferos e os lévedos. De feito, un lévedo é viable en ausencia do APC/C se se elimina a necesidade de atacar eses substratos.[5]
Remove ads
Subunidades
Non hai unha gran cantidade de investigacións sobre as subunidades do APC/C, que funcionan principalmente como adaptadores. Os estudos das subunidades do APC realízanse principalmente en lévedos, e ditos estudos mostran que a maioría das subunidades do APC de lévedos están tamén presentes en vertebrados; isto suxire a conservación das subunidades nos eucariotas. En vertebrados atopáronse once subunidades centrais do APC e trece en lévedos.[1] As subunidades activadoras únense ao APC en varios estadios do ciclo celular para controlaren a súa actividade de ubiquitinación, a miúdo ao dirixiren o APC contra os substratos diana destinados á ubiquitinación. Propúxose que a especificidade das APC ligases está controlada pola incorporación de factores de especificidade no complexo da ligase, en vez de pola fosforilación de substrato. A subunidade CDC20 permite que o APC degrade substratos como os inhibidores da anafase (Pdsp1) ao principio da anafase; por outra parte cando o CDC20 está substituído polo factor de especificidade Hct1, o APC degrada un conxunto diferente de substratos, particularmente as ciclinas da mitose na anafase tardía. Os activadores CDC20 e Cdh1 son de especial importancia e son as subuniddes máis amplamente estudadas e habituais do APC/C.
O centro catalítico do APC/C consiste na subunidade culina Apc2 e a subinidade de dominio RING H2 Apc11. Estas dúas subunidades catalizan a ubiquitinación de substratos cando o dominio C-terminal da Apc2 forma un complexo fortemente unido coa Apc11. O RING/APc11 únese ao conxugado E2-ubiquitina que cataliza a tansferencia da ubiquitina a un sitio activo de E2.[1] Ademais da funcionalidade catalítica, outras proteínas do corazón do complexo APC están compostas por múltiples motivos repetidos co propósito principal de proporcionar un soporte de armazón molecular. Estas inclúen a Apc1, a subunidade máis grande que contén 11 repeticións en tándem de secuencias de 35-40 aminoácidos, e a Apc2, que contén tres repeticións de culina de aproximadamente 130 aminoácidos en total.[6] Os principais motivos nas subunidades do APC inclúen motivos tetratricopéptido (TPR) e repeticións WD40.[1] As rexións C-terminal de CDC20 e Cdh1 teñen un dominio WD40 que se suxire forma unha plataforma de unión que se une a substratos do APC, contribuíndo así á capacidade do APC de atacar estes substratos, aínda que se descoñece o mecanismo exacto polo cal se produce este incremento da actividade do APC.[7] Tamén suxeriu que as variacións nestes dominios WD40 resultan en variacións na especificidade de substrato, o cal se confirmou en estudos recentes que indican que diferentes substratos do APC poden unirse de forma directa e específica a Cdc20 e Cdh1/Hct1. Finalmente, as diferenzas de especificidade son responsables da orde e momento de destrución de varias dianas do APC durante da mitose, de modo que CDC20 ataca uns poucos substratos principais na metafase e Cdh1 ataca un conxunto máis amplo de substratos na mitose tardía e fase G1.[8]
As 4 subunidades do APC/C de lévedos constan enteiramente de repeticións múltiples do motivo tetratricopéptido (TPR) de 34 residuos de aminoácidos. Estas subunidades TPR, Cdc16,[9] Cdc27,[10] Cdc23 e Apc5, proporcionan principalmente un armazón e soporte ás interaccións proteína-proteína mediadas por outros. O Cdc27 e o Cdc23 apoian a unión de Cdc20 e Cdh1, xa que as mutacións en residuos clave destas subunidades causan un incremento da disociación dos activadores. O Apc10/Doc1 promove a unión ao substrto ao mediar nas súas interaccións con Cdh1 e Cdc20.[11]
En concreto, CDC20 (tamén chamdo p55CDC, Fizzy ou Slp1) inactiva CDK1 por ubiquitinación de ciclinas de tipo B. Isto ten como resultado a activación de Cdh1 (tamén chamado relacionado con Fizzy, Hct1, Ste9 ou Srw1), que interacciona co APC durante a mitose tardía e a G1/G0. A Cdh1 é inactivada por fosforilación durante as fases S, G2 e a fase M temperá. Durante estes momentos do ciclo, non se pode ensamblar.[12]
APC3 e APC7 serven para recrutar Cdh1 no complexo promotor da anafase.[13] Isto apoia tamén que a Cdh1 é a responsable de manter a actividade do APC durante G1. A Cdh1 non necesita o APC para ser fosforilada e poder unirse, de feito, a fosforilación de Cdh1 por Cdks impídelle unirse ao APC desde a fase S á M. Coa destrución de M-Cdk, poden producirse agora a liberación de CDC20 do APC e a unión de Cdh1, permitindo que a actividade do APC continúe durante a entrada a G1.[1] Mentres que a Cdh1 recoñece as ciclinas M e S, permitindo a súa destrución ata que toda a célula queda determinada para avanzar a un novo ciclo, non recoñece as ciclinas G1/S, e durante a fase G1/S, a actividade das ciclina pode aumentar sen obstáculo e fosforilan, e dese modo inactivan, a Cdh1 e, polo tanto, o APC.
A subunidade Apc15 xoga un papel importante na activación do APC/CCdc20 despois da biorientación de cromátides irmás na placa metafásica. Cando os cinetocoros non están unidos ao fuso, os complexos do punto de control da mitose (MCC) inhiben o APC. En ausencia de Apc15, MCCs e Cdc20 permanecen bloqueados no APC/C impedindo a súa acividade unha vez que se cumpren os requirimentos do punto de control do fuso. A Apc15 media no recambio de Cdc20 e MCCs para proporcionar información sobre o estado de unión dos cinetocoros.[14]
CDC27/APC3
Unha das subunidades que presenta o motivo TPR, a CDC27, comprobouse que interacciona con proteínas do punto de control da mitose, como Mad2, p55CDC e BUBR1, o que indica que pode estar implicada na sincronización de eventos na fase M.[15] Hai probas que sinalan que a CDC27 forma parte dun complexo ternario con SMAD2/3 e Cdh1, que se crea en resposta á sinalización de TGFβ. Debido á súa interacción con Cdh1 en particular, ten un posible papel na determinación da afinidade entre o APC e os seus activadores Cdc20 e Cdh1. Un estudo suxire que a fosforilación de Cdc27 inducida polo TGF-β mellora a interacción entre Cdc27 e Cdh1, que está directamente implicada na activación do APC.[16] A CDC27 pode funcionar como un vehículo a través do cal a sinalización de TGFβ pode activar o APC. A hiperfosforilación de CDC27 inducida por TGFβ xera unha elevada actividade do APC.
CDC23, CDC16, CDC27
A CDC23, outra subunidade con TPR interacciona con SWM1, uníndose á caixa D de CLB2. Baseándose en ensaios de híbridos in vivo e coinmunoprecipitación in vitro, suxeriuse que Cdc16p, Cdc23p e Cdc27p (análogos en Saccharomyces cerevisiae) interaccionan e forman un complexo macromolecular. Sinalouse que o seu tema común de TPR media nestas interaccións.[17] En canto Cdc27 e Cdc16 en Drosophila, testáronse as súas funcións por interferencia de ARN (RNAi).[18] Os resultados suxiren que poden mediar na actividade do complexo enteiro por mecanismos diferentes en sitios distintos. Noutros estudos nas moscas drosófilas, Cdk16 e Cdk23 parecen activarse por fosforilación realizada pola quinase similar a Polo 1 (Plk1), e a molécula correspondente de lévedos de fisión parece unirse especialmente a Cdc23.[19]
O complexo está regulado polos activadores CDC20 e Cdh1 durante a mitose. O seu papel na degradación da ciclina B está demostrado por un cribado de mutantes de Saccharomyces cerevisiae defectivos para a degradación de ciclina B, que teñen mutacións nos xenes CDC16 e CDC23. Nos mutantes para CDC27, CDC23 e CDC 27 prodúcese en todos os casos a detención do ciclo celular na metafase.[20]
Remove ads
Recoñecemento de substrato
Os substratos do APC/C teñen secuencias de aminoácidos de recoñecemento que permiten que o APC/C os identifique. A secuencia máis común é coñecida como "caixa de destrución" ou caixa D (D-box). O APC/C xúntase a un encima conxugante da ubiquitina E2 e a caixa D en lugar de ser un transportador de intermediario covalente.[21] A caixa D debería ter unha versión da seguinte secuencia de aminoácidos: RXXLXXXXN, onde R é arxinina, X é calquera aminoácido, L é leucina e N é asparaxina. A caixa KEN (ou Ken) é outro motivo de importancia. A súa secuencia debería lembrar a seguinte: KENXXXN, onde K é lisina e E é glutamato. O aminoácido na última posición na caixa KEN é moi variable. Se ben se demostrou que as mutacións nas secuencias inhiben a destrución das proteínas in vivo, aínda queda moito por aprender sobre como se une o APC/C a proteínas específicas.[1]
Unha vez unidas ao APC/C, as proteínas Cdc20 e a Cdh1 funcionan como receptores das caixas D e KEN para varios substratos do APC. Kraft et al. mostraron que as caixas D dos substratos se unen directamente á rexión propulsor (propeller) de repeticións WD40 altamente conservadas nos activadores do APC. É importante salientar que a área conservada do propulsor de Cdh1 é moito máis grande que a de Cdc20, o que permite a Cdh1 ter unha especificidade de substrato máis ampla, o que é consistente co feito de que a APC/CCdh1 tamén activa a destrución mediada polo APC de substratos que conteñen a caixa KEN. A caixa D potencia adicionalmente a degradación de proteínas, xa que os residuos de lisina moi próximos á caixa D serven como dianas de ubiquitilación. Atopouse que un residuo de lisina en posición inmediatamente C-terminal respecto á caixa D pode funcionar como aceptor da ubiquitina.[22]
Moitos substratos do APC conteñen tanto caixas D coma KEN, e a súa ubiquitilación por APC/CCdc20 ou APC/CCdh1 é dependente de ambas as secuencias, aínda que algúns substatos conteñen só caixa D ou caixa KEN, nunha ou en múltiples copias. Ter dúas secuencias de degadación distintas crea un alto nivel de especificidade de substrato no APC/C, sendo o APC/CCdc20 máis dependente da caixa D e o APC/CCdh1 máis dependente da caixa KEN. Por exemplo, APC/CCdh1 pode ubiquitilar substratos que conteñen só a caixa KEN, como Tome-1 e a sororina.[6]
Aínda que Cdc20 e Cdh1 poden servir como receptores das caixas D e KEN, a baixa afinidade destas interaccións coactivador–substrato suxire que é improbable que os coactivadores por si sós sexan suficientes para proporcionar unha alta afinidade de unión do substrato a APC/CCdc20 e APC/CCdh1.[6] En consecuencia, as subunidades centrais do APC/C, como Apc10, contribúen tamén á asociación co substrato. En construtos do APC/C que carecían da subunidade Apc10/Doc1, substratos como Clb2 non podían asociarse con APCΔdoc1–Cdh1, mentres que a adición de Doc1 purificado ao constructo APCΔdoc1–Cdh1 restauraba a capacidade de unión ao substrato.[11]
Remove ads
Transición da metafase á anafase
Cando comeza a metafase, o punto de control do fuso inhibe o APC/C ata que todos os cinetocoros irmáns están unidos a polos opostos do fuso mitótico, un proceso chamado biorientación dos cromosomas. Cando todos os cinetocoros están debidamente unidos, o punto de control do fuso é silenciado e o APC/C pode activarse. As M-Cdks fosforilan subunidades no APC/C que promoven a unión a Cdc20. A securina e as ciclinas M (ciclinas A e B) son atacdas por APC/CCdc20 para a súa degradación. Unha vez degradados, libérase a separina, a cohesina é degradada e as cromátides irmás están preparadas para moverse aos seus respectivos polos na anafase.[1]
Nas células animais, é probable que polo menos ocorra algunha activación de APC/CCdc20 cedo no ciclo celular (profase ou prometafase) baseándose no momento da degradación dos seus substratos. A ciclina A degrádase cedo na mitose, o que apoia esta teoría, mais a ciclina B e a securina non se degradan ata a metafase. As bases moleculares deste atraso non se coñecen, pero crese que son a clave para unha correcta sincronización do inicio da anafase. En células animais, o sistema do punto de control do fuso contribúe ao atraso se cómpre corrixir a biorientación dos cromosomas. Porén, non se coñece a forma en que o sistema do punto de control do fuso inhibe a destrución da ciclina B e da securina mentres que permite que a ciclina A sexa degradada. O atraso pode tamén explicarse por interaccións descoñecidas con reguladores, localización e cambios na fosforilación.[1]
Isto inicia un bucle de retroalimentación negativa. Aínda que para a activación de APC/CCdc20 cómpre M-Cdk, o complexo é tamén responsable de romper a ciclina para desactivar M-CdK. Isto significa que APC/CCdc20 promove a súa propia desactivación. É posible que esta retroalimentación negativa sexa a columna vertebral da actividade de Cdk controlada polas oscilacións das concentracións de ciclinas M e S.[1]
Remove ads
Transición da fase M á G1
Unha vez completada a mitose, é importante que as células (agás as do embrión) experimenten un período de crecemento, coñecido como fase G1, para creceren e produciren os factores necesarios para o seguinte ciclo celular. A entrada noutra rolda de mitose impídese inhibindo a actividade das Cdk. Aínda que diferentes procesos son os responsables desta inhibición, un importante é a activación do APC/C pola Cdh1. Esta activación continuada impide a acumulación de ciclinas que desencadearían outra rolda da mitose e, ao contrario, impulsa a saída da mitose.[1]
Ao principio do ciclo celular, Cdh1 é fosforilada por M-Cdk, impedíndolle que se una ao APC/C. Despois, o APC/C é libre de unirse a Cdc20 e guiar a transición da metafase á anafase. A medida que M-Cdk se degrada na parte final da mitose, a Cdc20 queda liberada e a Cdh1 pode unirse ao APC/C, manténdoo activado durante a transición á M/G1. Unha diferenza clave é que mentres que a unión de Cdc20 ao APC/C depende da fosforilación do APC/C polas Cdks mitóticas, a unión de Cdh1 non. Así, cando APCCdc20 queda inactivado durante a metafase debido á desfosforilación resultante da inactivación das Cdks mitóticas, a Cdh1 pode unirse inmediatamente ao APC/C, ocupando o lugar de Cdc20. A Cdc20 é tamén unha diana de APC/CCdh1, asegurando que APC/CCdc20 deixa de funcionar. Despois, APC/CCdh1 continúa traballando en G1 para etiquetar as ciclinas S e M para a súa destrución. Porén, as ciclinas de G1/Sr non son substratos de APC/CCdh1 e, polo tanto, acumúlanse durante esta fase e fosforilan a Cdh1. Na fase G1 tardía, acumulouse unha cantidade suficiente de ciclinas de G1/S e de Cdh1 fosforilada para inactivar o APC/C ata a seguinte metafase.[1]
Unha vez en G1, APCCdh1 é responsable da degradación de varias proteínas que promoven a correcta progresión do ciclo celular. A xeminina é unha proteína que se une a Cdt1, o cal impide a súa unión ao complexo de recoñecemento da orixe (ORC). APCCdh1 actúa sobre a xeminina para a ubiquitinación ao longo da G1, mantendo os seus niveis baixos. Isto permite que a Cdt1 leve a cabo a súa función durante a ensamblaxe pre-RC. Cando APCCdh1 queda inactiva debido á fosforilación de Cdh1 polas ciclinas de G1/S, a actividade da xeminina increméntase outra vez. Ademais, a Dbf4 estimula a actividade de Cdc7, o cal promove a activación das orixes de replicación. Pénsase que APCCdh1 ten como diana a Dbf4 para destruíla. Isto podería proporcionar unha resposta a como se activa Cdc7 ao principio dun novo ciclo celular. A súa actividade probablemente corresponde coa inactivación de APC/CCdh1 polas ciclinas de G/S.[1]
Remove ads
Regulación adicional
A inactivación da APC/CCdc20 durante as etapas iniciais do ciclo celular conséguese parcialmente pola acción da proteína Emi1. Os experimentos iniciais mostraron que a adición de Emi1 a extractos do ciclo de Xenopus poden impedir a destrución das ciclinas endóxenas A e B e a saída da mitose, o que suxire que Emi1 pode contrarresta a actividade do APC. Ademais, a depleción de Emi1 en células somáticas leva a unha falta de acumulación de ciclina B. A falta de Emi1 probablemente leva a unha carencia de inhibición do APC impedindo que se acumule a ciclina B.[23]
A partir destas observacións iniciais, foi confirmado que en G2 e no inicio da mitose, Emi1 únese e inhibe a Cdc20 ao impedir a súa asociación con substratos do APC. A Cdc20 pode aínda ser fosforilada e únese ao APC/C, pero a unión de Emi1 bloquea a interacción de Cdc20 con dianas do APC.[1] A asociación de Emi1 con Cdc20 permite a estabilización de varias ciclinas a través das fases S e G2, pero a retirada de Emi1 é esencial para a progresión a través da mitose. Así, na profase tardía, Emi1 é fosforilada pola quinase similar a Polo (Plk). A Plk actívase durante o inicio da mitose pola acción de Cdk1, e a fosforilación que realiza de Emi1, a unión a βTrCP e a ubiquitinación, fai Emi1 que sexa unha diana para o SCF, o que leva a súa subseguinte destrución en prometafase.[24] A destrución de Emi1 leva a activación de APC/CCdc20, permitindo a destrución da ciclina A no inicio da mitose. Os niveis de Emi1 empezan a elevarse outra vez na fase G, que axuda a inhibir a APC/CCdh1.[1]
A regulación da actividade da APC/CCdc20 sobre substratos da metafase como a securina e a ciclina B pode ser un resultado da localización intracelular. Hipotetízase que as proteínas do punto de control do fuso que inhibe a APC/CCdc20 soamente se asocia cun subconxunto da poboación de moléculas de Cdc20 localizada preto do fuso mitótico. Desta maneira, a ciclina A pode ser degradada mentres que a ciclina B e a securina soamente son degradadas unha vez que as cromátides irmás conseguiron a biorientación.[1]
Remove ads
Notas
Véxase tamén
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads