Nitrozocsoport
From Wikipedia, the free encyclopedia
Remove ads
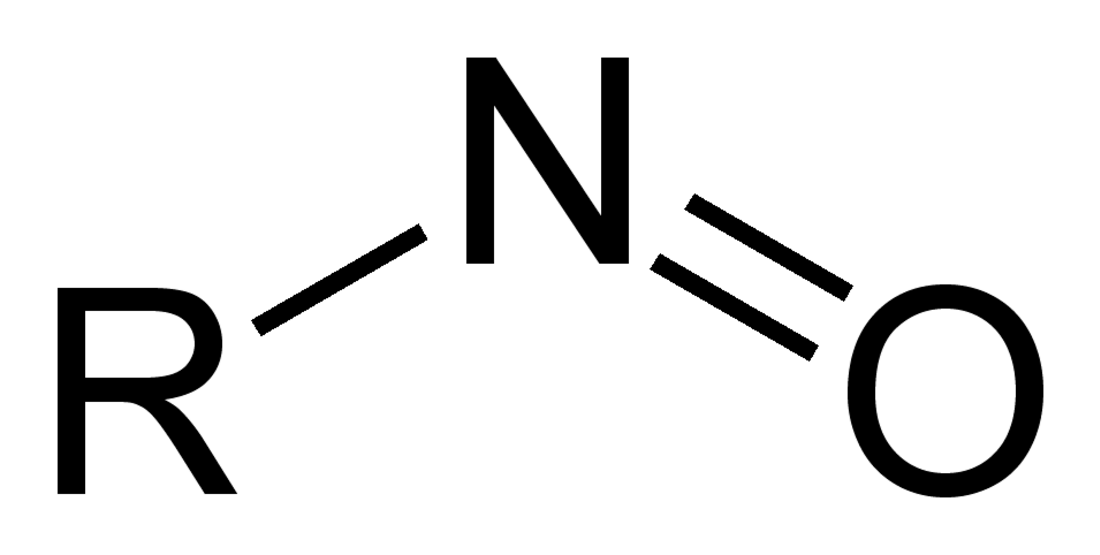
A nitrozocsoport szerves kémiai funkciós csoport, a nitrozovegyületekben −NO csoport kapcsolódik a szerves lánchoz. Aszerint, hogy milyen atomhoz kapcsolódik, megkülönböztetünk C-nitrozo vegyületeket (pl. nitrozoalkánok: R−N=O), S-nitrozo vegyületeket (nitrozotiolok: RS−N=O), N-nitrozo vegyületeket (például nitrózaminokat: R1N(−R2)−N=O) és O-nitrozo vegyületeket (alkil-nitritek: RO−N=O).

Remove ads
Előállításuk
Nitrovegyületek redukciójával[1] vagy hidroxil-aminok oxidációjával állíthatók elő.[2] A Baudisch-reakcióval orto-nitrozofenolok nyerhetők. A Fischer–Hepp-átrendeződés során nitrózaminok a megfelelő aromás 4-nitrozoanilinekké konvertálhatók.
Tulajdonságaik

A nitrozoarének többnyire monomer-dimer egyensúlyban vannak. A – többnyire halványsárga – dimerek szilárd fázisban általában túlsúlyban vannak, míg a sötétebb monomerek híg oldatokban vagy magasabb hőmérsékleten kerülnek nagyobb arányba. Cisz- és transz-izomerjeik léteznek.[4]
A nitrogén-monoxid gyök stabil volta miatt a szerves nitrozovegyületek esetén általában nagyon kicsi a C−N kötés disszociációs energiája: a nitrozoalkánok esetén ez nagyságrendileg 30–40 kcal/mol, a nitrozoaréneknél 50–60 kcal/mol. Ennek következtében ezek a vegyületek általában hő- és fényérzékenyek. Az O−(NO) vagy N−(NO) kötést tartalmazó molekulák kötés disszociációs energiája jellemzően még kisebb. Például az N-nitrozodifenilamin (Ph2N−N=O) N−N kötés disszociációs energiája csak 23 kcal/mol.[5] A szerves nitrozovegyületek átmenetifémek ligandumaként szolgálhatnak.[6]
Remove ads
Reakcióik
Sok reakciót ismerünk, amelyben köztitermékként nitrozovegyület szerepel, ilyen például a Barton-reakció és a Davis–Beirut-reakció, valamint az indolok előállítására használt Baeyer–Emmerling és Bartoli-féle indolszintézis.
Nitrozálás és nitrozilálás
A fizikai-kémia környezettől függően a nitritek kétféleképpen reagálhatnak.
- A nitrozilálás (nitroziláció) során fémre (pl. vasra) vagy tiolra nitrozilion (NO−) addícionál, így nitrozil-vas (Fe−NO, pl. nitrozilált hem = nitrozilhem) vagy S-nitrozotiol (RSNO) keletkezik.
- A nitrozálás (nitrozáció) során nitrozóniumion (NO+) addícionál aminra (−NH2), nitrózamin keletkezése közben. Ez az átalakulás savas pH-n következik be, különösen a gyomorban, amint az alábbi – az N-fenilnitrózamin kialakulását leíró – egyenlet is mutatja:
- NO−2 + H+ ⇌ HONO
- HONO + H+ ⇌ H2O + NO+
- C6H5NH2 + NO+ → C6H5N(H)NO + H+
Számos primer alkil-N-nitrozovegyület – például a CH3N(H)NO – hajlamos alkohollá történő hidrolízisre. A szekunder aminok származékai – például a dimetil-aminból keletkező (CH3)2NO – jóval stabilabbak. Ezek azok az N-nitrózaminok, amelyek rákkeltő hatásúak a rágcsálókban.
Remove ads
Nitrozil a szervetlen kémiában

A nitrozilek olyan NO csoportot tartalmazó szervetlen vegyületek, amelyekben a fém közvetlenül a nitrogénatomhoz kapcsolódva fém−NO egységet alkot. Egy másik, nemfémet tartalmazó példa az ismert reagens, a nitrozil-klorid (Cl−N=O). A nitrogén-oxid stabil gyök, egy párosítatlan elektronja van. Redukciójával hiponitrit anion, NO− keletkezik:
- NO + e− → NO−
A NO oxidációja NO+ nitrozónium kationt eredményez:
- NO → NO+ + e−
A nitrogén-oxid ligandumként fém-nitrozil komplexeket, más néven fém-nitrozilokat képezhet. Ezek a komplexek NO+, NO− vagy valamilyen köztes részecske adduktumának tekinthetők.
Élelmiszerekben

Az élelmiszerekben és a béltraktusban a nitrozálás és a nitrozilálás a fogyasztó egészségére nem mindig azonos hatású.
- Pácolt húsokban: A pácolással feldolgozott hús nitritet tartalmaz, és pH-ja kb. 5, qhol majdnem minden nitrit NO−2 formájában van jelen (99%). A pácolt húshoz nátrium-aszkorbátot (vagy eritorbátot vagy C-vitamint) adnak. Az aszkorbát gátolja az aminok – nitrózaminná történő – nitrozálását, mert az aszkorbát a NO−2-tel NO képződése közben reagál.[7] Az aszkorbát és az 5-ös pH ezért a hem vas nitrozilálásának kedvez, amikor is nitrozilhem keletkezik, mely a mioglobin belsejében vörös színű pigment, a főzés közben szabaddá válva azonban rózsaszínű. A nitrozilhem hozzájárul a pácolt hús „szalonna ízéhez”, ezért a húsipar és a fogyasztó szempontjából is előnyösnek tartják.[8]
- Gyomorban: a kiválasztott hidrogén-klorid savas környezetet teremt (pH=2), és a(z étellel vagy nyállal) bevitt nitrit az aminok nitrozálásához vezet, ami nitrózaminokat (potenciális karcinogéneket) eredményez. A nitrozálás mértéke csekély, ha az aminkoncentráció kicsi (pl. fehérjeszegény étrend, erjesztetlen ételek) vagy ha a C-vitamin koncentráció nagy (pl. gyümölcsben gazdag étrend). Ilyenkor pH 2-n stabil S-nitrozotiolok képződnek.
- Vastagbélben: a semleges pH nem kedvez a nitrozálásnak. A székletben nem keletkezik nitrózamin, még szekunder amin vagy nitrit hozzáadása után sem.[9] A semleges pH kedvez az S-nitrozotiolból történő NO− felszabadulásnak, valamint a vas nitrozilálásának.
A korábban NOC-nek (N-nitroso compounds, N-nitrozovegyületek) nevezett, Bingham és munkatársai által a vörös húst fogyasztó önkéntesek székletében mért értékek[10] – Bingham és Kuhnle szerint – nagyrészt nem N-nitrozo ATNC (apparent total nitroso compounds, látszólagos összes nitrozoveyület) volt, pl. S-nitrozotiolok és nitrozilvas (nitrozilhem formájában).[11]
Remove ads
Hivatkozások
Fordítás
Kapcsolódó szócikkek
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads