Timeline
Chat
Prospettiva
Piperidina
farmaco Da Wikipedia, l'enciclopedia libera
Remove ads
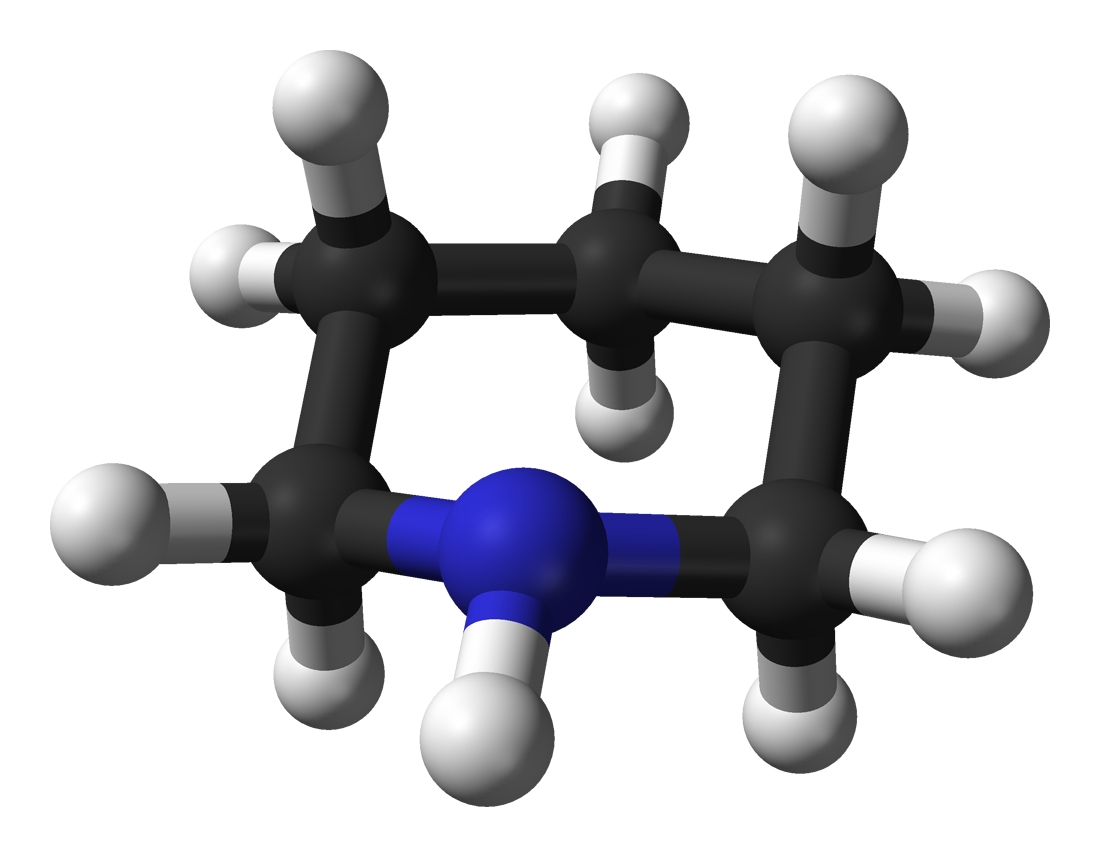
La piperidina, nome sistematico azacicloesano, è un composto organico di formula (CH2)5NH. È un'ammina eterociclica secondaria il cui scheletro è un anello a sei termini con cinque unità ponte metilene (-CH2-) e un atomo di azoto. È un liquido incolore, fumante, con un odore descritto come ammoniacale, pepato;[2] il nome deriva dal genere Piper, che è la parola latina per pepe.[3] La piperidina è molto usata come sintone e reagente chimico per la sintesi di vari composti organici, anche farmaceutici.
Remove ads
Produzione
La piperidina si produce industrialmente per idrogenazione della piridina, di solito con un catalizzatore di solfuro di molibdeno:[4]
La piperidina si può ottenere anche con l'idrogenazione della piridina condotta con sodio in etanolo.[5]
Remove ads
Presenza in natura della piperidina e di suoi derivati
La piperidina è stata ricavata dal pepe[6], dalla Psilocaulon absimile N.E.Br (Aizoaceae)[7] e dalla Petrosimonia monandra.[8]
L'anello della piperidina è presente in molti alcaloidi naturali, tra i quali:
- la piperina, responsabile del gusto pepato del pepe nero (Piper nigrum), e che è all'origine del nome;
- la solenopsina, un alcaloide velenoso presente nelle punture della formica di fuoco (Solenopsis invicta);[9]
- l'anabasina, analogo della nicotina che si trova nell'albero del Tabacco Brasiliano (Nicotiana glauca);
- la lobelina, alcaloide del Tabacco Indiano (Lobelia inflata);
- la coniina, alcaloide tossico della cicuta (Conium maculatum), che fu usata per uccidere Socrate.[10]
Remove ads
Conformazione
 |
 |
La piperidina preferisce la conformazione a sedia, analogamente al cicloesano. A differenza del cicloesano, la piperidina possiede due diverse conformazioni a sedia: in una il legame N–H è in posizione assiale, e nell'altra in posizione equatoriale.
Dopo una lunga controversia nel periodo 1950–1970, si è trovato che la conformazione equatoriale è più stabile di 0,72 kcal/mol in fase gassosa.[11] In solventi non polari si è valutato un intervallo tra 0,2 e 0,6 kcal/mol, ma in solventi polari potrebbe essere più stabile il conformero assiale.[12]
I due conformeri si interconvertono rapidamente per inversione dell'azoto; la barriera energetica per questo processo è stimata in 6,1 kcal/mol, un valore sostanzialmente minore delle 10,4 kcal/mol necessarie per l'inversione dell'anello.[13] Nel caso della N-metilpiperidina la conformazione equatoriale è preferita per 3,16 kcal/mol,[11] un valore molto maggiore di quello del metilcicloesano, 1,74 kcal/mol.
Reazioni
La piperidina è una ammina secondaria molto usata. Insieme alla pirrolidina e alla morfolina è una delle ammine secondarie più usate per convertire aldeidi e chetoni che abbiano almeno un atomo di idrogeno in posizione alfa nelle corrispondenti enammine.[14] Le enammine derivate dalla piperidina si possono usare nell'alchilazione delle enammine di Stork; tali enammine alchilate possono poi essere facilmente riconvertite nei corrispondenti chetoni e aldeidi alchilati.[15]
La piperidina si può convertire nella sua clorammina C5H10NCl con ipoclorito di calcio. La clorammina risultante può eliminare facilmente una molecola di HCl formando l'immina endociclica (C5H9N).[16]
Remove ads
Usi
Oltre che come reagente per sintesi di composti, la piperidina è usata sia come solvente che come base. Lo stesso vale per alcuni derivati: la N-formilpiperidina (C5H10N−CH=O) è un solvente polare aprotico in grado di sciogliere idrocarburi meglio di altri solventi ammidici, e la 2,2,6,6-tetrametilpiperidina è una base con alto ingombro sterico, utile per la scarsissima nucleofilia e alta solubilità in solventi organici. Un'importante applicazione industriale della piperidina è nella sintesi di prodotti acceleranti per la vulcanizzazione della gomma.[4] La piperidina e i suoi derivati sono inoltre comunissimi sintoni nella sintesi di farmaci e prodotti della chimica fine. L'anello della piperidina si trova ad esempio nei farmaci paroxetina, risperidone, raloxifene, minoxidil, aloperidolo, petidina, e in tanti altri. La piperidina è anche comunemente impiegata in reazioni chimiche di degradazione, come nel sequenziamento del DNA per rompere specifici nucleotidi modificati. È usata anche come base per deproteggere amminoacidi FMOC nella sintesi dei peptidi in fase solida.
Remove ads
Note
Voci correlate
Altri progetti
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads