トップQs
タイムライン
チャット
視点
プロテインキナーゼB
ウィキペディアから
Remove ads
プロテインキナーゼB (英: protein kinase B、略称: PKB)は、グルコースの代謝やアポトーシス、細胞増殖、転写、細胞遊走といった複数の細胞プロセスにおいて重要な役割を果たすセリン/スレオニンキナーゼで、Aktとしても知られる。
Remove ads
ファミリーのメンバー(アイソフォーム)
Akt1は細胞の生存経路に関与し、アポトーシスを阻害することが知られている。またAkt1はタンパク質合成経路を誘導することもでき、そのため骨格筋肥大や一般的な組織成長を誘導する細胞経路において主要なシグナル伝達タンパク質となっている。Akt1を完全に欠損させたマウスモデルでは成長の遅滞がみられ、精巣や胸腺といった組織では自発的なアポトーシスの増加がみられる[3]。アポトーシスを防ぐことで細胞の生存が促進されることから、Akt1は多くのタイプのがんにおいて主要な因子として関係している。Akt(現在ではAkt1と呼ばれている)はもともと形質転換能を持つレトロウイルスAKT8の中のがん遺伝子として同定された[4]。
Akt2は、インスリンシグナル経路において重要なシグナル伝達分子であり、グルコース輸送の誘導に必要とされる。Akt1を欠損しているがAkt2は正常なマウスでは、グルコースの恒常性は影響を受けない一方、マウスの体は小さくなり、これはAkt1の成長における役割と一致している。反対に、Akt2を持たず正常なAkt1を持つマウスでは、軽度の発育不全と糖尿病の表現型(インスリン抵抗性)が生じ、Akt2はインスリンシグナル経路に対してより特異的に機能するという考えと一致している[5]。
Aktのアイソフォームはヒトのさまざまな腫瘍で過剰発現しており、ゲノムレベルにおいても胃腺がん(Akt1)、卵巣がん(Akt2)、膵がん(Akt2)、乳がん(Akt2)で増幅が確認されている[6][7]。
Akt3は主に脳で発現しているようであるが、その機能ははっきりしない。Akt3を失ったマウスは脳が小さくなることが報告されている[8]。
Remove ads
調節
要約
視点
Akt1はPI3K/AKT/mTOR経路などに関与している。
リン脂質への結合
Aktは、PHドメイン(pleckstrin homology domain)として知られるタンパク質ドメインを持っている。このドメインは、ホスホイノシチドに高い親和性で結合する。AktのPHドメインの場合は、PIP3(ホスファチジルイノシトール-3,4,5-トリスリン酸)とPI(3,4)P2(ホスファチジルイノシトール-3,4-ビスリン酸)のどちらかに結合する[9]。PI(4,5)P2(ホスファチジルイノシトール-4,5-二リン酸)はPI3キナーゼ(PI3K)ファミリーの酵素のみによってリン酸化される。リン酸化は成長過程の開始を細胞へ伝達する化学的メッセージを受け取ったときのみ起こり、細胞シグナリングの制御には好都合である。PI3KはGタンパク質共役受容体や、インスリン受容体のような受容体型チロシンキナーゼなどによって活性化される。活性化が起こると、PI3KはPI(4,5)P2をリン酸化してPIP3を形成する。
リン酸化
PIP3を介して正しく膜に配置されたAktは、PDPK1(phosphoinositide dependent kinase 1)によってスレオニン308番残基が、mTORC2(mammalian target of rapamycin complex 2)によってセリン473番残基がリン酸化されて活性化されるが[10][11]、最初に起こるのはmTORC2によるリン酸化であり、これによってその後のPDPK1によるリン酸化が促進される。セリン473番残基に対するリン酸化は、インテグリン結合キナーゼ(ILK)[12]やMAPKAK2(mitogen-activated protein kinase-activated protein kinase 2)[13]といった他の酵素によって行われることもある。
活性化されたAktは、そのキナーゼ活性によって多数の基質(mTORなど)を活性化または不活性化し続ける。
AktはPI3Kの下流のエフェクター分子であるだけでなく、PI3K非依存的な方法によっても活性化される[14]。非受容体型チロシンキナーゼであるACK1(TNK2)はAktのチロシン176番残基をリン酸化し、PI3K非依存的な活性化を引き起こす[14]。インスリン存在下では、cAMP量の増加によってプロテインキナーゼA(PKA)を介してAktが活性化されることが、研究からは示唆されている[15]。
ユビキチン化
Aktは通常、ターンモチーフに位置するスレオニン450番残基が翻訳時にリン酸化される。この残基がリン酸化されていないときは、Aktは正しくフォールディングしない。450番残基がリン酸化されず、誤ったフォールディングがなされたAktは、ユビキチン化されてプロテアソームによって分解される。また、IGF-1への応答によってスレオニン308番残基とセリン473番残基がリン酸化されると、ユビキチンリガーゼ(E3リガーゼ)であるNEDD4によって部分的なユビキチン化がなされる。リン酸化されてユビキチン化されたAktはプロテアソームによって分解される一方、その一部はユビキチン依存的に核へ移行し、基質のリン酸化を行う。がん由来のAkt変異体(E17K)は、野生型Aktよりも容易にユビキチン化とリン酸化がなされ、より効率的に核へと移行する。この機構が、ヒトでのE17K変異によるがんに寄与している可能性がある[16]。
脂質ホスファターゼとPIP3
PI3K依存的なAktの活性化は、がん抑制遺伝子PTENによって制御される。PTENは上述のPI3Kの逆の機能を持ち[17]、PIP3をPI(4,5)P2に脱リン酸化するホスファターゼである。これによって、Aktのシグナル伝達経路から膜局在化因子が除去される。膜への局在化がなくなることでAktの活性化は大きく減少し、そしてAktに依存して活性化される下流経路も減弱する。
またPIP3は、SHIPファミリーのイノシトールホスファターゼであるSHIP1とSHIP2によって、5位が脱リン酸化される。PIP3とPI(3,4)P2では、下流の応答が異なることが報告されている[18][19]。
プロテインホスファターゼ
PHLPPファミリーのホスファターゼ、PHLPP1とPHLPP2は、Aktを直接脱リン酸化し、不活性化することが示されている。PHLPP2はAkt1とAkt3を脱リン酸化する一方、PHLPP1はAkt2とAkt3を脱リン酸化する[20]。
Remove ads
機能
Aktは細胞の生存[21]と代謝を調節する。Aktが結合して調節する下流のエフェクターには、NF-κB、Bcl-2ファミリータンパク質、TFEB、MDM2などがある。
細胞生存
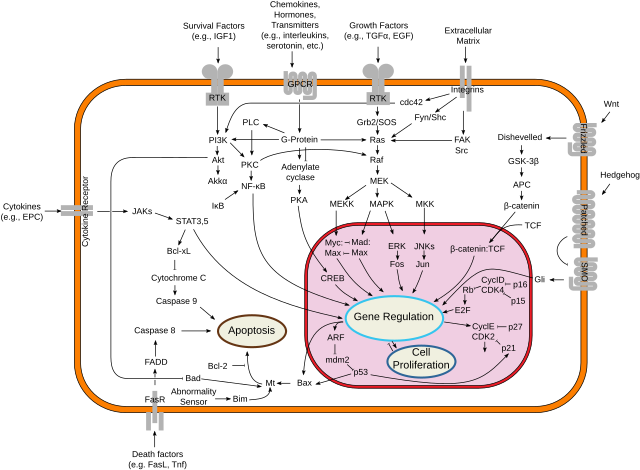
Aktは、成長因子を介した細胞生存を直接的にも間接的にも促進する。BADはBcl-2ファミリーのアポトーシス促進タンパク質である。AktはBADの136番のセリン残基をリン酸化し[22]、それによってBADはBcl-2/Bcl-X複合体から解離してアポトーシス促進機能を失う[23]。また、AktはIκBキナーゼ(IKK)を調節することでNF-κBを活性化し、生存促進遺伝子の転写を引き起こす[24]。
細胞周期
Aktは細胞周期に関与することが知られている。さまざまな状況で、Aktの活性化によってG1期[25]およびG2期[26]での細胞周期の停止が解除されることが示されている。さらに、活性化されたAktは、変異原性の可能性のある影響を受けた細胞の増殖と生存を可能にし、そのため他の遺伝子の変異獲得に寄与している可能性がある。
代謝
Akt2は、インスリンによって誘導されるグルコース輸送体GLUT4の細胞膜への輸送に必要とされる[27]。GSK-3(glycogen synthase kinase 3)はAktによるリン酸化で阻害され、その結果グリコーゲン合成が増加する。また、GSK-3はWntシグナル経路にも関与しており、そのためAktもWnt経路に関与している可能性がある。C型肝炎ウイルスによって誘導される脂肪変性にもAktが関与しているが、その機能はあまり解明されていない[28]。
リソソームの生合成とオートファジー
Aktは、リソソーム生合成の主要な制御因子[29]であるTFEBに対し、467番目のセリン残基のリン酸化によって直接的に調節を行う[30]。リン酸化されたTFEBは核外へ移行し、活性は低下する[30]。薬剤によるAktの阻害によってTFEBの核移行が促進され、リソソームの生合成とオートファジーは活性化される[30]。
血管新生
Akt1は、血管新生や腫瘍形成にも関与している。Akt1が欠乏したマウスでは生理的な血管新生が阻害される一方で、皮膚と血管の細胞外マトリックスの異常に関連した、病理的な血管新生と腫瘍の成長が促進される[31][32]。
臨床的重要性
要約
視点
Aktは腫瘍細胞の生存、増殖、そして侵襲性に関連している。またAktの活性化は、ヒトのがんと腫瘍細胞において最も頻繁に観察される変化の1つである。Aktが恒常的に活性化されている腫瘍細胞は、その生存がAktに依存している可能性がある。それゆえ、Aktとその関連経路について理解することは、がんや腫瘍細胞に対するより良い治療法を生み出すために重要となる。AKT1のモザイク活性化変異(c. 49G>A, p.Glu17Lys)はプロテウス症候群と関連しており、皮膚、結合組織、脳や他の組織の過成長が引き起こされる[33]。
AKT阻害剤
Aktの上の機能のため、Aktの阻害剤は神経芽腫のようながんの治療となる可能性がある。いくつかのAkt阻害剤で治験が行われている。2007年にVQD-002の第I相試験が行われた[34]。2010年にはペリホシン(perifosine)がフェーズIIに到達したが[35]、2012年の第III相試験は通過しなかった[36]。ミルテホシン(miltefosine)はリーシュマニア症に対して承認されているが、HIVを含めた他の適応症に対しての研究がなされている。2011年にMK-2206の進行固形腫瘍に対する第I相試験の結果が報告され[37]、その後さまざまな種類のがんに対して第II相試験が行われている[38]。2013年にAZD5363の固形腫瘍に対する第I相試験の結果が報告された[39]。また、2016年にはAZD5363とオラパリブの併用試験が報告された[40]。イパタセルチブ(ipatasertib)の乳がんに対する第II相試験が行われている[41]。
AKTは現在では、単純ヘルペスウイルスHSV-1とHSV-2の細胞進入の「鍵」となると考えられている。細胞による細胞内へのカルシウムの放出によってヘルペスウイルスは進入できるようになるが、ウイルスはAKTを活性化することでカルシウムの放出を引き起こす。ウイルスへの曝露前に細胞をAkt阻害剤で処理することで、感染率は有意に低下する[42]。
AKTの活性低下
AKTの活性化は多くの悪性腫瘍と関連している。一方で、マサチューセッツ総合病院とハーバード大学の研究グループによって、急性骨髄性白血病(AML)において、AKTとその下流のエフェクターであるFOXOが反対の役割を持っているという発見がなされた。彼らは、AKTの活性が低レベルであることとFOXOのレベルが昂進していることが、白血病幹細胞の機能と未成熟状態の維持に必要であると主張している。AMLの患者の試料は遺伝子型に関わらず約40%でFOXOが活性化しており、それゆえAKTの活性は減少していると考えられる。マウスモデルでは、Aktの活性化もしくはFoxO1/3/4すべての欠失のいずれかによって白血病細胞の成長が減少した[43]。
AKTの過剰な活性化
近年の2つの研究によって、AKT1が若年型顆粒膜細胞腫(juvenile granulosa cell tumor, JGCT)に関与していることが示されている。15歳以下で発生したJGCTの60%以上でPHドメインの重複が見られた。重複の見られないJGCTでは、高度に保存された残基に点変異が生じていた。重複が起こった変異タンパク質は野生型とは異なる細胞内分布を示し、細胞膜で顕著に増加していた。これによってAKT1が顕著に活性化されていることがAKT1の強いリン酸化レベルから示され、レポーターアッセイによっても裏付けられた[44]。
RNA-Seq解析によって発現が変化している一連の遺伝子が特定され、それらはサイトカインとホルモンのシグナル伝達や、細胞分裂に関連する過程に関与していた。さらなる分析によって脱分化の過程が起こっている可能性が指摘され、トランスクリプトームの異常のほとんどは、AKT1の活性化の影響を受けた限られたセットの転写因子を介して行われていることが示唆された。これらの結果は、AKT1の体細胞変異がJGCTの発症を駆動する主要なイベントとなっている可能性を示している[45]。
Remove ads
出典
関連文献
関連項目
外部リンク
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads


