トップQs
タイムライン
チャット
視点
細胞核
ウィキペディアから
Remove ads
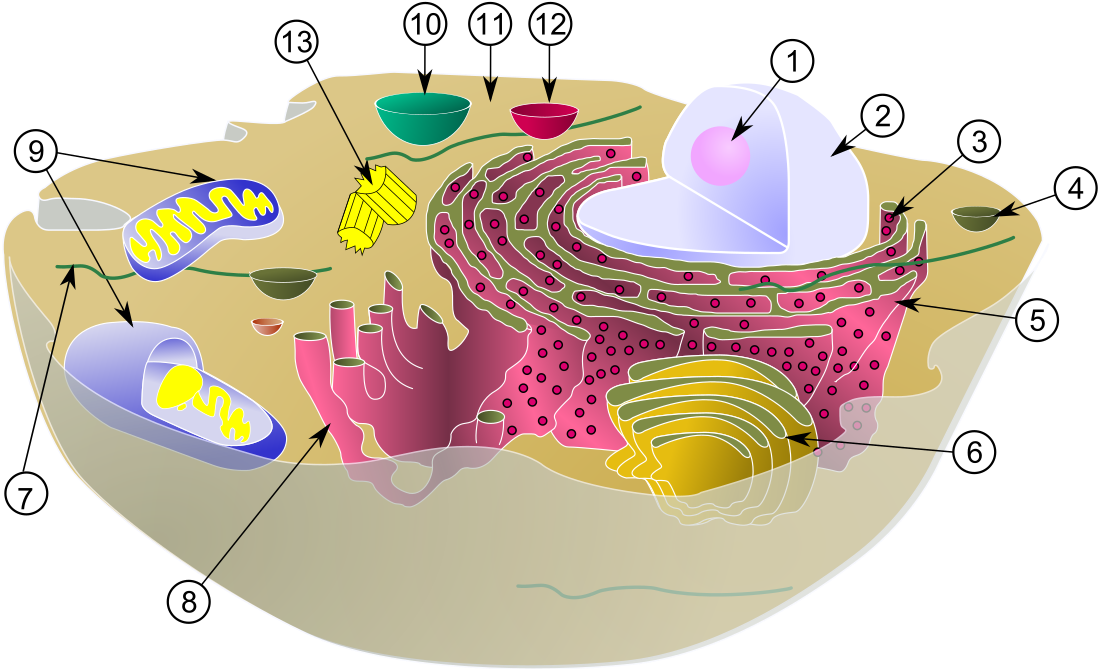
細胞核(さいぼうかく、英: cell nucleus、単に核とも)は、真核生物にみられる、膜に覆われた細胞小器官である。通常、真核生物の細胞には核は1つだけ存在するが、哺乳類の赤血球は核を持たず、破骨細胞には多数の核が存在するなど、例外的な細胞種もいくつか存在する。核を構成する主要な構造は核膜と核マトリックスである。核膜は細胞小器官全体を包み込む二重の膜構造であり、核マトリックスは核内で機械的支持を行うネットワーク構造である。

核にはその細胞のゲノムのほぼ全てが含まれており、多くの場合、核DNAは複数の染色体へと組織化されている。染色体は長い直鎖状のDNA分子にさまざまな種類のタンパク質(ヒストンなど)が点在する構成をしており、タンパク質はDNAを保護し組織化する役割を果たしている。また、染色体内に存在する遺伝子は細胞機能を促進するように構造化されている。核は遺伝子の完全性を維持し、遺伝子発現を調節することで細胞の活動を制御している。
巨大な分子は核膜を透過することができないため、核膜を越える輸送の調節には核膜孔が必要とされる。核膜の二重膜構造を貫通する核膜孔は、輸送タンパク質を介した能動的輸送を必要とする巨大分子が通過するためのチャネルとなっており、また低分子やイオンは孔を自由に通過する。遺伝子発現と染色体の維持の双方のプロセスにおいて、タンパク質やRNAなどの高分子が核膜孔を通って移動することが必要である。核の内部には膜に覆われた小区画は存在しないが、特定のタンパク質、RNA分子、染色体の特定の部分から構成される核内構造体が多数存在する。こうした構造体の中では核小体が最もよく知られており、主にリボソームの組み立てに関与している。
Remove ads
染色体
→詳細は「染色体」および「細胞核の組織化」を参照
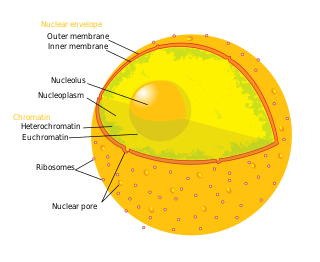
細胞核には細胞の遺伝物質の大部分が複数の直鎖状のDNA分子の形で含まれており、染色体と呼ばれる構造に組織化されている。ヒトの各細胞にはおおよそ2 mの長さのDNAが含まれている[1]:405。細胞周期のほとんどの期間では、核内のDNAはクロマチンと呼ばれるDNA-タンパク質複合体へ組織化されている。細胞分裂の期間には、核型の図で良く知られた、明確な染色体構造を形成しているのが観察される。また、細胞内の遺伝子の一部は、核ではなくミトコンドリアに位置している[1]:438。
クロマチンには2つの種類が存在する。ユークロマチンはDNAの詰め込みがが比較的緩やかな形態であり、高頻度で発現している遺伝子が含まれている[2]。もう1つの種類であるヘテロクロマチンはユークロマチンよりもコンパクトにDNAが詰め込まれた形態であり、まれにしか転写されないDNAが含まれている。ヘテロクロマチンにはさらに、特定の細胞種または特定の発生段階でのみヘテロクロマチンとして組織化される条件的ヘテロクロマチン(facultative heterochromatin)領域と、テロメアやセントロメアのように染色体の構造的構成要素として常にヘテロクロマチン化している構成的ヘテロクロマチン(constitutive heterochromatin)領域に分類される[3]。間期の間のクロマチンは、各染色体ごとに染色体テリトリーと呼ばれるパッチ状に組織化されている[4][5]。一般的に染色体のユークロマチン領域にみられる活発な遺伝子は、染色体テリトリーの境界に位置している傾向がある[6]。
特定種のクロマチン構造、特にヌクレオソームに対する抗体は、全身性エリテマトーデスなど多くの自己免疫疾患と関連している[7]。こうした抗体は抗核抗体と呼ばれ、多発性硬化症の患者でも免疫系の全般的機能不全の一部として観察される[8]。

Remove ads
特徴的構造
要約
視点
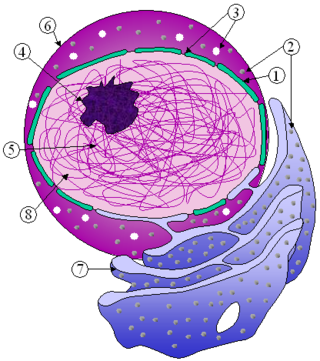
核にはその細胞のDNAのほぼ全てが含まれている。核内のDNAは核マトリックスと呼ばれる繊維状の中間径フィラメントネットワークに囲まれており、核膜と呼ばれる二重膜構造によって内包されている。核膜は、細胞の他の部分から核質と呼ばれる核内の流体を分離する役割を果たしている。核の大きさは細胞の大きさと相関しており、その比率はさまざまな細胞種や生物種で報告されている[9]。真核生物の多くの細胞種では、一般的に細胞体積の10%を核が占めている[10]:178。動物細胞では核は最も大きな細胞小器官であり[11]:12、ヒト細胞では核の直径は約6 μmである[10]:179。
核膜と核膜孔

核膜は内膜と外膜の2つの脂質二重層によって構成されており、核膜孔は両者を貫通している[10]:649。内膜と外膜は細胞の遺伝物質を他の細胞内容物から分離する役割を果たしており、核内が細胞内の他の部分とは異なる環境となるよう維持している。これら2つの膜は核の大部分を囲んで並置されているが、その形状や含有物に関しては大きく異なる。内膜は核の内容物を取り囲んでおり、明確な境界を形成している[11]:14。内膜にはさまざまなタンパク質が埋め込まれており、これらは中間径フィラメントに結合して核の構造の形成に寄与している[10]:649。外膜は内膜を内包しており、隣接する小胞体膜と連続的に膜を形成している。このように外膜は小胞体膜の一部でもあるため、膜を越えてタンパク質を活発に翻訳しているリボソームが膜上に点在している[10]:649。内膜と外膜の間の領域は perinuclear space と呼ばれ、この空間は小胞体内腔と連続している[10]:649。
哺乳類の核膜には、核膜を貫通する核膜孔複合体(NPC)が一般的には3000個から4000個存在している[10]:650。内膜と外膜が融合する地点において、NPCは8回対称のリング構造を形成している[12]。NPCの数は細胞種によって大きく異なる場合があり、小さなグリア細胞では数百個しか存在しないのに対し、大きなプルキンエ細胞では約20000個も存在する[10]:650。NPCは核質と細胞質基質の間での分子選択的輸送を可能にしている[13]。NPCは、ヌクレオポリンと呼ばれる約30種類の異なるタンパク質から構成されている[10]:649。大きさは60–80 MDaであり、酵母では約50個、脊椎動物では数百個のタンパク質が含まれている[11]:622–4。核膜孔全体の直径は100 nmであるが、孔の中心部には調節システムが存在するため、分子が自由に拡散することができる隙間はわずか9 nmである。このサイズは水溶性の小分子の通過は可能となるが、核酸やタンパク質などは核を自由に出入りすることはできず、こうした分子は核内へ能動的に輸送する必要がある。このリング構造からは核バスケット (nuclear basket) と呼ばれる構造が核質側へ突出しており、細胞質側へは複数の繊維状構造が伸びている。どちらの構造も核輸送タンパク質の結合を媒介している[1]:509–10。
ほとんどのタンパク質、リボソームサブユニット、そして一部のRNAは、カリオフェリンと呼ばれる輸送因子ファミリーによって、核膜孔複合体を通って輸送される。核内への移動を媒介するカリオフェリンはインポーチン、核外への移動を媒介するものはエクスポーチンと呼ばれる。ほとんどのカリオフェリンはその積み荷と直接的に相互作用するが、一部はアダプタータンパク質を介して結合する[14]。コルチゾールやアルドステロンなどのステロイドホルモンや、細胞間シグナル伝達に関与する他の脂溶性低分子は細胞膜を通過して細胞質へ拡散し、そこで核内受容体と結合して核内へと輸送される。核内受容体はリガンドの結合時には転写因子として機能する[1]:482。
核ラミナ
→詳細は「核ラミナ」を参照
動物細胞の核は、中間径フィラメントネットワークによって機械的に支持されている。核膜の内側は核ラミナがメッシュ状に組織化されたネットワークを形成している一方で、核膜の細胞質側の支持は組織化の程度は比較的低い。双方の系が核膜の機械的支持や、染色体や核膜孔のアンカー部位として機能している[15]。
核ラミナの大部分はラミンタンパク質で構成されている。他の全てのタンパク質と同様にラミンは細胞質で合成される。その後で核の内部へ輸送され、そこで重合して既存の核ラミナネットワークに組み込まれる[16][17]。核ラミナは核膜内側のエメリン、細胞質側のネスプリンなどを介して細胞骨格と連結されている[18]。ラミンは核質の内部にもみられ、nucleoplasmic veilとして呼ばれる、蛍光顕微鏡で観察可能な他の規則的構造を形成している[19][20]。この構造の実際の機能は明らかではないが、核小体からは排除されており、細胞周期の間期に存在する[21]。このラミン構造はクロマチンと相互作用しており、これらの構造を破壊するとタンパク質をコードする遺伝子の転写が阻害される[22]。
他の中間径フィラメントの構成要素と同様に、ラミンの単量体はα-ヘリカルドメインを持っており、2分子の単量体が互いに巻きついてコイルドコイルと呼ばれる二量体構造を形成する。そして、2つの二量体が逆平行型に並んで結合し、プロトフィラメント(protofilament)と呼ばれる四量体構造が形成される。さらに8つのプロトフィラメントが並び、ねじれることでロープ状のフィラメントが形成される。こうしたフィラメントが動的に重合・脱重合を行い、その競合によってフィラメントの長さが変化する[15]。
フィラメント重合に欠陥をもたらすラミン遺伝子の変異は、ラミノパチーと呼ばれる希少遺伝子疾患群の原因となる。ラミノパチーの中で最も有名なものはプロジェリアと呼ばれる疾患ファミリーであり、患者では早老が引き起こされる。老化の表現型を生じさせる生化学的変化の正確な機構は、まだ十分には理解されていない[23]。
核小体
→詳細は「核小体」および「核内構造体」を参照

核小体は、核内で濃密に染色される、膜を持たない構造体(核内構造体)の中で最大のものである。核小体リボソームRNA(rRNA)をコードするDNA(rDNA)のタンデムリピートの周囲に形成される。こうしたDNA領域は核小体形成域と呼ばれる。核小体の主な役割はrRNAの合成とリボソームの組み立てである。核小体の構造的凝集はその活性に依存している。核小体でのリボソームの組み立てが核小体構成要素間の一過的結合をもたらし、それによってさらにリボソームの組み立てが促進され、さらに結合が進行する。このモデルは、rDNAの不活性化によって組織的な核小体構造の混合が引き起こされる観察によって支持されている[24]。
リボソームの組み立ての最初の段階では、RNAポリメラーゼIと呼ばれるタンパク質がrDNAを転写し、大きなpre-rRNA前駆体が形成される。そして、5.8S、18S、28S rRNAのサブユニットへ切断される[10]:328[25]。転写と転写後プロセシング、そしてrRNAの組み立ては、核小体低分子RNA(snoRNA)の助けによって行われる。snoRNAのいくつかは、リボソームの機能に関連する遺伝子をコードするmRNAからスプライシングされたイントロンに由来する。組み立てられたリボソームサブユニットは核膜孔を通過する最も大きな構造体である[1]:526。
電子顕微鏡による観察では、核小体は3つの判別可能な領域から構成されていることが観察される。最も内側の繊維状中心部(fibrillar center [FC])、それを取り囲む高密度繊維状部(dense fibrillar component [DFC]、フィブリラリンやヌクレオリンが含まれる)、外側の境界をなす顆粒部(granular component [GC]、ヌクレオフォスミンが含まれる)である。rDNAの転写はFCまたはFC-DFC境界で起こり、そのため細胞でrRNAの転写が増加するとFCがより多く検出されるようになる。rRNAの切断と修飾の大部分はDFCで行われ、リボソームサブユニットへのタンパク質の組み込みを伴う後半のステップはGCで行われる[25]。
核スペックル
核スペックル(スペックル、スプライシングスペックル、speckle)は、pre-mRNAスプライシング因子に富む核内構造体で、哺乳類細胞の核質のクロマチン間領域(interchromatin region)に位置している[26]。蛍光顕微鏡観察では不定形の点状構造で大きさや形も様々であるが、電子顕微鏡観察ではクロマチン間顆粒のクラスターとして観察される。核スペックルは動的な構造で、タンパク質やRNA-タンパク質複合体の構成要素は絶えずスペックル間や、転写活性部位など核内の他の領域を循環している。核スペックルは遺伝子活性のエンハンサーとしてp53と協働し、特定の遺伝子の活性を直接高める場合がある。p53の標的遺伝子の中でも、スペックルと関連したものとそうでないものとは機能的に異なっている[27]。
核スペックルの構成、構造、挙動についての研究からは、核の機能的区画化と、遺伝子発現装置、スプライシングsnRNP、pre-mRNAスプライシングに必要な他のタンパク質の組織化に関与しているというモデルが立てられている[28][29][30]。細胞の要求の変化に応じて、これらの構造体の構成要素や位置はmRNA転写や特定のタンパク質のリン酸化による調節を介して変化する[31]。核スペックルは上に挙げた名称の他にも、splicing factor compartment (SF compartment)、interchromatin granule cluster (IGC)、B snurposomes などの名称でも知られている[32]。B snurposome は両生類の卵母細胞の核や、キイロショウジョウバエDrosophila melanogasterの胚で観察されている。両生類の核の電子顕微鏡像では、B snurposome は単独で存在するか、もしくはカハール体に付着しているように見える[33]。核スペックルは当初はスプライシング因子の貯蔵部位として機能していると考えられていたが[34]、核スペックル近傍の遺伝子やpre-mRNAの組織化によってスプライシングの速度論的効率を高め、スプライシングの調節によって最終的には産生されるタンパク質量を高めることが示されている[35]。
カハール体とGem

典型的な核には、カハール体(カハール小体、カハールボディ)またはコイル体(coiled body)と呼ばれる1個から10個のコンパクトな構造が存在し、その直径は生物種や細胞種によって異なるが 0.2 µm から 2.0 µm 程度である[36]。電子顕微鏡下での観察では絡まった糸玉のような形状をしており[37]、fociと呼ばれる濃密な中心部にはタンパク質コイリンが分布している[38]。カハール体はRNAのプロセシングに関する多くの役割に関与しており、特に核小体低分子RNA(snoRNA)や核内低分子RNA(snRNA)の成熟や、ヒストンmRNAの修飾などに関与している[36]。
カハール体に類似した構造として、Gem(Gem小体、Gems、Gemini of coiled bodies、Gemini of Cajal bodies)がある。その名前はふたご座(Gemini)に由来し、カハール体との密接な関係を表している。Gemは大きさと形状の面ではカハール体と類似しており、実際、顕微鏡下で視覚的に区別することはできない[38]。カハール体とは異なり、Gemには核内低分子リボヌクレオタンパク質(snRNP)が含まれないが、snRNPの生合成に関連した機能を持つSMNタンパク質を含んでいる[39]。 GemはsnRNPの生合成においてカハール小体を補助していると考えられているが[39]、両者は同じ構造が異なる見え方をしているだけであることを示唆する観察もある[38]。その後の電子顕微鏡による微細構造の解析によって、Gemとカハール体との差異はコイリンにあることが示された。すなわち、カハール体はSMNとコイリンを含んでおり、GemはSMNを含むがコイリンを含まない[40]。
その他の核内構造体
上述したサンティアゴ・ラモン・イ・カハールによって最初に記載された核内構造体(核小体、核スペックル、カハール小体)以外にも核には多くの構造体が含まれており、PIKA(polymorphic interphase karyosomal association)、PMLボディ(PML body)、パラスペックルなどの構造体が知られている。これらの構造体の機能はあまり解明されていないが、核質が一様な混合物ではなく、組織化された機能的なサブドメインを含むものであることを示している点で重要である[42]。
また、異常な疾患過程の一部として出現する核内構造体もある。一例として、ネマリンミオパチーの一部症例では、核内に小さな桿状の構造体の存在が報告されている。この疾患は一般的にはアクチンの変異が原因となっており、桿状構造は変異体アクチンやその他の細胞骨格タンパク質から構成されている[44]。
PIKA
PIKA(polymorphic interphase karyosomal association)は、1991年に顕微鏡研究で初めて記載された。その機能は未だ明らかではないが、活発なDNA複製、転写、そしてRNAのプロセシングとは関連していないと考えられている[45]。snRNAの転写を促進する転写因子PTFの濃密な局在によって定義されるドメインとしばしば相互作用していることが判明している[46]。
PMLボディ
→「前骨髄球性白血病タンパク質」も参照
PMLボディ(PML体、PML小体、promyelocytic leukemia body)は核質中に分散して存在する球形の構造体で、大きさは約0.1–1.0 µm である。他の名称でも知られており、nuclear domain 10 (ND10)、Kremer body、PML oncogenic domain などとも呼ばれる[47]。PMLボディの名称は、主要な構成要素であるPMLタンパク質に由来する。核内でカハール体やcleavage bodyと結合して存在していることがしばしば観察される[42]。Pml遺伝子を欠失しPMLボディが形成されないマウスも明確な悪影響を示すことなく正常に発生するため、PMLボディはほとんどの基礎的な生物学的機能に必要ではないことが示されている[48]。
パラスペックル
→詳細は「パラスペックル」を参照
Foxらによって2002年に発見されたパラスペックルは、核のクロマチン間領域に位置する不定形の区画である[49]。最初に記載されたのはHeLa細胞においてであり、核には一般的に10個から30個存在するとされた[50]。現在では、全ての初代培養細胞、形質転換細胞株、組織切片に存在することが知られている[51]。その名称は核での分布に由来するもので、"para"は"parallel"の略、"speckle"は常に近接して存在する核スペックルを指している[50]。
パラスペックルは核内のタンパク質やRNAを隔離しており、遺伝子発現調節に関与する分子スポンジ(molecular sponge)として機能しているようである[52][53]。パラスペックルは動的な構造体であり、細胞の代謝活性の変化に応答して変化する。この構造体は転写に依存的であり[54]、RNAポリメラーゼIIによる転写がないときにはパラスペックルは消失する。こうした状況下では関連するタンパク質構成要素(PSP1、p54nrb、PSP2、CFI(m)68、PSF)は核小体で三日月型のキャップ構造体(perinucleolar cap)を形成する。この現象は細胞周期中でも実証されている。パラスペックルは間期の間に存在し、有糸分裂中も終期を除いて存在する。2つの娘細胞の核が形成される終期にはRNAポリメラーゼIIによる転写が行われないため、タンパク質構成要素は代わりにperinucleolar capを形成する[51]。
Perichromatin fibril
Perichromatin fibrilと呼ばれる繊維状構造体は、電子顕微鏡下でのみ観察可能である。転写が活発なクロマチンに近接して位置し、pre-mRNAのプロセシングが活発に行われている場所であるという仮説が立てられている[34]。
クラストソーム
クラストソーム(clastosome)は小さな構造体で (0.2–0.5 µm)、構造体周縁部のカプセル構造のために厚いリング状に観察される[41]。その名称はギリシャ語のklastos(壊れた)と soma(体)に由来する[41]。クラストソームは通常の細胞に一般的には存在せず、そのため検出は困難である。クラストソームは核内部のタンパク質分解活性が高いときに形成され、活性が低下するか、細胞がプロテアソーム阻害剤によって処理されると解体される[41][55]。クラストソームが細胞にわずかしか存在しないということは、この構造体がプロテアソームの機能に必須であるわけではないことを示している[56]。浸透圧ストレスもクラストソームの形成を引き起こすことが示されている[57]。この核内構造体は、プロテアソームの触媒サブユニットと調節サブユニット、そしてその基質を含んでおり、タンパク質分解部位であることが示唆される[56]。
Remove ads
機能
要約
視点
核は翻訳の場である細胞質から隔離された遺伝子転写のための場所を提供することで、原核生物には利用できないレベルでの遺伝子調節を可能にしている。核の主要な機能は遺伝子発現の制御と細胞周期進行中のDNA複製の媒介である[1]:171。
細胞の区画化
核膜は核の内容物の制御を可能にし、必要に応じてそれらを残りの細胞質部分から分離している。このことは、核膜の両側での過程の制御に重要な意味を持つ。細胞質での過程を制限する必要があるケースの大部分では、主要な関連因子は核へ除去され、またそこで転写因子と相互作用してその経路の特定の酵素の産生をダウンレギュレーションする。こうした調節は、エネルギー産生のためにグルコースを分解する経路である解糖系でも行われている。ヘキソキナーゼは解糖系の第一段階を担う酵素であり、グルコースからグルコース-6-リン酸を形成する。グルコース-6-リン酸から合成される分子であるフルクトース-6-リン酸が高濃度で存在すると、調節タンパク質によってヘキソキナーゼは核へ除去され[58]、そこで核内タンパク質と転写リプレッサー複合体を形成して解糖系に関与する遺伝子の発現を低下させる[59]。
また細胞は、どの遺伝子を転写するかを制御するため、遺伝子発現調節を担う転写因子の一部を隔離し、他のシグナル伝達経路によって活性化されない限りそれらがDNAに物理的にアクセスすることがないようにしている。これによって、不適切な遺伝子発現がたとえ低レベルであっても生じることがないよう防がれている。一例として、ほとんどの炎症反応に関与しているNF-κBによって制御される遺伝子の場合、シグナル伝達分子TNF-αによって開始される経路など、シグナル伝達経路への応答として転写が誘導される。TNF-αが細胞膜の受容体に結合すると細胞内のシグナル伝達タンパク質が膜へリクルートされ、最終的にNF-κBが活性化される。活性化されたNF-κBは核局在化シグナルによって核膜孔を通って核内へ輸送され、標的遺伝子の転写を刺激する[15]。
核膜による区画化は、スプライシングされていないmRNAの翻訳の防止も可能にしている[60]。真核生物のpre-mRNAはイントロンを含んでおり、翻訳によって機能的なタンパク質を産生するためにはイントロンを除去することが必要である。スプライシングは、リボソームがmRNAにアクセスするより前の核内の段階で行われる。核がなければ、リボソームは転写されたばかりの(プロセシングされていない)mRNAを翻訳してしまい、欠陥を有する非機能的タンパク質が合成されてしまう[1]:108–15。
複製
→詳細は「DNA複製」および「真核生物のDNA複製」を参照
核の主な機能は、遺伝子発現の制御と細胞周期進行中のDNA複製の媒介である[1]:171。複製は核内に局在化された形で生じ、細胞周期間期のS期に行われる。従来、静的なDNAに沿って複製フォークが進んでゆくことで複製が進行すると考えられてきたが、複製ファクトリー(replication factory)と呼ばれる新たなモデルが提唱されている。このモデルでは、複製フォークはいくつかの固定化されたファクトリー領域に濃縮されており、鋳型となるDNA鎖がベルトコンベアのようにそこを通過するとされている[61]。
遺伝子発現
→詳細は「遺伝子発現」および「転写ファクトリー」を参照

遺伝子発現はまず転写過程を伴い、そこではDNAを鋳型としてRNAが合成される。タンパク質をコードする遺伝子の場合、この過程で合成されるRNAはmRNAであり、タンパク質を合成するにはその後リボソームによってmRNAが翻訳される必要がある。リボソームは核外に位置しているため、合成されたmRNAは核外への輸送が必要である[62]。
核は転写の場であるため、転写を直接的に媒介したり転写過程の調節に関与したりするさまざまな種類のタンパク質が含まれている。これらには、二本鎖DNAをほどいてDNAへのアクセスを促進するヘリカーゼ、DNAのプロモーター領域に結合してRNA分子を合成するRNAポリメラーゼ、DNAのスーパーコイル構造を変化させてDNAの巻き戻しなどを助けるトポイソメラーゼ、発現を調節するさまざまな種類の転写因子などが含まれている[63]。
pre-mRNAのプロセシング
→詳細は「翻訳後修飾」を参照
新しく合成されたmRNA分子は、一次転写産物またはpre-mRNAと呼ばれる。pre-mRNAは細胞質への輸送の前に核内で転写後修飾を受けなければならず、こうした修飾を受けずに細胞質へ移動したmRNAはタンパク質への翻訳に利用されるのではなく、分解の標的となる。核内で行われる転写後修飾は、5'キャッピング、3'ポリアデニル化、そしてRNAスプライシングである。核内では、pre-mRNAはhnRNPと呼ばれる複合体中のさまざまなタンパク質と相互作用している。5'キャップの付加は転写と共役した形で行われ、転写後修飾の第一段階となっている。3'末端へのポリ(A)テール付加は、転写が完了した後に行われる[1]:509–18。
RNAスプライシングはスプライソソームと呼ばれる複合体によって行われ、イントロン(タンパク質をコードしていない領域)がpre-mRNAから除去され、残ったエクソンが1本の連続的なRNA分子として再形成される。この過程は通常、5'キャッピングと3'ポリアデニル化の後に起こるが、多くのエクソンからなる転写産物の場合には転写が完了する前に開始される[1]:494。多くのpre-mRNAは複数通りにスプライシングされ、その結果、異なるタンパク質配列をコードする成熟mRNAが作り出される。この過程は選択的スプライシングとして呼ばれ、限られた量のDNAから多様なタンパク質を生み出すことが可能となっている[64]。
Remove ads
ダイナミクスと調節
要約
視点
核輸送
→詳細は「核輸送」を参照

高分子の核への出入りは、核膜孔複合体によって緊密に制御されている。低分子は調節を受けることなく核へ入ることができるが[65]、RNAやタンパク質のような高分子が核内へ入るにはインポーチン、核外へ出るにはエクスポーチンと呼ばれるカリオフェリンとの相互作用を必要とする。細胞質から核へ移行するべき「積み荷」タンパク質には核局在化シグナルと呼ばれる短いアミノ酸配列が含まれており、そこへインポーチンが結合する。一方、核から細胞質へ輸送されるべきものには核外搬出シグナルが含まれており、エクスポーチンが結合する。インポーチンとエクスポーチンによる輸送は、GTPを加水分解してエネルギーを放出する酵素であるGTPアーゼによって調節されている。核輸送における主要なGTPアーゼはRanであり、核に位置するか細胞質に位置するかに応じて、GTPとGDPのいずれかを結合する。インポーチンはGTP結合型Ran(Ran-GTP)の結合によって積み荷を解離するが、一方エクスポーチンは積み荷を結合するためにRan-GTPを必要とする[14]。
核内輸送は細胞質における積み荷へのインポーチンの結合に依存しており、積み荷を結合したインポーチンは核膜孔を通って核へ移動する、核内では、Ran-GTPがインポーチンから積み荷を降ろすために働き、積み荷を降ろしたインポーチンは核外へ出て再利用される。核外輸送も同様の機構で行われており、エクスポーチンはRan-GTPに促進される形で核内の積み荷を結合し、核膜孔を通って外へ出た後、細胞質で積み荷を降ろす[66]。
転写後修飾が完了した後の、成熟したmRNAやtRNAを細胞質へ移動するためには、特別な核外搬出タンパク質が存在する。mRNAやtRNAはタンパク質の翻訳において中心的な役割を果たすため、この品質管理機構は重要である。イントロン除去が不完全であったりや誤ったアミノ酸が取り込まれることで誤ったタンパク質が発現されてしまうと、細胞には負の影響が生じる。そのため、修飾が不完全なRNAが細胞質に到着した場合には、翻訳には用いられず分解が行われる[1]。
組み立てと解体

細胞分裂過程、またはアポトーシスの影響下(プログラム細胞死過程)において、核は解体されたり破壊されたりする。これらのイベント中に、核の構造的構成要素(核膜や核ラミナ)は秩序だった分解が行われる。大部分の細胞において、核膜の解体は有糸分裂前期の終盤に起こる。しかしながら、核の解体は有糸分裂の普遍的特徴ではなく、全ての細胞で起こるわけではない。いくつかの単細胞真核生物(酵母など)ではいわゆる"closed mitosis"が起こり、核膜は保持されたままである。Closed mitosisでは、娘染色体は核の両極に移動し、核はその後2つに分割される。一方、高等真核生物の細胞は通常"open mitosis"が起こり、核膜の解体を特徴とする。娘染色体は紡錘体の両極に移動し、新たな核がその周辺で再び組み立てられる[1]:854。
細胞周期の特定の時点で、細胞は2つへ分裂する。新たな娘細胞はそれぞれ完全な遺伝子のセットを持っていなければならず、そのためには染色体を複製し、それらを別々のセットへと分離することが必要となる。この過程は、複製された染色体(姉妹染色分体)が微小管を介してそれぞれ異なる中心体と結合されているようにすることで行われている。その後、姉妹染色分体は細胞の別々の位置へと引き離される。多くの細胞では、中心体は核外の細胞質に位置しており、核膜が存在しているときには微小管は染色分体へ結合することはできない[67]。そのため、細胞周期の初期の段階、前期から前中期の段階までに、核膜は解体される[19]。同様に、CDC2などのプロテインキナーゼによるラミンのリン酸化で調節された過程によって、同時期に核ラミナの脱重合が生じる[68]。そして細胞周期の終結へ向けて核膜は再形成され、ほぼ同時期に核ラミナもラミンの脱リン酸化によって再重合する[68]。
一方で渦鞭毛藻では、核膜は保持されたままであり、そして中心体は細胞質に位置している。有糸分裂時には微小管は染色体と接触するようになり、セントロメア領域は核膜に取り込まれる(この機構はclosed mitosis with extranuclear spindleと呼ばれる)。他の多くの原生生物(繊毛虫や胞子虫など)や菌類は、中心体は核内にあるため、細胞分裂中も核膜は解体されない[69]。
アポトーシスは、制御された形で細胞の構造要素が破壊される過程であり、細胞死が誘導される。アポトーシスに関連した変化は核やその内容物に直接的影響を及ぼし、クロマチンは凝縮され、核膜や核ラミナは解体される。ラミンネットワークの破壊はアポトーシスの進行を担うカスパーゼと呼ばれる特別なプロテアーゼによって制御されており、ラミンが切断されることで核の構造的完全性が失われる。アポトーシスの初期活性のアッセイにおいて、ラミンの切断はカスパーゼ活性の実験的指標として用いられることもある[19]。カスパーゼによって切断されない変異型ラミンを発現する細胞ではアポトーシスに関連した核の変化はみられないため、ラミンがアポトーシスによる核の解体を開始する役割を担っていることが示唆される[19]。またラミンの重合の阻害は、アポトーシスの誘導因子となる[70]。
核膜は、DNAウイルスやRNAウイルスが核へ進入するのを防ぐ障壁として機能している。いくつかのウイルスは、自身の複製と組み立てを行うために核内のタンパク質へアクセスする必要がある。ヘルペスウイルスなどのDNAウイルスは、核内で複製と組み立てを行い、核の内膜からの出芽によって外部へ出る。この過程は、内膜の核側のラミナの解体を伴っている[19]。
疾患と関連したダイナミクス
かつては、一般的には免疫グロブリン、特に自己抗体は核内へ進入することはないと考えられていた。現在では、全身性エリテマトーデスなどの疾患状態においてはIgGが核に進入することを示す多くのエビデンスが蓄積されている[71]。
Remove ads
一細胞あたりの核の数
通常、真核生物の大部分の細胞種は核を1つだけ持っているが、いくつかには核が存在せず、また他のものは複数の核を持っている。哺乳類の赤血球の成熟のように正常な発生の結果である場合も、細胞分裂時の欠陥から生じている場合もある[72]。
無核細胞

無核細胞には核が存在せず、そのため分裂して娘細胞を生み出すことはできない。最もよく知られた無核細胞は哺乳類の赤血球である。赤血球はミトコンドリアなど他の細胞小器官も欠いており、肺から体中の組織へ酸素を運搬する輸送容器として主にはたらいている。赤血球は骨髄での赤血球形成過程を経て成熟し、そこで核、細胞小器官、リボソームを喪失する。核は赤芽球から網赤血球への分化過程で排出される[73]。変異原の存在下では、一部の未成熟な小核赤血球の血中への放出が誘発される可能性がある[74][75]。無核細胞の形成は、被子植物の師管要素でも生じる[76]。
無核細胞は細胞分裂の欠陥から生じることもあり、一方の娘細胞は無核細胞に、他方は2つの核を持つ細胞となる。
多核細胞
多核細胞は複数の核を持つ細胞である。原生生物のアカンタリアの大部分の種[77]と菌根菌の一部の種[78]は、通常多核である。他の例としては、ジアルジア属の腸管寄生体があり、1細胞当たり2つの核を持つ[79]。繊毛虫は、1細胞に大核と小核という2種類の核を有する[80]。ヒトでは、骨格筋の筋細胞は発生過程で多核細胞となる。核は細胞の周縁部に配置され、筋線維のための細胞内空間が最大化されている[1]。ヒトの他の多核細胞としては骨細胞の一種である破骨細胞が挙げられる。ヒトでは何らかの異常によって多核細胞や二核細胞が形成される場合がある。単球とマクロファージの融合によって形成される細胞は多核巨細胞(multinucleate giant cell)と呼ばれ、炎症を伴い[81]、腫瘍形成への関与も示唆されている[82]。
多くの渦鞭毛藻も2つの核を持つことが知られている。他の多核細胞とは異なり、2つの核はDNAの系統が異なる。1つは渦鞭毛藻のもので、もう1つは共生した珪藻のものである[83]。
Remove ads
進化
要約
視点
核は真核生物の細胞を定義づける主要な特徴であるため、核の進化的起源は多くの思索の対象となってきた。核の存在を説明するために4つの主要な仮説が提唱されているが、どれもいまだ幅広く支持を得るには至っていない[84][85][86]。
第一のモデルは「栄養共生モデル」(syntrophic model) として知られるもので、古細菌と細菌の共生関係が核を持つ真核生物細胞を作り出したと提唱する。古細菌ドメイン・細菌ドメインの生物は核を持たない[87]。現代のメタン菌に似た太古の古細菌が、現代の粘液細菌に似た細菌に侵入して生息したことに起源を持ち、最終的に初期の核が形成されたという仮説が立てられている。この理論は真核生物のミトコンドリアと葉緑体の起源について広く受け入れられている理論(細胞内共生説)と類似したものであり、その理論ではミトコンドリアと葉緑体は原始的な真核生物と好気性細菌との内部共生関係から発展したと考えられている[88]。1つの可能性は、古細菌を宿主とするミトコンドリアが生じ、続いて新たな膜系として核膜が生じたというものである[89]。始原ミトコンドリアによって産生される活性酸素種による損傷から、ゲノムを保護する役割を核膜が果たした可能性がある[90]。核が古細菌起源であることは、古細菌と真核生物がヒストンなど特定のタンパク質について似た遺伝子を持っていることから支持される。そして真核細胞が細菌起源であることは、粘液細菌が運動性であること、多細胞性複合体を形成することができること、真核生物と似たキナーゼやGタンパク質を持つことから支持される[91]。
第二のモデルでは、始原真核生物は細菌から内部共生段階を経ることなく進化したと提唱される。このモデルは現代のプランクトミケス門の細菌の存在に基づいており、これらの細菌には原始的な孔を持つ核構造や他の区画化された膜構造が存在する[92]。同様のモデルでは、chronocyteと呼ばれる真核生物様の細胞が最初に進化し、古細菌や細菌を食作用で取り込んで核や真核細胞が生み出されたという主張がなされている[93]。
最も物議を醸しているモデルは「細胞核ウイルス起源説」と呼ばれるもので、膜に覆われた核や、その他の真核生物の特徴は原核生物にウイルスが感染したことで生じたとしている。この提案は、直鎖状のDNA、mRNAのキャッピングといった、真核生物とウイルスの間の類似性に基づいている。このモデルの1つのバージョンでは、核は食作用と共に進化し、初期の細胞の「捕食者」が形成されたと示唆されている[94]。他のバージョンでは真核生物は初期の古細菌にポックスウイルスが感染したことで生じたと提唱されており、これは現代のポックスウイルスと真核生物のDNAポリメラーゼの類似性に基づいている[95][96]。また、有性生殖の進化という未解決の問題もこの仮説と関連している可能性があると示唆されている[97]。
より近年に提唱されたexomembrane hypothesisでは、核は外側に2つ目の細胞膜を進化させた単一の祖先細胞に起源を持つとされ、内側の膜が元の細胞を包み込んで核膜となり、リボソームサブユニッなど内部で合成される細胞構成要素の通り道として複雑な孔構造が進化したと示唆されている[98]。
Remove ads
歴史
要約
視点


核は最初に発見された細胞小器官である。現存する最古のスケッチはおそらく、初期の顕微鏡学者であったアントニ・ファン・レーウェンフック(1632–1723)によるものである。彼はサケの赤血球細胞の中に"lumen"と呼ばれるものを観察した[99]。哺乳類とは異なり、他の脊椎動物の赤血球には核が存在する[100]。
また、核はオーストリアの植物画家フランツ・バウアーによって1804年に記載され[101]、そしてより詳細はスコットランドの植物学者ロバート・ブラウンによって1831年にロンドン・リンネ協会で発表された。ブラウンは顕微鏡下でランの研究をしている際に、花の外層の細胞に不透明な領域を発見し、それを"areola"または"nucleus"と名付けた[102]。
ブラウンはその領域の機能については示唆しなかったが、1838年にマティアス・ヤーコプ・シュライデンは核が細胞を生み出す役割を持つと提唱し、"cytoblast"(細胞を構築するもの)という名称を導入した。彼は、新たな細胞が"cytoblast"の周辺に集まって形成されるのを観察したと考えていた。フランツ・ユリウス・フェルディナント・マイエンはこの考えに強く反対しており、細胞が分裂によって増殖することをすでに記載していたため、多くの細胞は核を持たないと考えていた。"Cytoblast"であれ何であれ、細胞が「新たに」生じるという考えは、「全ての細胞は細胞から生じる」("Omnis cellula e cellula")という新たなパラダイムを広めるのに決定的な役割を果たしたロベルト・レーマク(1852)やルドルフ・ルートヴィヒ・カール・フィルヒョウ(1855)の業績とも矛盾していた。核の機能は依然として不明なままであった[103]。
1877年から1878年の間に、オスカー・ヘルトヴィヒはウニの発生に関するいくつかの研究を発表し、精子の核が卵母細胞に進入し、その核と融合することを示した。これは、個体が1個の有核細胞から発生することを初めて示唆したものであった。またこれは、個体発生は系統発生を反復する(反復説)、構造を持たない原始的な原形質の塊から最初の有核細胞が発生する、としていたエルンスト・ヘッケルの理論と矛盾するものであった。そのため、発生の開始に精子の核が必要であるかどうかがしばらくの間議論の的となった。しかし、ヘルトヴィヒは両生類や軟体動物など、他の動物群を用いて自身の観察を確証した。エドゥアルト・シュトラスブルガーは、1884年に植物でも同様の結果を得た。ここから、遺伝において核が果たしている重要な役割の理解への道が開かれることとなった。1873年にアウグスト・ヴァイスマンは、遺伝に関しては母系と父系の生殖細胞が等価であると予想した。遺伝情報を運搬するという核の機能は、有糸分裂が発見され、20世紀の初めにメンデルの法則が再発見されてはじめて明らかとなった。その後、遺伝の染色体説が発展した[104]。
Remove ads
出典
関連文献
外部リンク
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads