상위 질문
타임라인
채팅
관점
삼불화 질소
위키백과, 무료 백과사전
Remove ads
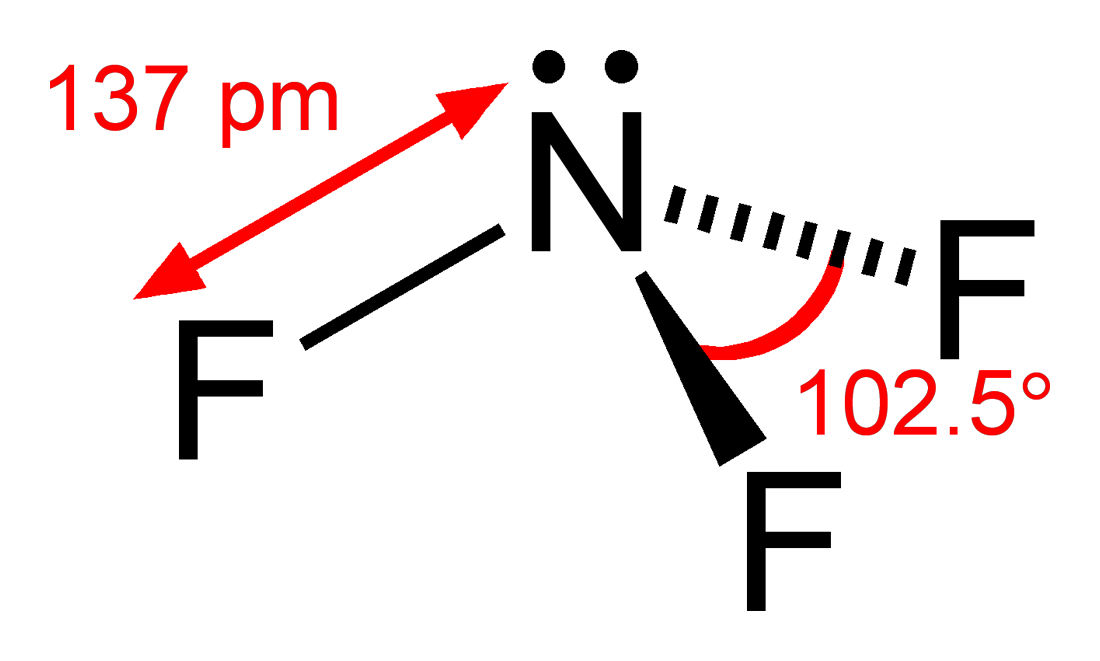
삼불화 질소(Nitrogen trifluoride)는 화학식 (NF
3)을 갖는 무기 화합물이다. 약간 곰팡이 냄새가 나는 무색의 비-가연성, 독성 가스이다. 암모니아와 달리 비염기성이다. 평판 디스플레이, 광전지, LED 및 기타 마이크로일렉트로닉스 제조에서 사용이 증가하고 있다.[6] NF
3는 100년 동안 비교했을 때 CO
2보다 17,200배 더 큰 지구 온난화 지수(GWP)를 가진 온실 기체이다.[7][8][9]
Remove ads
합성 및 반응성
삼불화 질소는 전기 방전 존재하에 원소로부터 제조될 수 있다.[10] 1903년, 오토 러프는 용융된 플루오린화 암모늄과 플루오린화 수소 혼합물의 전기 분해로 삼불화 질소를 제조했다.[11] 이것은 폭발성인 다른 질소 삼할로젠화물인 삼염화 질소, 삼브로민화 질소, 아이오딘화 질소보다 훨씬 반응성이 낮다. 질소 삼할로젠화물 중 유일하게 음의 생성 엔탈피를 갖는다. 현대에는 암모니아와 플루오린의 직접 반응과 러프 방법의 변형을 통해 제조된다.[6] 가압 실린더에 공급된다.
NF
3는 물에 약간 용해되지만 화학 반응을 겪지 않는다. 0.2340 D의 낮은 결합 쌍극자 모멘트를 가진 비염기성이다. 대조적으로, 암모니아는 염기성이며 고도로 극성이다 (1.47 D).[12] 이러한 대조는 H와 F의 서로 다른 전기음성도를 반영한다.
이산소와 유사하게, NF3는 강력하지만 느린 산화제이다.[6] 염화 수소를 염소로 산화시킨다:
- 2 NF3 + 6 HCl → 6 HF + N2 + 3 Cl2
그러나 고온에서만 유기 화합물을 (폭발적으로) 공격한다. 따라서 표준 조건에서 여러 플라스틱뿐만 아니라 강철 및 모넬과 호환된다.[6]
200-300 °C 이상에서 NF3는 금속, 탄소 및 기타 시약과 반응하여 테트라플루오로하이드라진을 생성한다.[13]
- 2NF
3 + Cu → N
2F
4 + CuF
2
NF3는 플루오린 및 오플루오린화 안티모니와 반응하여 테트라플루오로암모늄 염을 생성한다.[6]
- NF3 + F2 + SbF5 → NF+
4SbF−
6
NF3와 B2H6는 극저온에서도 격렬하게 반응하여 질소, 삼플루오르화 붕소 및 플루오린화 수소산을 생성한다.[14]
Remove ads
응용
DRAM 컴퓨터 메모리 생산, 평판 디스플레이 제조 및 박막 태양 전지 대규모 생산과 같은 대용량 응용 분야에서는 NF
3를 사용한다.[15][16]
에칭
삼불화 질소는 주로 LCD 디스플레이, 일부 박막 태양 전지 및 기타 마이크로일렉트로닉스와 같은 반도체 장치 제조 중 규소 및 규소 화합물을 제거하는 데 사용된다. 이러한 응용 분야에서 NF
3는 처음에 플라스마 내에서 분해된다. 생성된 플루오린 유리기는 폴리실리콘, 질화 규소 및 산화 규소를 공격하는 활성제이다. 또한 규소화 텅스텐, 텅스텐 및 특정 기타 금속을 제거하는 데 사용될 수 있다. 장치 제작에서 에천트 역할을 하는 것 외에도 NF
3는 PECVD 챔버를 청소하는 데 널리 사용된다.
NF
3는 과불소화합물(PFC) 및 육플루오린화 황(SF
6)에 비해 저압 방전 내에서 더 쉽게 해리된다. 생성되는 음전하를 띠는 유극기의 풍부함은 더 높은 규소 제거율을 가져오고 잔류 오염 감소 및 제조되는 장치에 대한 낮은 순 전하 스트레스와 같은 다른 공정 이점을 제공할 수 있다. 보다 철저하게 소비되는 에칭 및 세정제로서 NF3는 육플루오로에탄과 같은 SF
6 또는 PFC를 대체하는 환경적으로 선호되는 대안으로도 홍보되었다.[17]
플라스마 처리 공정에 적용되는 화학 물질의 활용 효율은 장비 및 응용 분야에 따라 크게 달라진다. 반응물의 상당 부분은 배출 흐름으로 낭비되어 궁극적으로 지구 대기로 배출될 수 있다. 최신 저감 시스템은 대기 배출을 실질적으로 줄일 수 있다.[18] NF
3는 심각한 사용 제한의 대상이 되지 않았다. 관찰된 대기 성장과 국제 교토 의정서에 대한 대응으로 많은 산업화된 국가에서는 대규모 제조업체에 의해 NF
3 생산, 소비 및 폐기물 배출에 대한 연간 보고가 요구되었다.[19]
고독성 플루오린 가스 (F2, 이원자 플루오린)는 일부 제조 응용 분야에서 삼불화 질소의 기후 중립 대체 물질이다. 특히 제조 직원을 보호하기 위해 더 엄격한 취급 및 안전 예방 조치가 필요하다.[20]
삼불화 질소는 불화수소 및 중수소 불화 레이저에도 사용되는데, 이는 화학 레이저의 일종이다. 여기서도 취급이 더 편리하기 때문에 플루오린 가스보다 선호된다.
Remove ads
온실 기체
요약
관점

NF
3의 GWP는 교토 의정서에서 인정하는 온실 기체 그룹 중 SF
6에 이어 두 번째이며, NF
3는 2013년부터 발효된 교토 의정서 2차 공약 기간부터 해당 그룹에 포함되었다. 추정되는 대기 수명은 740년이지만[7], 다른 연구에서는 550년으로 약간 짧은 수명(및 그에 상응하는 16,800의 GWP)을 제시한다.[15]


1992년에는 100톤 미만이 생산되었지만, 2007년에는 약 4000톤으로 생산량이 증가했으며 앞으로도 크게 증가할 것으로 예상된다.[15] 2010년까지 NF3의 전 세계 생산량은 연간 8000톤에 달할 것으로 예상된다. 현재까지 세계에서 가장 큰 NF
3 생산 업체는 미국의 산업 가스 및 화학 회사인 에어 프로덕츠 앤 케미컬스이다. 생산된 NF
3의 약 2%가 대기로 방출되는 것으로 추정된다.[23][24] 롭슨은 최대 대기 농도가 부피 기준으로 0.16ppt(1조 분의 1) 미만이며, 이는 0.001Wm−2 미만의 적외선 강제력을 제공할 것으로 예상했다.[25]
NF3의 평균 전 지구 대류권 농도는 1980년 약 0.02ppt(1조 분의 1, 건조 공기 몰 분율)에서 2011년 0.86ppt로 증가했으며, 연간 증가율은 0.095ppt yr−1, 즉 연간 약 11%였다. 이는 예상대로 배출이 주로 북반구에서 발생하고 있음을 시사하는 남북 반구 간 농도 차이가 일관되게 나타났다. 2011년의 이러한 증가율은 전 세계적으로 연간 약 1200톤의 NF3 배출에 해당하며, 이는 NF3 전 세계 생산량 추정치의 약 10%에 해당한다. 이는 업계에서 추정한 것보다 훨씬 높은 비율이므로, NF3 생산량을 재고하고 배출량을 규제해야 할 필요성을 더욱 강조한다.[26]
산업계 대표들이 공동 저술한 한 연구에 따르면 박막 Si 태양 전지 제조의 전체 온실 기체 예산에 NF3 배출량이 기여하는 바가 명확하다.[27]
UNFCCC는 교토 의정서의 맥락에서 2012년부터 시작하여 2017년 또는 2020년에 끝나는 교토 의정서 두 번째 이행 기간에 삼불화 질소를 포함하기로 결정했다. 이에 따라 WBCSD/WRI GHG 프로토콜은 모든 표준(기업, 제품 및 스코프 3)을 수정하여 NF3도 포함하도록 하고 있다.[28]
안전
NF
3와의 피부 접촉은 위험하지 않으며, 점막과 눈에 비교적 경미한 자극제이다. 질소 산화물보다 훨씬 낮은 독성도를 가진 폐 자극제이며, 흡입을 통한 과다 노출은 혈액 내 헤모글로빈을 메트헤모글로빈으로 전환시켜 메트헤모글로빈혈증을 유발할 수 있다.[29] 미국 국립 직업안전위생연구소(NIOSH)는 생명이나 건강에 즉각적으로 위험한 농도(IDLH 값)를 1,000ppm으로 지정한다.[30]
같이 보기
- IPCC 온실 기체 목록
- 오플루오린화 질소
- 테트라플루오로하이드라진
내용주
각주
외부 링크
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads