상위 질문
타임라인
채팅
관점
탄소-탄소 결합
위키백과, 무료 백과사전
Remove ads
탄소-탄소 결합(영어: Carbon–carbon bond)은 두 탄소 원자 사이의 공유 결합이다.[1] 가장 일반적인 형태는 단일 결합으로, 두 원자 각각에서 온 두 전자로 구성된 결합이다. 탄소-탄소 단일 결합은 시그마 결합이며, 각 탄소 원자의 혼성 궤도 사이에서 형성된다. 에테인에서 궤도는 sp3-혼성 궤도이지만, 다른 혼성화를 가진 탄소 원자들 사이에서도 단일 결합이 형성될 수 있다(예: sp2와 sp2). 사실, 단일 결합 내의 탄소 원자는 같은 혼성화를 가질 필요는 없다. 탄소 원자는 또한 알켄이라고 불리는 화합물에서 이중 결합을 형성하거나 알카인이라고 불리는 화합물에서 삼중 결합을 형성할 수 있다. 이중 결합은 sp2 혼성 궤도와 혼성화에 참여하지 않는 p-궤도로 형성된다. 삼중 결합은 sp 혼성 궤도와 각 원자에서 온 두 개의 p-궤도로 형성된다. p-궤도의 사용은 파이 결합을 형성한다.[2]
Remove ads
사슬과 가지
탄소는 자체 원자들의 긴 사슬을 형성할 수 있는 몇 안 되는 원소 중 하나이며, 이 특성을 고리화라고 한다. 이 특성과 탄소-탄소 결합의 강도가 결합되어 엄청난 수의 분자 형태가 생성되며, 이들 중 다수는 생명체의 중요한 구조적 요소이다. 따라서 탄소 화합물은 유기화학이라는 고유한 연구 분야를 가지고 있다.

C−C 골격에서도 가지가 흔하다. 분자 내 탄소 원자는 이웃 탄소 원자의 수에 따라 분류된다.
"구조적으로 복잡한 유기 분자"에서 분자의 모양을 결정하는 것은 사차 중심에서의 탄소-탄소 결합의 3차원적 방향이다.[3] 또한, 사차 중심은 코르티손과 모르핀과 같이 생물학적으로 활성인 많은 작은 분자에서 발견된다.[3]
Remove ads
합성
탄소-탄소 결합 형성 반응은 새로운 탄소-탄소 결합이 형성되는 유기 반응이다. 이 반응들은 의약품과 플라스틱과 같은 많은 인공 화학 물질 생산에 중요하다. 탄소-탄소 결합이 끊어지는 역반응은 탄소-탄소_결합_활성화로 알려져 있다.
탄소-탄소 결합을 형성하는 반응의 몇 가지 예로는 알돌 반응, 딜스-알더 반응, 그리냐르 반응, 교차 결합 반응, 마이클 반응 및 비티히 반응이 있다.
삼차 탄소의 원하는 3차원 구조에 대한 직접적인 합성은 20세기 후반에 대체로 해결되었지만, 사차 탄소 합성에도 비슷한 능력이 나타나기 시작한 것은 21세기 첫 10년에 이르러서였다.[3]
결합력 및 길이
탄소-탄소 단일 결합은 C–H, O–H, N–H, H–H, H–Cl, C–F 및 많은 이중 또는 삼중 결합보다 약하고, C–O, Si–O, P–O, S–H 결합과 유사한 강도를 가지지만,[4] 일반적으로 강하다고 간주된다.
위에 주어진 값은 일반적으로 나타나는 C–C 결합 해리 에너지를 나타내며, 때로는 이 범위를 크게 벗어나는 예외가 있을 수 있다.
극단적인 경우
길고 약한 C–C 단일 결합
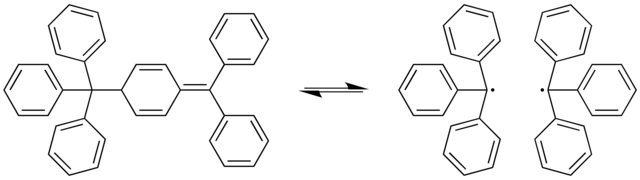
C–C 결합이 늘어나는 다양한 극단적인 경우가 확인되었다. 곰베르그의 이합체에서 한 C–C 결합은 159.7 피코미터로 상당히 길다. 이 결합은 용액에서 실온에서 가역적으로 쉽게 끊어진다.[6]
훨씬 더 혼잡한 분자인 헥사키스(3,5-다이-터트-부틸페닐)에테인에서는 안정화된 트라이아릴메틸 라디칼을 형성하는 결합 해리 에너지가 8 kcal/mol에 불과하다. 또한 심한 입체적 혼잡의 결과로, 헥사키스(3,5-다이-터트-부틸페닐)에테인은 길이가 167 pm로 크게 늘어난 중앙 결합을 가지고 있다.[7]
비틀리고 약한 C–C 이중 결합
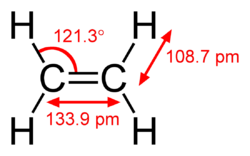
테트라키스(다이메틸아미노)에틸렌 (TDAE)의 구조는 매우 왜곡되어 있다. 두 N2C 말단의 이면각은 C=C 거리가 정상인 135 pm임에도 불구하고 28º이다. 거의 등구조인 테트라아이소프로필에틸렌도 C=C 거리가 135 pm이지만, 그 C6 코어는 평면이다.[8]
짧고 강한 C–C 삼중 결합
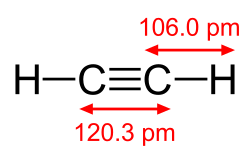
반대 극단에서, 다이아세틸렌의 중심 탄소-탄소 단일 결합은 두 sp 혼성화 탄소를 연결하기 때문에 160 kcal/mol로 매우 강하다.[9] 탄소-탄소 다중 결합은 일반적으로 더 강하며, 에틸렌의 이중 결합과 아세틸렌의 삼중 결합은 각각 174 및 230 kcal/mol의 결합 해리 에너지를 가지는 것으로 결정되었다.[10] 강한 전자 흡인성 아이오도늄 부분으로 인해 요오도늄 종 [HC≡C–I+Ph] [CF3SO3–]에서 115 pm의 매우 짧은 삼중 결합이 관찰되었다.[11]
Remove ads
같이 보기
각주
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads