Azotasta kiselina
From Wikipedia, the free encyclopedia
Remove ads
Azotasta kiselina (nitritna kiselina) je jedinjenje sa molekulskom formulom HNO2). Ona je slaba i monobazina kiselina koja je poznata samo u rastvoru i u obliku nitritnih soli.[6][7]
Azotasta kiselina se koristi za pravljenje diazida iz amina. Do toga dolazi nukleofilnim napadom amina na nitrit, reprotonacijom uz pomoć rastvarača, i dvostrukom eliminacijom u vodi. Diazid se zatim oslobađa i daje karben ili karbenoid.
Remove ads
Struktura
U gasovitoj fazi, planarni molekul azotaste kiseline može da poprimi cis i trans formu. Trans forma je predominatna na sobnoj temperaturi, i IR merenja ukazuju da je stabilnija za oko 2.3 kJ mol−1.[8]
 | 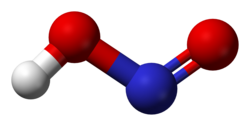 |  |
(sa mikrotalanog spektra) |
Priprema
Azotasta kiselina se pravi opreznom zakišeljavanjem hladnih razblaženih rastvora nitritnog jona, NO2−. Slobodna azotasta kiselina je nestabilna i brzo se razlaže.
Razlaganje
Osim u veoma razblaženim, hladnim rastvorima, azotasta kiselina se brzo razlaže u azot dioksid, azot monoksid, i vodu:
- 2 HNO2 → NO2 + NO + H2O
Azot dioksid se disproporcioniše u azotnu kiselinu i azotastu kiselinu u vodenom rastvoru:[9]
- 2 NO2 + H2O → HNO3 + HNO2
U toplim ili koncentrisanim rastvorima, sveukupna reakcija dovodi do formiranja azotne kiseline, vode, i azot oksida:
- 3 HNO2 → HNO3 + 2 NO + H2O
Reference
Vanjske veze
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads

