Hidrazin
From Wikipedia, the free encyclopedia
Remove ads
Hidrazin (diazan) neorgansko jedinjenje je sa formulom N2H4. On je bezbojna zapaljiva tečnost sa mirisom sličnom amonijaku. Hidrazin je veoma toksičan i veoma je nestabilan, osim ako se njime rukuje u rastvoru. Godine 2002. je proizvedeno oko 260.000 tona.[12] Hidrazin se uglavnom koristi kao agens za formiranje pene u pripremi polimernih pena, a nalazi i znatnu primenu kao prekurzor za polimerizacione katalizatore i lekove. Osim toga, hidrazin se koristi u raznim raketnim gorivima i za pripremu gasnih prekurzora koji se koriste u vazdušnim jastucima. Hidrazin se koristi u nuklearnim i konvencionalnim elkctričnim centralama u sistemima vodene pare kao sakupljač kiseonika, kojim se kontrolišu koncentracije rastvorenog kiseonika radi redukovanja korozije.
Remove ads
Molekulska struktura i osobine
Hidrazin formira monohidrat koji ima veću gustinu (1,032 g/cm3) od anhidratnog materijala.
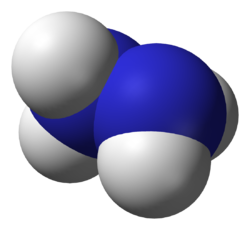
Hidrazin se može formirati iz dva molekula amonijaka uklanjanjem jednog vodonika po molekulu. Svaka H2N-N podjedinica je piramidalnog oblika. N-N rastojanje je 1,45 Å (145 pm), i molekul poprima gauche konformaciju.[13] Rotaciona barijera dva puta veća od etana. Ova strukturna svojstva su slična gasovitom vodonik peroksidu, koji poprima zakrivljenu antiklinalnu konformaciju, i takođe ima jaku rotacionu barijeru.
Hidrazin ima bazna (alkalna) hemijska svojstva, slična amonijaku:
- N2H4 + H2O → [N2H5]+ + OH−
sa vrednostima:[14]
- Kb = 1,3 x 10−6
- pKa = 8,1
(za amonijak Kb = 1,78 x 10−5)
Hidrazin se teško deprotonuje:[15]
- [N2H5]+ + H2O → [N2H6]2+ + OH− Kb = 8.4 x 10−16
Toplota sagorevanja hidrazina u kiseoniku (vazduhu) je 194,1 x 105 J/kg (9345 BTU/lb).[16]
Remove ads
Reference
Literatura
Povezano
Vanjske veze
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads