குரோமியம் மூவாக்சைடு
From Wikipedia, the free encyclopedia
Remove ads
குரோமியம் மூவாக்சைடு (Chromium trioxide) என்பது CrO3 என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு கனிம வேதியியல் சேர்மமாகும். குரோமியம் டிரையாக்சைடு என்றும் அழைக்கப்படும் இச்சேர்மம் குரோமிக் அமிலத்தின் அமிலநீரிலி வகை உப்பாகும். சிலசமயங்களில் இதே பெயரில் வர்த்தகரீதியாகவும் இச்சேர்மம் விற்பனை செய்யப்படுகிறது[6]. நீரற்றநிலையில் குரோமியம் மூவாக்சைடு அடர் ஊதா நிறத்தில் திண்மமாகவும் ஈரமான நிலையில் பிரகாசமான ஆரஞ்சு நிறத்திலும் காணப்படுகிறது. நிராற்பகுப்பு வினையின்போது உடனிகழ்வாக நீரில் கரைகிறது. மின்முலாம் பூசும் பயன்பாட்டிற்காக ஒவ்வோர் ஆண்டும் மில்லியன் கிலோகிராம்கள் கணக்கில் உற்பத்தி செய்யப்படுகிறது[7]. வலிமையான ஆக்சிசனேற்றியான குரோமியம் மூவாக்சைடு ஒரு புற்றுநோய்க் காரணி என்றும் சந்தேகிக்கப்படுகிறது.
Remove ads
தயாரிப்பு
சோடியம் குரோமேட்டு அல்லது அதனுடன் தொடர்புடைய சோடியம் டைகுரோமேட்டுடன் கந்தக அமிலம் சேர்த்து சூடுபடுத்துவதன் மூலமாக குரோமியம் மூவாக்சைடு தயாரிக்கமுடியும்:[6]
- H2SO4 + Na2Cr2O7 → 2 CrO3 + Na2SO4 + H<
இம்முறையிலேயே பெரும்பான்மையான அளவில் குரோமியம் மூவாக்சைடு தயாரிக்கப்படுகிறது.[7]
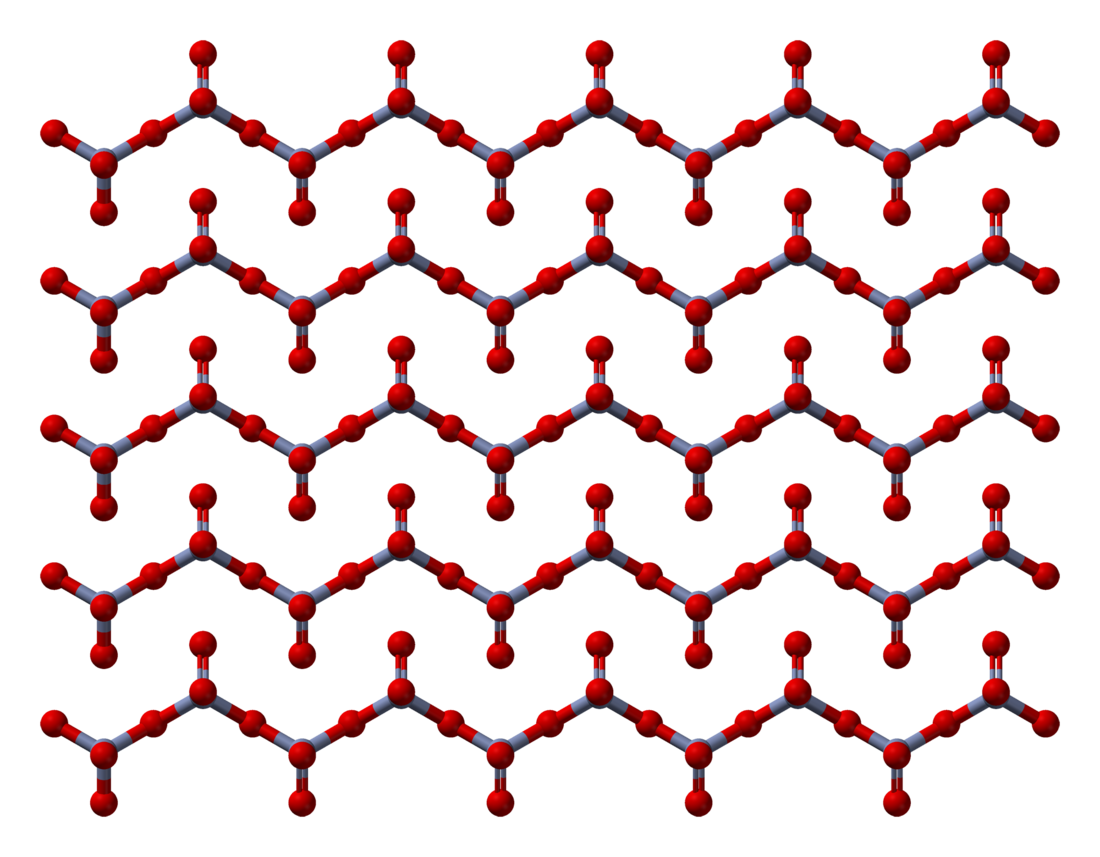
கட்டமைப்பு
திண்ம நிலை குரோமியம் மூவாக்சைடின் கட்டமைப்பானது, உச்சிகளைப் பகிர்ந்து கொள்கின்ற, நான்முக வடிவத்தில் ஒருங்கிணைக்கப்பட்ட குரோமியம் அணு சங்கிலிகளைக் கொண்டுள்ளது. இதனால் ஒவ்வொரு குரோமியம் மையமும் அடுத்துள்ள இரண்டு ஆக்சிசன் மையங்களைப் பகிர்து கொள்கின்றன. பகிர்ந்து கொள்ளாத ஆக்சிசன் அணுக்கள் ஒட்டுமொத்தமாக 1:3 என்ற விகிதவியல் அளவைத் தருகின்றன[8][9]
அடர்த்திச் சார்பு கோட்பாட்டின்படி கணக்கிடப்பட்ட ஒற்றைப்படி குரோமியம் மூவாக்சைடின் கட்டமைப்பானது, D3h இடக்குழு வகை சமதள வடிவத்திற்கு மாறாக C3v இடக்குழு வகை பட்டைக்கூம்பாக இருக்குமென முன்கணிக்கப்பட்டது[10]
Remove ads
வினைகள்
197 பாகை செல்சியசு வெப்பநிலைக்கு மேல் குரோமியம் மூவாக்சைடு சிதைவடைகிறது. அவ்வாறு சிதையும் போது ஆக்சிசனை வெளியேற்றி முடிவாக குரோமியம்(III) ஆக்சைடைத் தருகிறது
- 4 CrO3 → 2 Cr2O3 + 3 O2
கரிம வேதியியல் தொகுப்பு வினைகளில் குரோமியம் மூவாக்சைடு ஒரு ஆக்சிசனேற்றியாகப் பயன்படுத்தப்படுகிறது. பெரும்பாலும் அசிட்டிக் அமிலத்தில் ஒரு கரைசலாகவும் அல்லது யோன்சு ஆக்சிசனேற்ற வினையெனில் அசிட்டோனில் ஒரு கரைசலாகவும் இது பயன்படுகிறது. இவ்வாக்சிசனேற்ற வினைகளில் Cr(VI) முதல்நிலை ஆல்ககால்களை அவற்றுடன் தொடர்புடைய கார்பாக்சிலிக் அமிலங்களாகவும் இரண்டாம்நிலை ஆல்ககால்களை கீட்டோன்களாகவும் மாற்றுகிறது.
முதல்நிலை ஆல்ககால்கள்
- 4 CrO3 + 3 RCH2OH + 12 H+ → 3 RCOOH + 4 Cr3+ + 9 H2O
இரண்டாம்நிலை ஆல்ககால்கள்
- 2 CrO3 + 3 R2CHOH + 6 H+ → 3 R2C=O + 2 Cr3+ + 6 H2O
பயன்பாடுகள்
குரோமியம் மூவாக்சைடு முக்கியமாக குரோம் முலாம் பூசுவதில் பயன்படுத்தப்படுகிறது. பொதுவாக முலாம் செயல்முறையைப் பாதிக்கும் கூட்டுப்பொருளாக இச்சேர்மம் கருதப்பட்டாலும் மூவாக்சைடுடன் இது வினைபுரிவதில்லை. காட்மியம், துத்தநாகம் மற்றும் பிற உலோகங்களுடன் மூவாக்சைடு வினைபுரிந்து அரிமானத்தை முடக்குகின்ற குரோமேட்டு படலங்களை உருவாக்குகிறது. செயற்கை மாணிக்கக் கற்கள் தயாரிப்பிலும் குரோமியம் மூவாக்சைடு பயன்படுத்தப்படுகிறது. விண்வெளி பயன்பாடுகளுக்கு பயன்படுத்தப்படும் அலுமினியத்தில் குரோமிக் அமிலக் கரைசல் நேர்மின்முனைப்படலப் பூச்சாகவும் பூசப்படுகிறது. அனைத்து வகையான நேர்மின்முனை பூச்சுகளையும் நீக்கும் முகவராக குரோமிக் அமிலம்/ பாசுபாரிக் அமிலக் கரைசல் செயல்படுகிறது.
Remove ads
பாதுகாப்பு
குரோமிக் மூவாக்சைடு ஒரு உயர் நச்சுத்தன்மை வாய்ந்த சேர்மமாகும். அரிக்கும் தன்மையும் புற்றுநோய் உருவாக்கும் தன்மையும் கொண்டுள்ளது.[11] ஆறிணைதிறன் குரோமியத்திற்கு உதாரணமாக உள்ள இச்சேர்மம் சுற்றுச்சூழலுக்கு தீங்கு விளைவிக்கும் சேர்மமாகக் கருதப்படுகிறது. தொடர்முடைய குரோமியம்(III) வழிப்பொருட்கள் ஆபத்தானவையல்ல. இவை குறைப்பானாகச் செயல்பட்டு ஆறினைய குரோமியம் உப்புகளை அழிக்கின்றன.
வலிமையான ஆக்சிசனேற்றியாக இருப்பதால் ஆல்ககால்கள் போன்ற கரிம வேதியியல் பொருட்களுடன் தொடர்பு கொள்ள நேரிட்டால் தீப்பற்றிக் கொள்கிறது.
Remove ads
படங்கள்
- நீரில் பொட்டாசியம் டைகுரோமேட்டின் அடர் கரைசல்.
- கரைசலில் கந்தக அமிலம் சேர்க்கப்படுதல்.
- வினையில் குரோமியம் மூவாக்சைடு படிகமாக்கப்படுகிறது.
- எத்தனாலும் குரோமியம் மூவாக்சைடும் வினை.
மேற்கோள்கள்
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads