Топ питань
Часова шкала
Чат
Перспективи
Ксилени
З Вікіпедії, вільної енциклопедії
Remove ads
Ксиле́ни, ксило́ли (від грец. ξύλον, xylon — деревина) — органічні сполуки ряду аренів, ізомери складу C6H4(CH3)2. Залежно від взаємного розташування метильних груп у бензеновому ядрі розрізняють: орто-ксилен (1,2-диметилбензен), мета-ксилен (1,3-диметилбензен) і пара-ксилен (1,4-диметилбензен).
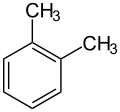 | 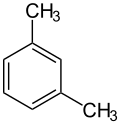 |  |
| о-ксилен | м-ксилен | п-ксилен |
Історія
Ксилени вперше були виділені 1850 року французьким хіміком Огюстом Кауром з неочищеного деревного спирту. В 1855 році їх отримали з кам'яновугільної смоли німецький біохімік Карл Генріх Ріттхаузен і британський хімік Артур Герберт Черч.
У проміжку з 1865 по 1869 роки Фіттіг та Ернст з'ясували, що виділена зі смоли речовина «ксилен» не є однією сполукою. Для перевірки цієї теорії вони синтезували ксилен з толуену, назвавши його метилтолуен (пізніше стало відомо, що ним є пара-ксилен). Після порівняння властивостей отриманого «метилтолуену» та «ксилену» дослідники дійшли до висновку, що присутні сполуки мають різні положення метильної групи.
У 1865 році Фіттіг розробив метод синтезу ксилену, що полягав у перегонці кальцієвої солі 2,4,6-триметилбензойної (мезитойної) кислоти. І хоча отримана сполука виявляла властивості, подібні до раніше отриманих «ксилену» та «метилтолуену», вона не була ідентичною до них. Її назвали ізоксилен (мета-ксилен). В ході подальших досліджень Фіттіг ідентифікував третій ізомер — орто-ксилен, що був виділений з кам'яновугільної смоли Оскаром Якобсоном у 1877 році.
Remove ads
Поширення у природі
Цей розділ потребує доповнення. (березень 2016) |
Основним джерелом ксиленів у природі є нафта. Також для їхнього добування застосовується вугілля.
Фізичні властивості
Отримання
Каталітичний риформінг
Ксилени (переважно пара- та орто) отримують з легких фракцій (температурою 65—170 °C).
Отримання з толуену
Толуен диспропорціонує з утворенням бензену і ксилену (переважно пара- та орто-):
Також він отримує метильну групу внаслідок трансалкілювання при взаємодії з алкілбензенами, що мають більший бічний ланцюг, в тому числі з етилбензеном.
Інші методи
Ксилени можна синтезувати шляхом алкілювання бензенового ядра за реакцією Фріделя — Крафтса:
Введення другої метильної групи здійснюється за орто- або пара-положеннями, оскільки перший метильний замісник є орієнтантом першого роду.
Складність синтезу шляхом алкілювання полягає в тому, що продукти мають здатність ізомеризуватися, особливо за великого надлишку каталізаторів. Так, п- і о-ксилени можуть ізомеризуватися до м-ксилену[1].
Remove ads
Хімічні властивості
Узагальнити
Перспектива
Хімічні властивості ксиленів більшою мірою визначаються наявність метильних груп.
Окиснення
При окисненні ксиленів відбуваються переважно перетворення CH3-груп. Так, при взаємодії з сильними окисниками типу дихроматів, перманганатів, метильні групи окиснюються до карбоксильних. Ця реакція має широке значення в отриманні промислово важливої терефталевої кислоти (бензен-1,4-діової) з п-ксилену.
Окрім того є можливим проведення неповного окиснення метильних груп — за допомогою суміші оксиду хрому(VI) та оцтового ангідриду. Окиснення проходить лише до стадії отримання альдегідних груп, оскільки подальший процес є неможливим через приєднання до атомів Карбону ацильних груп, які за даних умов є стійкими. Подальшим кислотним гідролізом отримують ароматичний діальдегід[2].
Окремий випадок складає каталітичне окиснення о-ксилену до фталевого ангідриду:
До випадків окиснення бензенового кільця можна віднести озоноліз ксиленів — відбувається розрив подвійних зв'язків та утворення простіших оксосполук. Наприклад, при озонолізі о-ксилену утворюються гліоксаль, метилгліоксаль і діацетил у співвідношенні 3:2:1[3].
Відновлення
Повне відновлення (гідрування) ксиленів іде з утворенням диметилциклогексанів. При цьому утворюється суміш цис- і транс-ізомерів, що відрізняються положенням CH3-груп по відношенню до площини бензенового кільця. При гідруванні на твердих каталізаторах переважними є цис-ізомери — це пов'язано із цис-розташуванням метильних груп при закріпленні на поверхні каталізатору. Так, продуктами гідрування на родієвому каталізаторі (при 100 °C, 30 атм) є цис- і транс-ізомери у співвідношенні 9:1[4].
Неповне відновлення ксиленів проходить із утворенням заміщених циклогексадієнів. Таку реакцію можна здійснити відновленням натрієм в рідкому аміаці (відновлення за Берчем)[5]:
У промисловості відновлення ксиленів як нафтової сировини застосовують для отримання бензену: при високих температурах відбувається деметилювання, що веде до утворення бензену і метану[6]:
Галогенування
Подібно до толуену, галогенування ксиленів відбувається за вільнорадикальним механізмом, у бічний ланцюг. Взаємодія з хлором та бромом при наявності сонячного світла веде до утворення моно- і дигалогенопохідних[7].
Remove ads
Токсичність
Потрапляння ксиленів до організму можливе шляхом інгаляції або резорбції крізь шкіру.
Їхня повторювана дія спричинює подразнення дихальних шляхів та слизових оболонок. Контактуючи зі шкірою, вони можуть залишати пухирці і провокувати дерматит. При концентрації у повітрі від 100 до 1000 см³/м³ ксилени подразнюють ЦНС, наслідками чого можуть бути сповільнена реакція, головний біль, нудота. Також спостерігаються зміни кров'яного тиску. Дія ксиленів у великих дозах (близько 10 000 см³/м³) призводить до набряку легень і подальшої смерті.
Тривала дія ксиленів призводить до сильного пошкодження ЦНС, внаслідок чого з'являється порушення сну, диспепсія. Усі симптоми є зворотніми. Окрім поступового збільшення толерантності до подразника, може також спостерігатися звикання (ксилени демонструють пренаркотичну і наркотичну дії).
Ксилени не проявляють явних канцерогенних і мутагенних властивостей. У довготермінових експериментах з пацюками дія ксиленів мала незначний вплив на розвиток плоду.
Remove ads
Застосування
Основна частина ксиленів (які здебільшого отримують за допомогою риформінгу) застосовується як додатки до пального. пара-Ксилен має найбільше практичне значення — з нього синтезують терефталеву кислоту, що йде на виробництво диметилтерефталату і поліетилентерефталату. Отримуваний орто-ксилен є прекурсором для отримання фталевого ангідриду — компоненту пластифікаторів. Також з орто-ксилену синтезують фталонітрил, котрий використовується в отриманні барвників фталоціанів. Мета-ксилен може використовуватися для синтезу ізофталевої кислоти, що йде на отримання поліестерів, ізофталонітрилу та його похідної — фунгіциду тетрахлороізофталонітрилу, однак загалом він не має значного застосування, тому основну його частину ізомеризують з метою добування інших ксиленів.
Ксилени можуть використовуватися в ролі розчинників та компонентів покриттів, але це застосування не є поширеним через їхню небезпеку для довкілля.
Розчин ксилену використовують для депарафінізації при виділення ДНК з архівних тканин, що були фіксовані в формальдегіді та залучені в парафіновий блок.
Remove ads
Див. також
Вікісховище має мультимедійні дані за темою: Ксилени
Примітки
Джерела
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads




