Топ питань
Часова шкала
Чат
Перспективи
Непротеїногенні амінокислоти
клас хімічних сполук З Вікіпедії, вільної енциклопедії
Remove ads
У біохімії некодовані або непротеїногенні амінокислоти відрізняються від 22 протеїногенних амінокислот (21 в еукаріот[1]), які природним чином закодовані в геномі організмів для формування білків. Проте понад 140 непротеїногенних амінокислот зустрічаються в білках природним шляхом, і тисячі інших можуть зустрічатися в природі або синтезуватися в лабораторії[2]. Хімічно синтезовані амінокислоти можна назвати неприродними амінокислотами. Неприродні амінокислоти можуть бути отримані синтетичним шляхом з їхніх нативних аналогів за допомогою модифікацій, таких як алкілування аміном, заміна бічного ланцюга, циклізація подовження структурного зв’язку та ізостерична заміна в амінокислотному скелі[3]. Багато непротеїногенних амінокислот є важливими:
- проміжні продукти біосинтезу,
- у посттрансляційному утворенні білків,
- у фізіологічній ролі (наприклад, компоненти стінок бактеріальних клітин, нейромедіатори та токсини),
- природні або створені людиною фармакологічні сполуки,
- міститься в метеоритах або використовується в пребіотичних експериментах (таких як експеримент Міллера-Юрі),
- можуть бути важливими нейромедіаторами, такими як γ-аміномасляна кислота[4] і
- може відігравати вирішальну роль у клітинній біоенергетиці, наприклад креатин[5].

Remove ads
Означення шляхом заперечення
Узагальнити
Перспектива

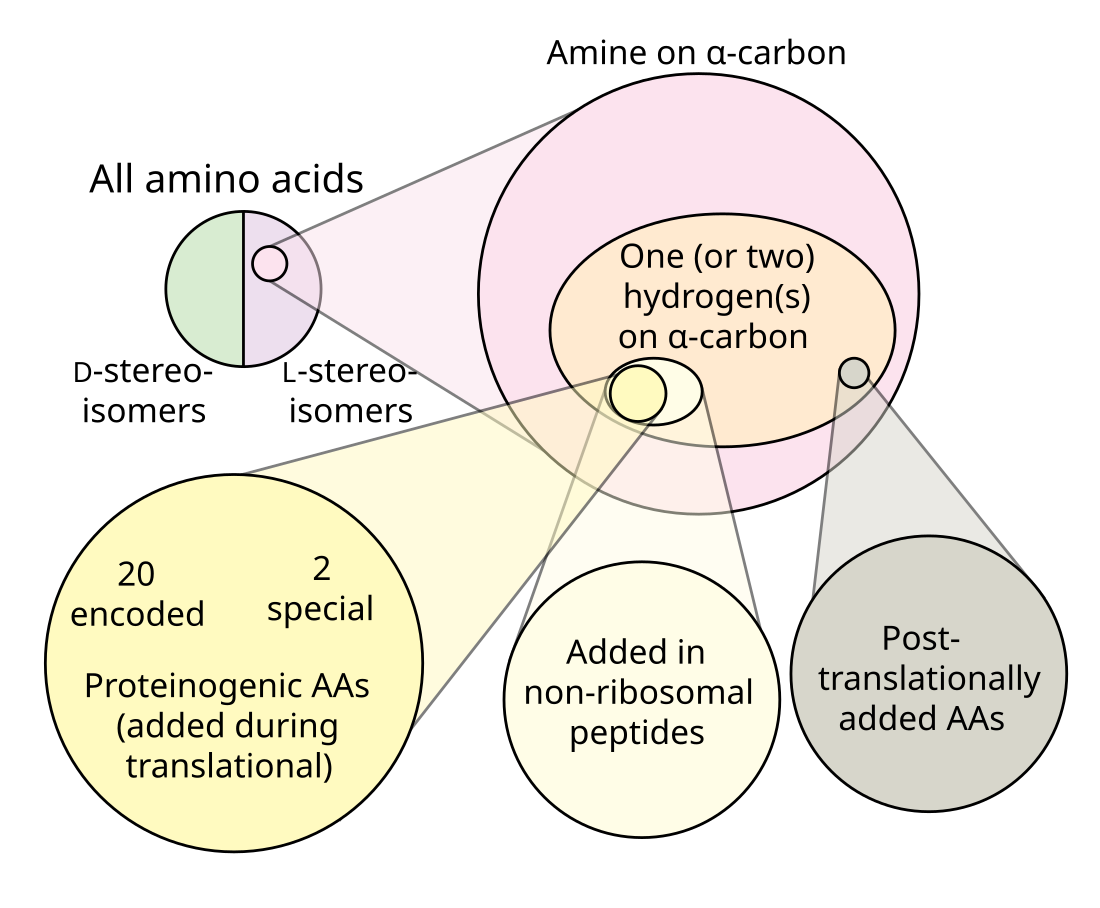
Технічно будь-яка органічна сполука з функціональною групою аміну (–NH2) і карбонової кислоти (–COOH) є амінокислотою. Протеїногенні амінокислоти є невеликою підмножиною цієї групи, яка має центральний атом вуглецю (α- або 2-), що містить аміногрупу, карбоксильну групу, бічний ланцюг і α-водневу ліву конформацію, за винятком гліцину, який є ахіральний, і пролін, аміногрупа якого є вторинним аміном і, отже, часто згадується як імінокислота з традиційних причин, хоча і не є імінокислотою.
Генетичний код кодує 20 стандартних амінокислот для включення в білки під час трансляції. Однак є дві додаткові протеіногенні амінокислоти: селеноцистеїн і піролізин . Ці нестандартні амінокислоти не мають виділеного кодону, але додаються замість стоп-кодону, коли присутня певна послідовність, кодон UGA та елемент SECIS для селеноцистеїну,[6] послідовність UAG PYLIS для піролізину[7]. Усі інші амінокислоти називаються «непротеїногенними».
- Селеноцистеїн. Ця амінокислота містить селенольну групу на β-вуглеці
- Піролізин. Ця амінокислота утворюється шляхом приєднання до ε-аміногрупи лізину карбоксильованого піролінового кілця.
Існують різні групи амінокислот:[8]
- 20 стандартних амінокислот
- 22 протеїногенні амінокислоти
- понад 80 амінокислот, створених абіотично у високих концентраціях
- близько 900 виробляються природними шляхами
- понад 118 сконструйованих амінокислот були введені в білок
Ці групи перетинаються, але не є ідентичними. Усі 22 протеїногенні амінокислоти біосинтезуються організмами, і деякі, але не всі, з них також є абіотичними (виявлені в пребіотичних експериментах і метеоритах). Деякі природні амінокислоти, такі як норлейцин, помилково включаються в білки під час трансляції через порушення процесу синтезу білка. Багато амінокислот, таких як орнітин, є метаболічними проміжними продуктами, що виробляються біосинтетично, але не включені трансляційно в білки. Посттрансляційна модифікація амінокислотних залишків у білках призводить до утворення багатьох білкових, але непротеїногенних амінокислот. Інші амінокислоти містяться виключно в абіотичних сумішах (наприклад, α-метилнорвалін). Більше 30 неприродних амінокислот було включено у білок під час трансляції синтетичним шляхом, але вони не є біосинтетичними[8].
Remove ads
Номенклатура
На додаток до системи нумерації IUPAC для диференціації різних атомів вуглецю в органічній молекулі шляхом послідовного присвоєння номера кожному вуглецю, включаючи ті, що утворюють карбоксильну групу, атоми вуглецю вздовж бічного ланцюга амінокислот також можна позначати грецькими літерами., де α-вуглець є центральним хіральним вуглецем, що має карбоксильну групу, бічний ланцюг і, в α-амінокислотах, аміногрупу – вуглець у карбоксильних групах не враховується[9]. (Отже, назви IUPAC багатьох непротеїногенних α-амінокислот починаються з 2-аміно- і закінчуються на -інова кислота .)
Remove ads
Природні не- L -α-амінокислоти
Узагальнити
Перспектива
Більшість природних амінокислот є α-амінокислотами в L-конфігурації, але існують деякі винятки.
Не альфа

Деякі не-α-амінокислоти існують в організмах. У цих структурах амінна група зміщується далі від кінця карбонової кислоти молекули амінокислоти. Таким чином, β-амінокислота має аміногрупу, приєднану до другого вуглецю, а γ-амінокислота має її на третьому. Приклади включають β-аланін, ГАМК і δ-амінолевулінову кислоту.
- β-аланін: амінокислота синтезується аспартат 1-декарбоксилазою та є попередником коензиму А та пептидів карнозину та ансерину.
- γ-Аміномасляна кислота (GABA, ГАМК): нейромедіаітор у тварин.
- 4-Амінобензойна кислота (PABA, ПАБК): інтермедіат у біосинтезі фолієвої кислоти.
Причина, чому α-амінокислоти використовуються в білках, пов’язана з їх пошиерністю в метеоритах і пребіотичних експериментах[10]. Початкове припущення про шкідливі властивості β-амінокислот з точки зору вторинної структури[10] виявилося невірним[11].
D-амінокислоти
Деякі амінокислоти містять протилежну абсолютну хіральність, хімічні речовини, які недоступні із звичайних механізмів трансляції та транскрипції. Стінки більшості бактеріальних клітин утворені пептидогліканом, полімером, що складається з аміноцукрів, зшитих короткими олігопептидами, сполученими між собою. Олігопептид не синтезується рибосомами і містить кілька особливостей, включаючи D-амінокислоти, як правило, D -аланін і D -глутамат. Ще одна особливість полягає в тому, що D -аланін рацемізується ферментами, що зв’язують PLP (кодуються alr або гомологом dadX ), тоді як D -глутамат рацемізується незалежним від кофактора ферментом (murI). Наприклад, D -лізин присутній у Thermotoga spp., а в деяких стійких до ванкоміцину бактеріях присутній D -серин (ген vanT )[12][13].
Без водню на α-вуглеці
Усі протеїногенні амінокислоти мають принаймні один атом водню на α-вуглеці. Гліцин має два атоми водню, а всі інші мають один атом водню та один бічний ланцюг. Заміна водню, що залишився, більшим замісником, таким як метильна група, спотворює білкову основу[10].
У деяких грибах α-аміноізомасляна кислота виробляється як попередник пептидів, деякі з яких виявляють антибіотичні властивості[14]. Ця сполука подібна до аланіну, але має додаткову метильну групу на α-вуглеці замість водню. Тому він є ахіральним. Іншою сполукою, подібною до аланіну без α-водню, є дегідроаланін, який має метиленовий бічний ланцюг. Це одна з кількох природних дегідроамінокислот .
- аміноізомасляна кислота
- дегідроаланін
Подвійні стереоцентри амінокислот
Підгрупа L-α-амінокислот неоднозначна щодо того, який із двох кінців є α-вуглецем. У білках залишок цистеїну може утворювати дисульфідний зв’язок з іншим залишком цистеїну, таким чином зшиваючи білок. Два зшиті цистеїни утворюють молекулу цистину. Цистеїн і метіонін зазвичай утворюються шляхом прямого сульфурилювання, але в деяких видів вони можуть бути отримані шляхом транссульфурування, коли активований гомосерин або серин зливається з цистеїном або гомоцистеїном, утворюючи цистатіонін . Подібною сполукою є лантіонін, який можна розглядати як дві молекули аланіну, з’єднані тіоефірним зв’язком, який зустрічається в різних організмах. Подібним чином дженколієва кислота, рослинний токсин із бобів Дженгколь, складається з двох цистеїнів, з’єднаних метиленовою групою. Діамінопімелінова кислота використовується як місток у пептидоглікані та використовується як попередник лізину (через його декарбоксилювання).
Remove ads
Пребіотичні амінокислоти та альтернативна біохімія
Узагальнити
Перспектива
У метеоритах і в пребіотичних експериментах (наприклад, в експерименті Міллера-Юрі) виявлено набагато більше амінокислот, ніж двадцять стандартних амінокислот, деякі з яких містяться у вищих концентраціях, ніж стандартні. Було припущення, що якби амінокислотне життя виникло десь у Всесвіті, то не більше 75% амінокислот були б спільними[10]. Найбільш помітною аномалією є відсутність аміномасляної кислоти.
Прямий бічний ланцюг
Генетичний код був описаний як заморожена випадковість, і причиною, чому існує лише одна стандартна амінокислота з прямим ланцюгом, аланін, може бути просто надлишок валіну, лейцину та ізолейцину[10]. Однак, вважається, що амінокислоти з прямим ланцюгом утворюють набагато більш стабільні альфа-спіралі[15].
- гліцин (бічний ланцюг водню)
- аланін (метил бічний ланцюг)
- гомоаланін, або α-аміномасляна кислота (етиловий бічний ланцюг)
- норвалін (бічний ланцюг н-пропілу)
- норлейцин (бічний ланцюг н-бутилу)
- гомонорлейцин (бічний ланцюг п-пентилу, показана гептанова кислота)
Халькоген
Серин, гомосерин, O-метилгомосерин і O-етилгомосерин мають гідроксиметильний, гідроксиетиловий, O-метилгідроксиметильний і O-метилгідроксиетильний бічний ланцюг; тоді як цистеїн, гомоцистеїн, метіонін і етіонін мають тіолові еквіваленти. Еквівалентами селенолу є селеноцистеїн, селеногомоцистеїн, селенометіонін і селеноетіонін. Амінокислоти з наступним зниженням халькогену також зустрічаються в природі: кілька видів, таких як Aspergillus fumigatus, Aspergillus terreus і Penicillium chrysogenum, за відсутності сірки здатні продукувати та включати в білок телуроцистеїн і телурометіонін[16].
Remove ads
Роль
Узагальнити
Перспектива
У клітинах, особливо автотрофних, кілька непротеїногенних амінокислот зустрічаються як метаболічні проміжні продукти. Однак, незважаючи на каталітичну гнучкість PLP-зв'язуючих ферментів, багато амінокислот синтезуються як кетокислоти (наприклад, 4-метил-2-оксопентаноат до лейцину) і амінуються на останньому етапі, таким чином зберігаючи рівень непротеїногенних амінокислот у ролі проміжних продуктів досить низьким.
Орнітин і цитрулін беруть участь у циклі сечовини, що є частиною катаболізму амінокислот[17].
На додаток до первинного метаболізму, кілька непротеїногенних амінокислот є попередниками або кінцевим продуктом у вторинному метаболізмі для створення невеликих сполук або нерибосомних пептидів (таких як деякі токсини).
Посттрансляційне включення у білок
Незважаючи на те, що вони не кодуються генетичним кодом як протеїногенні амінокислоти, деякі нестандартні амінокислоти все ж містяться в білках. Вони утворюються шляхом посттрансляційної модифікації бічних ланцюгів стандартних амінокислот, присутніх у цільовому білку. Ці модифікації часто необхідні для функціонування або регуляції білка; наприклад, в γ-карбоксиглутаматі карбоксилювання глутамату забезпечує краще зв'язування катіонів кальцію[18], а в гідроксипроліні гідроксилювання проліну є критичним для підтримки сполучних тканин[19]. Іншим прикладом є утворення гіпузину у факторі ініціації трансляції EIF5A шляхом модифікації залишку лізину[20]. Такі модифікації також можуть визначати локалізацію білка, наприклад, додавання довгих гідрофобних груп може призвести до зв’язування білка з фосфоліпідною мембраною[21].
- Карбоксиглутамінова кислота. Тоді як глутамінова кислота має одну γ-карбоксильну групу, карбоксиглутамінова кислота має дві.
- Гідроксипролін. Ця амінокислота відрізняється від проліну гідроксильною групою при 4 вуглеці.
- Гіпузин. Ця амінокислота отримується шляхом додавання до ε-аміногрупи лізину 4-амінобутилового фрагмента (отриманого зіспермідину)
- Піроглутамінова кислота
Існують деякі попередні докази того, що аміномалонова кислота може бути присутня в білку, можливо, через неправильне включення[22][23].
Remove ads
Токсичні аналоги
Кілька непротеїногенних амінокислот є токсичними через їх здатність імітувати певні властивості протеїногенних амінокислот, таких як тіалізин . Деякі непротеїногенні амінокислоти є нейротоксичними, імітуючи амінокислоти, які використовуються як нейротрансмітери (тобто не для біосинтезу білка), включаючи квісквалінову кислоту, канаванін і азетидин-2-карбонову кислоту[24]. Цефалоспорин С має основу α-аміноадипінової кислоти (гомоглутамат), яка амідована цефалоспориновим фрагментом[25]. Пеніциламін є терапевтичною амінокислотою, механізм дії якої невідомий.
- Тіалізин
- Квісквалова кислота
- Канаванін
- Азетидин-2-карбонова кислота
- Цефалоспорин С
- Пеніциламін
Ціанотоксини, що зустрічаються в природі, також можуть включати непротеїногенні амінокислоти. Мікроцистин і нодулярін, наприклад, походять від ADDA, β-амінокислоти.
Remove ads
Не амінокислоти
Таурин є аміносульфоновою кислотою, а не амінокарбоновою кислотою, однак іноді її вважають такою, оскільки кількості, необхідні для пригнічення ауксотрофу в певних організмах (таких як коти), ближчі до кількості «незамінних амінокислот» (ауксотрофія амінокислот), ніж у вітамінів (кофакторна ауксотрофія).
Осмоліти, саркозин і гліцинбетаїн є похідними амінокислот, але мають вторинний і четвертинний амін відповідно.
Remove ads
Див. також
Список літератури
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads