Топ питань
Часова шкала
Чат
Перспективи
Протеїногенна амінокислота
З Вікіпедії, вільної енциклопедії
Remove ads
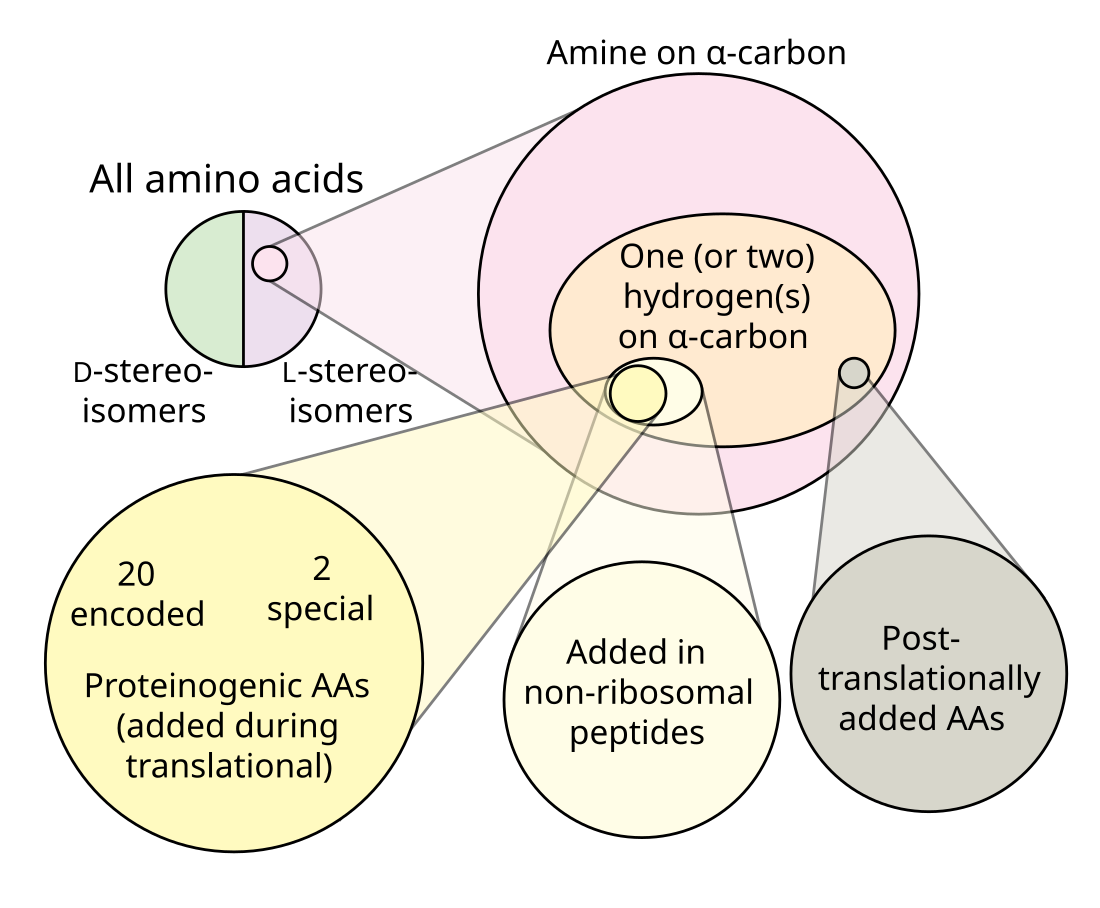
Протеїногенні амінокислоти — це амінокислоти, які біосинтетично включаються до білків під час трансляції з РНК. Слово «протеїногенні» означає «створюючи білок». У відомому нам житті існує 22 генетично кодовані (протеїногенні) амінокислоти, 20 з яких входять до стандартного генетичного коду, а ще 2 (селеноцистеїн і піролізин) можуть бути включені за допомогою спеціальних механізмів трансляції.[1]

На відміну від них, непротеїногенні амінокислоти — це амінокислоти, які або не включаються до складу білків (як ГАМК, L-ДОФА або трийодтиронін), неправильно включаються замість генетично кодованої амінокислоти, або не виробляються безпосередньо та ізольовано стандартними клітинними механізмами (як гідроксипролін). Останнє часто є результатом посттрансляційної модифікації білків. Деякі непротеїногенні амінокислоти включаються до складу нерибосомних пептидів, які синтезуються нерибосомними пептидсинтетазами.
Як еукаріоти, так і прокаріоти до складу своїх білків можуть включати селеноцистеїн за допомогою нуклеотидної послідовності, відомої як SECIS-елемент, яка спрямовує клітину на трансляцію сусіднього кодону UGA як селеноцистеїну (UGA зазвичай є стоп-кодоном). У деяких метаногенних прокаріотів кодон UAG (зазвичай стоп-кодон) також може бути трансльований у піролізин.[2]
У еукаріотів існує лише 21 протеїногенна амінокислота, 20 стандартного генетичного коду, плюс селеноцистеїн. З інших амінокислот або з інших молекул проміжного метаболізму людський організм може синтезувати 12 амінокислот. Інші дев'ять повинні споживатися (зазвичай у вигляді їх білкових похідних), тому їх називають незамінними амінокислотами. Незамінними амінокислотами є гістидин, ізолейцин, лейцин, лізин, метіонін, фенілаланін, треонін, триптофан і валін (тобто H, I, L, K, M, F, T, W, V).[3]
Було виявлено, що протеїногенні амінокислоти пов'язані з набором амінокислот, які можуть розпізнаватися системами аутоаміноацилювання рибозимів.[4] Таким чином, непротеїногенні амінокислоти були виключені через випадковий еволюційний процес нуклеотидних форм життя. Були запропоновані й інші причини, щоб пояснити, чому певні специфічні непротеїногенні амінокислоти зазвичай не включаються до складу білків; наприклад, орнітин і гомосерин циклізуються відносно пептидного остова та фрагментують білок з відносно коротким періодом напіврозпаду, тоді як інші є токсичними, оскільки їх можна помилково включити до складу білків, як-от аналог аргініну канаванін.
Було висловлено припущення, що еволюційний відбір певних протеїногенних амінокислот з первинного бульйону, на відміну від непротеїногенних амінокислот, зумовлений їх кращим включенням у поліпептидний ланцюг.[5]
Remove ads
Структури
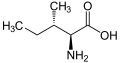
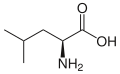
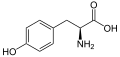
Нижче наведено структури та абревіатури 21 амінокислоти, які безпосередньо кодуються для синтезу білка генетичним кодом еукаріотів. Наведені нижче структури є стандартними хімічними структурами, а не типовими формами цвітер-іонів, що існують у водних розчинах.

IUPAC/IUBMB тепер також рекомендує стандартні скорочення для наступних двох амінокислот:
Remove ads
Хімічні властивості
Узагальнити
Перспектива
Нижче наведено таблицю, в якій перераховано однолітерні символи, трилітерні символи та хімічні властивості бічних ланцюгів стандартних амінокислот. Зазначені маси базуються на середньозважених значеннях елементарних ізотопів за їх природного вмісту. Утворення пептидного зв'язку призводить до відщеплення молекули води. Отже, маса білка дорівнює масі амінокислот, з яких складається білок, мінус 18,01524 Да на пептидний зв'язок.
Загальні хімічні властивості
Властивості бічного ланцюга
§: Тільки іонізуючі залишки мають значуще значення pKa. Значення для Asp, Cys, Glu, His, Lys та Tyr були визначені з використанням амінокислотного залишку, розташованого центрально в аланіновому пентапептиді.[6] Значення для Arg взято з Pace et al. (2009).[7] Значення для Sec взято з Byun & Kang (2011).[8]
Експресія генів та біохімія
* UAG зазвичай є стоп-кодоном, але в організмах, що містять біологічний апарат, кодований кластером генів pylTSBCD, амінокислота піролізин буде включена.[9] ** UGA зазвичай є стоп-кодоном opal (або umber), але кодує селеноцистеїн, якщо присутній SECIS-елемент. † Стоп-кодон не є амінокислотою, але включено для повноти картини. †† UAG та UGA не завжди діють як стоп-кодони (див. вище). ‡ Незамінна амінокислота не може синтезуватися в організмі людини і тому повинна надходити з їжею. Умовно незамінні амінокислоти зазвичай не потрібні в раціоні, але повинні надходити екзогенно для певних груп населення, які не синтезують їх у достатніх кількостях. & Наявність амінокислот базується на протеомах 135 архей, 3775 бактерій, 614 еукаріот та протеомах людини (21 006 білків) відповідно.[10]
Мас-спектрометрія
У мас-спектрометрії пептидів та білків корисним є знання мас залишків. Маса пептиду або білка дорівнює сумі мас залишків плюс маса води (моноізотопна маса = 18,01056 Да; середня маса = 18,0153 Да). Маси залишків обчислюються за табличними хімічними формулами та атомними вагами.[11] У мас-спектрометрії іони також можуть включати один або декілька протонів (моноізотопна маса = 1,00728 Да; середня маса* = 1,0074 Да). *Протони не можуть мати середньої маси, що призводить до плутанини, оскільки дейтрони є дійсним ізотопом, але вони повинні бути іншого виду (див. Гідрон (хімія)).
§ Моноізотопна маса
Стехіометрія та метаболічні витрати в клітині
У таблиці нижче наведено вміст амінокислот у клітинах E. coli та метаболічні витрати (АТФ) на синтез цих амінокислот. Від'ємні числа вказують на те, що метаболічні процеси є енергетично вигідними та не витрачають чистий АТФ клітини.[12] Надлишок амінокислот включає амінокислоти у вільній формі та у полімеризованій формі (білки).
- Примітки

Катаболізм
Амінокислоти можна класифікувати за властивостями їхніх основних продуктів:[13]
- Глюкогенні амінокислоти, коли продукти мають здатність утворювати глюкозу шляхом глюконеогенезу
- Кетогенні амінокислоти, коли продукти не здатні утворювати глюкозу: ці продукти все ще можуть використовуватися для кетогенезу або синтезу ліпідів.
- Амінокислоти, які катаболізуються як у глюкогенні, так і в кетогенні продукти
Remove ads
Див. також
Примітки
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads