Топ питань
Часова шкала
Чат
Перспективи
Фторантимонова кислота
хімічна сполука З Вікіпедії, вільної енциклопедії
Remove ads
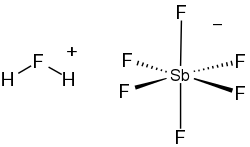
Фторантимонова кислота ― неорганічна сполука з хімічною формулою SbHF6. Являє собою суміш фтороводню і пентафториду стибію, що містить різні катіони та аніони (найпростішими є H
2F+
і SbF−
6). Ця суміш є суперкислотою, яка, з точки зору корозійної активності, у трильйони разів сильніша за 100% сірчану кислоту з точки зору її протонної здатності, виміряної функцією Гаммета. Вона навіть протонує деяку кількість вуглеводнів, щоб отримати пентакоординатні карбокатіони (іони карбонію[en]).[1] Як і її прекурсор фтороводню, вона руйнує скло, але її можна зберігати в контейнерах, покритих ПТФЕ (тефлон) або ПФА[en].
Remove ads
Хімічний склад
Узагальнити
Перспектива
Фторантимонова кислота утворюється шляхом з'єднання фтористого водню і пентафториду стибію:
- SbF5 + 2HF
 SbF−
SbF−
6 + H2F+
Специфікація (тобто перелік компонентів) фторантимонової кислоти є складною. Спектроскопічні вимірювання показують, що фторантимонова кислота складається із суміші HF-сольватованих протонів, [(HF)nH]+ (таких як H3F+2), і SbF5-аддукти фтору, [(SbF5)nF] – (такі як Sb4F−21). Таким чином, формула "[H2F]+[SbF6]−" є зручним, але надто спрощеним наближенням справжнього складу.[2] Тим не менш, надзвичайна кислотність цієї суміші очевидна з надзвичайно поганої здатності сполук, присутніх у розчині, сприймати протони. Фтороводнева кислота, слабка кислота у водному розчині, яка, як правило, взагалі не має помітної основності за Бренстедом, насправді є найсильнішою основою Бренстеда в суміші, протонуючи до H2F+ так само, як вода протонує до H3O+ у водному розчині кислоти. У результаті часто кажуть, що кислота містить «голі протони», хоча «вільні» протони насправді завжди пов’язані з молекулами фтороводню.[3] Саме іон флюору пояснює надзвичайну кислотність фторантимоної кислоти. Протони легко мігрують через розчин, переходячи від H2F+ до HF, якщо він присутній, за допомогою механізму Гроттгусса.
Два споріднені продукти були кристалізовані із суміші фторантимонової кислоти, і обидва були проаналізовані методом монокристалічної рентгенівської кристалографії. Ці солі мають формули [H
2F+
] [Sb
2F−
11] і [H
3F+
2] [Sb
2F−
11]. В обох солях аніоном є Sb
2F−
11.[4] Як згадувалося вище, SbF−
6 – слабоосновний; більший аніон Sb
2F−
11. Очікується, що Sb
2F−
11 буде ще слабшою базою.
Remove ads
Кислотність
Узагальнити
Перспектива
Фторантимонова кислота є найсильнішою суперкислотою на основі виміряного значення її функції кислотності Гаммета (H0), яка була визначена для різних співвідношень HF : SbF5. H0 фтороводню дорівнює −15. Розчин фтороводню, що містить 1 моль % пентафториду стибію (SbF5) становить -20. H0 дорівнює −21 для 10 моль %. Для > 50 моль % SbF5, H0 становить від -21 до -23. Найнижча досягнута H0 становить близько -28.[5][6][7] Наступні значення H0 показують, що фторантимонова кислота сильніша за інші суперкислоти.[8] Про підвищену кислотність свідчать менші (в даному випадку більш негативні) значення H0 .
- Фторантимонова кислота (−23 > H0 > −28)
- Магічна кислота (H0 = −23)
- Карборанова кислота (H0 < −18)
- Фторсульфатна кислота (H0 = −15)
- Трифлієва кислота (H0 = −15)
- Перхлоратна кислота (H0 = −13)
З перерахованих вище тільки карборанові кислоти, H0 яких неможливо визначити безпосередньо через їх високу температуру плавлення, можуть бути сильнішими кислотами, ніж фторантимонова кислота.[8][9]
Значення H0 вимірює здатність до протонування основної рідкої кислоти, і це значення було безпосередньо визначено або оцінено для різних складів суміші. pKa, з іншого боку, вимірює рівновагу дисоціації протона дискретного хімічного виду при розчиненні в конкретному розчиннику. Оскільки фтороантимонова кислота не є одним хімічним видом, її значення pKa не є чітко визначеним.
Кислотність газової фази (КГФ) окремих видів, присутніх у суміші, була розрахована за допомогою методів теорії функціоналу густини.[2] (Фазу розчинення pKa цих видів, у принципі, можна оцінити, беручи до уваги енергію сольватації, але, здається, нічого подібного не повідомлялося в літературі станом на 2019 рік.) Наприклад, іонна пара [H2F]+·SbF–
6, за оцінками, мав КГФ 254 ккал/моль. Для порівняння, широко поширена суперкислота трифлієва кислота (TfOH), є значно слабшою кислотою за цим показником із середнім показником ефективності 299 ккал/моль.[10] Однак певні карборанові кислоти мають КГФ нижчі, ніж [H2F]+·SbF–
6. Наприклад, H(CHB11Cl11) має експериментально визначений КГФ 241 ккал/моль.[11]
Remove ads
Реакції
Розчин фторантимонової кислоти настільки реакційноздатний, що важко визначити середовище, з яким він не реагує. Матеріали, сумісні з фторантимоновою кислотою як розчинником, включають SO2ClF і діоксид сірки; також були використані деякі хлорфторвуглеводні. Контейнери для HF·SbF5 виготовлені з ПТФЕ.
Розчини фторантимонової кислоти розкладаються при нагріванні, утворюючи газоподібний фтористий водень і рідкий пентафторид стибію при температурі 40°С.[12]
Будучи суперкислотою, розчини фторантимонової кислоти протонують майже всі органічні сполуки, часто викликаючи дегідрування або дегідратацію. У 1967 році Бікель і Хогевен показали, що 2HF·SbF5 реагує з ізобутаном і неопентаном з утворенням іонів карбенію:[13][14]
- (CH3)3CH + H+ → (CH3)3C+ + H2
- (CH3)4C + H+ → (CH3)3C+ + CH4
Він також використовується в синтезі комплексів тетраксенозолота.[15]
Безпека
Фторантимонова кислота є сильно корозійною речовиною, яка бурхливо реагує з водою. Її нагрівання також небезпечно, оскільки вона розкладається на токсичний газоподібний фтористий водень. Для суперкислот, які димлять і є токсичними, необхідно використовувати відповідні засоби індивідуального захисту. Крім обов'язкових рукавичок і захисних окулярів, також рекомендується використання маски[en] і респіратора. Не рекомендується використовувати звичайні лабораторні рукавички, оскільки ця кислота може реагувати з ними.[9] Під час роботи з цією корозійною речовиною або під час наближення до неї потрібно завжди носити захисне спорядження, оскільки фторантимонова кислота може протонувати будь-яку сполуку в організмі людини.[16]
Remove ads
Дивись також
Список літератури
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads