热门问题
时间线
聊天
视角
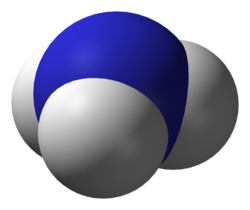
氨
化合物 来自维基百科,自由的百科全书
Remove ads
氨[11](英語:Ammonia,或稱氨氣、無水氨,曾音譯作氬、阿摩尼亞,分子式為NH3)是無色氣體,有強烈刺激氣味(尿味),極易溶於水。常溫常壓下,1單位體積水可溶解700倍體積的氨。[5]氨對地球上的生物相當重要,是所有食物和肥料的重要成分。氨也是很多藥物和商業清潔用品直接或間接的組成部分,具有腐蝕性等危險性質。
此條目可參照德語維基百科相應條目來擴充。 (2020年2月26日) |
此條目需要補充更多來源。 (2020年2月26日) |
由於氨有廣泛的用途,成為世界上產量最多的無機化合物之一,約八成用於製作化肥。2006年,氨的全球產量估計為1.465億噸,主要用於製造商業清潔產品。
Remove ads
製法
由於產物中含有水蒸氣,故反應物需用鹼石灰淨化。
注意不能用硝酸銨代替氯化銨,因硝酸銨不穩定且產物不單一;也不能用氫氧化鉀和氫氧化鈉代替氫氧化鈣,因為二者皆易吸收產物中的水,阻止進一步反應。吸收水蒸氣不能用濃硫酸和固體氯化鈣,因二者皆能與氨氣反應。
若有濃氨水,亦可加熱之,製備氨氣:
Remove ads
如今,工業製備氨氣主要是通過哈柏法,即在約700K及200個大氣壓下,以鐵為催化劑製成。然而此法耗費大量原料及能量,僅此一項即占全球碳排放量的3%[12],消耗5%的天然氣[13],故有新的制氨法被提出。日本化學家細野秀雄提出用更有效的含釕[14][15]及鋇-鈰催化劑[16]催化氮氣與水的反應製得氨氣,此法已在日本投產使用[17][18]。
鑑定
鑑定氨氣需將待測氣體通入水中溶解,然後用奈斯勒試劑(碘化汞鉀和氫氧化鉀的混合物)測試,溶液會變黃色:
NH4+ + 2[HgI4]2− + 4OH− → HgO·Hg(NH2)I + 7I− + 3H2O
氨水
氨水(NH3(aq),也常寫成 NH4OH)又稱為阿摩尼亞水,指氨的水溶液,有強烈刺鼻氣味,具弱鹼性。
氨水中,氨氣分子發生微弱水解生成氫氧根離子及銨根離子。「氫氧化銨」事實上並不存在,只是對氨水溶液中的離子的描述,並無法從溶液中分離出來。
氨的在水中的電離可以表示為:
反應平衡常數。
1M氨水的pH值為11.63,大約有0.42%的NH3變為NH4+。
Remove ads
用途
反應
NH3分子中氮原子有一對孤對電子,可以作為電子對給予體(路易斯鹼)形成加合物。如氨在氫離子絡合生成銨離子:
NH3亦可與金屬離子如Ag+、Cu2+等發生錯合,生成錯合物:
Remove ads
NH3分子中氮為-3價,在適當條件下可被氧化為N2或更高價氮化合物。
如NH3在純氧中燃燒,生成N2:
- (ΔHºr = –1267.20 kJ/mol)
可還原CuO為Cu:
常溫下NH3可與強氧化劑(如氯氣、過氧化氫、高錳酸鉀)直接反應:
Remove ads
氨是帶弱鹼性的,會和酸發生酸鹼中和反應。例:HNO3+NH3→NH4NO3
氨與強酸反應,生成的鹽大多為弱酸性。氨與弱酸(如乙酸)反應,鹽則為中性。
酸鹼中和是放熱反應。
氨分子的氮上有一對孤對電子,而且帶部分負電荷,因此氨具有親核性。換言之,氨是個親核試劑,因此可與親電體反應。
例如,氨與鹵代烴發生雙分子親核取代反應生成胺。該反應又稱氨解反應。
- RX + NH3 → RNH2+ HX
液氨
液氨(NH3)指的是液態的氨,為工業上氨氣的主要儲存形式。是一種常用的非水溶劑和致冷劑,也是除了水以外最常用的無機溶劑。不過由於它的揮發性和腐蝕性,液氨在儲存和運輸時發生事故的機率也相當高。
備注
參見
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads






![{\displaystyle {2\,\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{4}}\mathrm {Cl} ~{\text{+}}~\mathrm {Ca} (\mathrm {OH} ){\vphantom {A}}_{\smash[{t}]{2}}{}\mathrel {\longrightarrow } {}2\,\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{3}}\uparrow {}+{}\mathrm {CaCl} {\vphantom {A}}_{\smash[{t}]{2}}~{\text{+}}~2\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/84c8692818bf1eea14f97208695cf83ded79ba3b)
![{\displaystyle {\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{3}}\,{\cdot }\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}\mathrel {\xrightarrow {\triangle } } {}\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{3}}\uparrow {}+{}\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/a6fae963ee25d4de2becbf8a5958d802faa1bca6)
![{\displaystyle {\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{3}}\,{\cdot }\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}={}{\text{NH4}}{\vphantom {A}}^{+}{}+{}\mathrm {OH} {\vphantom {A}}^{-}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/3fa840f93d6375030880c0cd17c2bd6bab0b3f59)

![{\displaystyle {\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{3}}{}+{}\mathrm {H} {\vphantom {A}}^{+}{}={}{\text{NH4}}{\vphantom {A}}^{+}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/b5e63dfce016447c4bda71895fc996c2c5e0e44f)
![{\displaystyle {\mathrm {Ag} {\vphantom {A}}^{+}{}+{}2\,\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{3}}{}={}[\mathrm {Ag} (\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{3}}){\vphantom {A}}_{\smash[{t}]{2}}]{\vphantom {A}}^{+}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/795136047cc5bc5d95c75000bfa3bd68cf3f7de5)
![{\displaystyle {{\text{Cu}}{\vphantom {A}}^{2+}{}+{}4\,\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{3}}{}={}{\text{[Cu(NH3)4]}}{\vphantom {A}}^{2+}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/9ab00ff50eab088fc4f8124462273402f229bc16)
![{\displaystyle {4\,\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{3}}{}+{}3\,\mathrm {O} {\vphantom {A}}_{\smash[{t}]{2}}{}={}2\,\mathrm {N} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}6\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/4abeb2a7d8fd81c94bcdd2c08a69775fafc7c2a2)
![{\displaystyle {4\,\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{3}}{}+{}5\,\mathrm {O} {\vphantom {A}}_{\smash[{t}]{2}}{}={}4\,\mathrm {NO} {}+{}6\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/b85860751404480be4d817b542e3f7ea753bb4c6)
![{\displaystyle {2\,\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{3}}{}+{}3\,\mathrm {CuO} {}={}\mathrm {N} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}3\,\mathrm {H} {\vphantom {A}}_{\smash[{t}]{2}}\mathrm {O} {}+{}3\,\mathrm {Cu} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/2fcc782c2712cdcfc9054182e45e3e5ddfb932a2)
![{\displaystyle {2\,\mathrm {NH} {\vphantom {A}}_{\smash[{t}]{3}}{}+{}3\,\mathrm {Cl} {\vphantom {A}}_{\smash[{t}]{2}}{}={}\mathrm {N} {\vphantom {A}}_{\smash[{t}]{2}}{}+{}6\,\mathrm {HCl} }}](http://wikimedia.org/api/rest_v1/media/math/render/svg/fc579847bf0736ef7539d11e352566ee0f74dba7)