Top-Fragen
Zeitleiste
Chat
Kontext
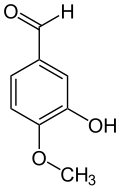
Isovanillin
chemische Verbindung Aus Wikipedia, der freien Enzyklopädie
Remove ads
Isovanillin (3-Hydroxy-4-methoxybenzaldehyd) ist eine organische chemische Verbindung mit der Summenformel C8H8O3. Es ist ein Derivat des Benzaldehyds mit einer zusätzlichen Hydroxy- und einer Methoxygruppe. Isovanillin ist ein nahezu geruchloses Isomer zum Vanillin, von dem es sich nur durch die Stellung der Methoxygruppe unterscheidet. Es dient als Synthesebaustein und findet vor allem im Pharma-, Kosmetik-, Agrar- und Nahrungsmittelbereich Verwendung.
Remove ads
Geschichte und Vorkommen

Isovanillin wurde 1882 von Rudolf Wegscheider isoliert und charakterisiert.[1] Es kommt u. a. in Mondia whitei[4][5] und Maniok[6] vor.
Gewinnung und Darstellung
Zusammenfassung
Kontext
Natürliche Quellen
Die Isolierung von Isovanillin geschieht entweder durch Extraktion mit verschiedenen Lösungsmitteln aber auch durch Wasserdampfdestillation aus getrockneten Wurzeln der Mondia whitei.[4][5][7]
Technische Synthesen
Zur Darstellung sind zahlreiche Verfahren bekannt:[8]
- Piperonal (3,4-(Methylendioxy)-benzaldehyd) wird mit Natriummethanolat in Gegenwart von Kupfer(I)-chlorid in Dimethylformamid umgesetzt.[9]
- Veratrumaldehyd (3,4-Dimethoxybenzaldehyd) kann durch selektive Demethylierung mit Methionin in Methansulfonsäure zu Isovanillin umgesetzt werden.[10] Die Reaktionszeiten sind lang und die Selektivität ist nicht sehr hoch.
- Eine selektive O-Methylierung von Protocatechualdehyd (3,4-Dihydroxybenzaldehyd) durch Methyliodid in Gegenwart von Natriumhydrid in Dimethylsulfoxid führt zu einer Ausbeute von etwa 65 % Isovanillin.[11]
- Eine Formylierung von Guajacol (o-Methoxyphenol), welches als Acetat geschützt ist, erfolgt mit Dichlormethoxymethan in Gegenwart von Titantetrachlorid in Dichlormethan. Der 3-Acetoxy-4-methoxybenzaldehyd wird anschließend mit NaOH hydrolysiert.[12]
- Isovanillin lässt sich in guter Ausbeute erhalten, indem man bei einem 3-Alkoxy-4-methoxybenzaldehyd mittels einer starken Säure selektiv in 3-Stellung die Alkylgruppe abspaltet, wobei die Alkoxygruppe mindestens zwei Kohlenstoffatome enthält. Hierzu eignet sich u. a. Ethylvanillin (1), welches mit Dimethylsulfat zum 3-Ethoxy-4-methoxybenzaldehyd (2) methyliert wird. Anschließend wird mit Schwefelsäure selektiv der Ethylether gespalten.[8]
Remove ads
Eigenschaften
Zusammenfassung
Kontext
Physikalische Eigenschaften
Isovanillin bildet schwach gelbliche glasglänzende Säulen[1], schmilzt bei 113–115 °C[2] und siedet bei 179 °C bei Unterdruck (15 mmHg; ≈ 20 hPa)[2]. Es ist in heißem Wasser leicht, in kaltem kaum löslich; hingegen ist es leicht löslich in Chloroform, Ethanol, Ether, Methanol und Eisessig.[1] Es kristallisiert im monoklinen Kristallsystem in der Raumgruppe P21/a (Raumgruppen-Nr. 14, Stellung 3) mit den Gitterparametern a = 851,7 pm, b = 1338,0 pm, c = 639,0 pm, β = 97,21° und vier Formeleinheiten pro Elementarzelle.[13]
Chemische Eigenschaften
Isovanillin leitet sich strukturell sowohl vom Benzaldehyd als auch vom Guajacol (2-Methoxyphenol) ab. Es unterscheidet sich als Isomer vom Vanillin durch die Stellung der Methoxygruppe. Anstatt an Position 3 ist diese hier an Position 4 vorzufinden. Hydroxy- und Methoxygruppe tauschen im Vergleich zum Vanillin die Plätze. Im Gegensatz zum Vanillin ist es nahezu geruchlos.[14][15]
Es bildet mit einer wässrigen Lösung von Eisen(III)-chlorid jedoch keine Färbung.[1] Der pKs-Wert der phenolischen OH-Gruppe beträgt 8,89 (25 °C).[3] Dieser Wert ist gegenüber dem Phenol mit 9,99[3] niedriger; die elektronenziehende Aldehydgruppe erhöht durch ihren −M-Effekt die OH-Acidität; die phenolische OH-Bindung wird zunehmend polarisiert.
Biologische Eigenschaften
Isovanillin ist ein selektiver Inhibitor der Aldehydoxidase. Es ist kein Substrat dieses Enzyms und wird von der Aldehyddehydrogenase zu Isovanillinsäure metabolisiert.[16][17][18][19][20]
Strukturelle Verwandte
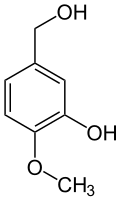
Isovanillylalkohol (3-Hydroxy-4-methoxybenzylalkohol) entsteht durch Reduktion von Isovanillin. Isovanillinsäure (3-Hydroxy-4-methoxybenzoesäure) entsteht durch Oxidation, z. B. auf enzymatischen Weg.[20]
Isoethylvanillin (3-Hydroxy-4-ethoxybenzaldehyd) ist ein struktureller Verwandter und unterscheidet sich vom Isovanillin, indem man die Methylgruppe gegen eine Ethylgruppe austauscht. Die Strukturanalogie entspricht der zwischen Vanillin und Ethylvanillin.
iso-Acetovanillon (3-Hydroxy-4-methoxyacetophenon) ist gleichfalls ein struktureller Verwandter und unterscheidet sich vom Isovanillin, indem man die Formylgruppe (Aldehydgruppe) gegen eine Acetylgruppe austauscht. Die Strukturanalogie entspricht der zwischen Vanillin und Acetovanillon.
Remove ads
Verwendung
Isovanillin dient als Synthesebaustein vor allem im Pharma-, Kosmetik-, Agrar- und Nahrungsmittelbereich.[8][21][22][23]
Einzelnachweise
Literatur
Weblinks
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads