Encima convertedor da anxiotensina
From Wikipedia, the free encyclopedia
Remove ads
O encima convertedor da anxiotensina (EC 3.4.15.1), simbolizado como ACE (ou ECA), cuxo nome aceptado pola NC-IUBMB é peptidil-dipeptidase A,[1] é un compoñente central do sistema renina-anxiotensina, que controla a presión arterial ao regular o volume dos fluídos do corpo. Converte a hormona anxiotensina I ao vasoconstritor activo anxiotensina II. Por tanto, o ACE incrementa indirectamente a presión sanguínea ao causar a constrición dos vasos sanguíneos. Os inhibidores do ACE utilízanse amplamente como fármacos para o tratamento de doenzas cardiovasculares.

Este encima foi descuberto por Leonard T. Skeggs Jr. en 1956.[2] Localízase principalmente nos capilares dos pulmóns pero pode tamén encontrarse en células endoteliais doutros vasos e células epiteliais renais.[3]
Ademais do control da presión arterial, outras funcións menos coñecidas do ACE son a degradación da bradicinina[4] e a proteína beta amiloide.[5]
Remove ads
Nomenclatura
O ACE foi coñecido polos seguintes nomes:
- dipeptidil carboxipeptidase I,
- peptidase P,
- dipéptido hidrolase,
- peptidil dipeptidase,
- encima convertedor da anxiotensina,
- encima conversor da anxiotensina,
- cininase II,
- encima convertidor da anxiotensina I,
- carboxicatepsina,
- dipeptidil carboxipeptidase,
- "encima convertedor da hipertensina" peptidil dipeptidase I,
- peptidil-dipéptido hidrolase,
- peptidildipéptido hidrolase,
- peptidil dipeptidase de célula endotelial,
- peptidil dipeptidase-4,
- peptidil-dipeptidase A
- PDH,
- peptidil dipéptido hidrolase,
- e DCP.
Remove ads
Función

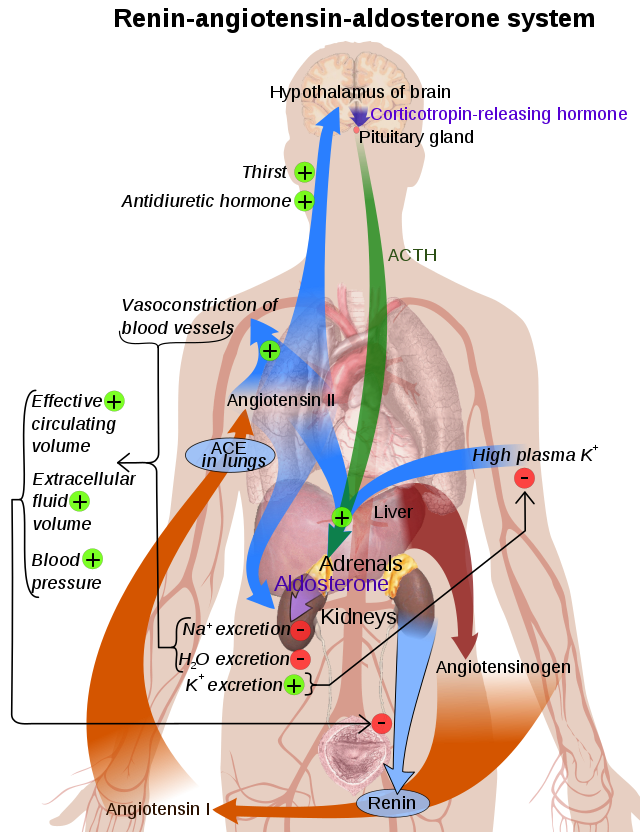
O ACE hidroliza péptidos ao eliminar un dipéptido do extremo C-terminal. Desa mesma maneira converte o decapéptido inactivo anxiotensina I no octapéptido anxiotensina II ao eliminar o dipéptido His-Leu.[7]
A anxiotensina II é un potente vasoconstritor de maneira dependente da concentración de substrato.[8] A anxiotensina II únese ao receptor de anxiotensina II tipo 1 (AT1), que inicia unha serie de accións que causan a vasoconstrición e o conseguinte incremento da presión arterial.
O ACE forma parte tamén do sistema cinina-callicreína, no que degrada a bradicinina, un potente vasodilatador, e outros péptidos vasoactivos.[9]
A cininase II é o mesmo encima que o ACE, que ten recibido moitos nomes. Así, o mesmo encima (ACE) que xera a vasoconstrición (anxiotensina II) tamén elimina vasodilatadores (bradicinina).[6]
Remove ads
Mecanismo de acción
O ACE é un metaolencima de zinc.[10] O ión zinc é esencial para a súa actividade, xa que participa directamente na catálise da hidrólise do péptido. Por tanto, o ACE pode ser inhibido por axentes quelantes de metais.[11]
O residuo E384 ten unha función dual. Primeiro actúa como unha base xeral para activar a auga como nucleófilo. Despois actúa como un ácido xeral para clivar o enlace C-N.[12]
A función do ión cloruro é moi complexa e moi discutida. A activación do anión polo cloruro é unha propiedade característica do ACE.[13] Determinouse experimentalmente que a activación da hidrólise polo cloruro é altamente dependente do substrato. Aínda que incrementa a velocidade da hidrólise de, por exemplo, Hip-His-Leu, inhibe a hidrólise doutros substratos como Hip-Ala-Pro.[12] En condicións fisiolóxicas o encima alcanza un 60% da súa actividade máxima coa anxiotensina I e alcanza a súa actividade completa coa bradicinina. Por tanto, asúmese que a función de activación do anión no ACE proporciona unha elevada especificidade de substrato.[13] Outras teorías din que o cloruro podería simplemente estabilizar a estrutura global do encima.[12]
Xenética
O xene ACE, situado no cromosoma 17 humano, codifica dous isocimas. O isocima somático exprésase en moitos tecidos, principalmente nos pulmóns, e tamén en células endoteliais, células epiteliais dos riles e células de Leydig dos testículos, mentres que o isocima xerminal se expresa só no espermatozoide. O tecido cerebral expresa o ACE, que toma parte no sistema renina-anxiotensina local e converte a forma de beta amiloide Aβ42 (que se agrega nas plaquetas) en Aβ40 (que se pensa é menos tóxico). Esta última é predominantemente unha función da porción do dominio N no ACE. Os inhibidores do ACE que cruzan a barreira hematoencefálica e seleccionaron preferentemente a actividade N-terminal poden, por tanto, causar acumulación de Aβ42.
Remove ads
Importancia en enfermidades

Os inhibidores do ACE son amplamente usados como fármacos no tratamento de condicións como a hipertensión arterial, insuficiencia cardíaca, nefropatía diabética e diabetes mellitus tipo 2.
Os inhibidores do ACE inhiben o ACE competitivamente.[14] Isto ten como resultado a diminución da formación da anxiotensina II e a diminución do metabolismo da bradicinina, que leva á dilatación sistemática das arterias e veas e unha diminución da presión arterial. Ademais, inhibindo a formación de anxiotensina II diminúe a secreción de aldosterona mediada por anxiotensina II no córtex adrenal, o que causa unha diminución da reabsorción de sodio e auga e unha redución do volume extracelular.[15]
Os efectos do ACE na enfermidade de Alzheimer aínda son moi discutidos. Os pacientes de alzhéimer xeralmente mostran altos niveis de ACE no cerebro. Algúns estudos suxiren que os inhibidores do ACE que poden atravesar a barreira hematoencefálica poderían potenciar a actividade de importantes encimas degradadores dos péptidos beta-amiloides como a neprilisina no cerebro, o que ten como resultado un desenvolvemento máis lento da enfermidade de Alzheimer.[16] Investigacións máis recentes suxiren que os inhibidores do ACE poden reducir o risco de padecer a enfermidade de Alzheimer en ausencia de alelos de apolipoproteína E4 (ApoE4), pero non terán ningún erfecto nos transportadores de ApoE4.[17] Outra hipótese máis recente é que niveis máis altos de ACE poden previr o alzhéimer. Asúmese que o ACE pode degradar o beta-amiloide nos vasos sanguíneos do cerebro e, por tanto, axuda a impedir a progresión da doenza.[18]
Remove ads
Patoloxía
- Encóntranse niveis elevados do ACE na sarcoidose e utilízanse na diagnose e monitorización desta doenza. Tamén están elevados na lepra, hipertiroidismo, hepatite aguda, cirrose biliar primaria, diabetes mellitus, mieloma múltiple, osteoartrite, amiloidose, enfermidade de Gaucher, pneumoconiose, histoplasmose, tuberculose miliar.
- Os niveis séricos de ACE están diminuídos na enfermidade renal, enfermidade pulmonar obstrutiva e hipotiroidismo.
Remove ads
Influencia no rendemento atlético
Segundo varios estudos os diferentes xenotipos do ACE poden ter diversa influencia no rendemento atlético. Os polimorfismos I/D no ACE consisten na inserción (I) ou a ausencia ou deleción (D) dunha secuencia de alaninas de 287 pares de bases no intrón 16 do xene.[19] As persoas que levan o alelo I xeralmente teñen menores niveis de ACE, mentres que as que portano alelo D teñen maiores niveis.
As persoas que portan o alelo D están asociadas con maiores niveis de ACE que causan que teñan maiores niveis de anxiotensina II. Durante o exercicio físico a presión arterial dos portadores do alelo D increméntase antes que nos portadores do alelo I. Isto ten como resultado unha menor frecuencia cardíaca e menor captación máxima de oxíxeno (VO2max). Por tanto, os portadores do alelo D teñen un 10% máis de risco de ter enfermidades cardiovasculares. Ademais, o alelo D está asociado cun maior incremento do crecemento do ventrículo esquerdo en resposta ao adestramento en comparción co alelo I.[20] Por outra parte, os portadores do alelo I xeralmente mostran un incremento da frecuencia cardíaca máxima debido aos baixos niveis de ACE, maior captación de oxíxeno máxima e, por tanto, mostran unha mellora na súa resistencia física.[20]
O alelo I encóntrase con maior frecuencia en corredores de elite de carreiras de longa distancia, remeiros e ciclistas. Os nadadores de probas de distancia curta mostran unha maior presenza do alelo D na súa disciplina específica, xa que dita disciplina require máis forza que resistencia.[21][22]
Remove ads
Notas
Véxase tamén
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads


