Retinal
composto químico From Wikipedia, the free encyclopedia
Remove ads
O retinal, tamén chamado retinaldehido, é unha forma de vitamina A. Orixinalmente chamouse retineno,[2] e foi renomeado[3] despois de que se descubriu que era o aldehido da vitamina A.[4][5] O retinal é unha das moitas formas da vitamina A (cuxo número varía coa especie). Pode encontrarse nas formas 11-cis-retinal e todo-trans-retinal. O retinal é un cromóforo polieno, que está unido a proteínas chamadas opsinas, e nel está baseada a química da visión animal. Ademais, o retinal permite que certos microorganismos convertan a luz en enerxía metabólica.
- Este artigo trata da molécula ; para retinal como adxectivo referido á retina, ver retina.
Os animais vertebrados inxiren retinal directamente da carne, ou prodúceno a partir de carotenoides, tanto a partir dun ou dous carotenos (α-caroteno, β-caroteno) coma a partir de β-criptoxantina, un tipo de xantofila. Á súa vez, estes carotenoides deben obterse de plantas e outros organimos fotosintéticos. Ningún outro carotenoide pode ser convertido polos animais en retinal, e algúns carnívoros non poden converter ningún carotenoide en absoluto. As outras formas principais de vitamina A son o retinol e unha forma parcialmente activa, o ácido retinoico, que poden ambos ser producidos a partir de retinal.
Invertebrados como os insectos e luras usan formas hidroxiladas do retinal nos seus sistemas visuais, que derivan da conversión doutras xantofilas.
Remove ads
Metabolismo da vitamina A
Os organismos vivos producen retinal (RAL) por clivaxe oxidativa irreversible de carotenoides.[6] For example,
- beta-caroteno + O2 → 2 retinal
catalizado por unha beta-caroteno 15,15'-monooxixenase[7] ou unha beta-caroteno 15,15'-dioxixenase.[8] Igual que os carotenoides son os precursores do retinal, o retinal é o precursor doutras formas de vitamina A. O retinal é interconvertible co retinol (ROL), a forma de almacenamento e transporte da vitamina A.
reaccións catalizadas pola retinol deshidroxenases (RDHs)[9] e alcohol deshidroxenases (ADHs).[10] O retinaol chámase alcohol da vitamina A ou máis frecuentemente, simplemente vitamina A. O retinal pode tamén ser oxidado a ácido retinoico (RA).
- retinal + NAD+ + H2O → ácido retinoico + NADH + H+ (catalizado pola RALDH)
- retinal + O2 + H2O → ácido retinoico + H2O2 (catalizado pola retinal oxidase)
catalizado polas retinal deshidroxenases[11] tamén coñecidas como retinaldehido deshidroxenases (RALDHs),[10] e polas retinal oxidases.[12] O ácido retinoico, ás veces chamado ácido da vitamina A, é unha importante molécula de sinalización e hormona en animais vertebrados.
Remove ads
Visión
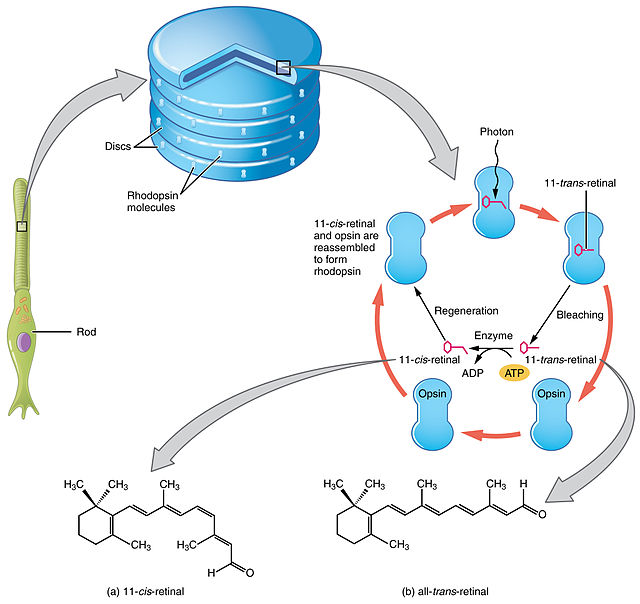
O retinal é un cromóforo conxugado. No ollo humano, o retinal empeza tendo a configuración de 11-cis-retinal, a cal, ao capturar un fotón da lonxitude de onda correcta, se endereita adoptando a configuración todo-trans-retinal. Este cambio configuracional empúrrao contra a proteína opsina na retina, o cal orixina unha fervenza de sinalizacións químicas que pode causar a percepción da luz ou de imaxes no cerebro humano. O espectro de absorbancia do cromóforo depende das súas interaccións coa proteína opsina á cal está unido, polo que diferentes complexos retinal-opsina absorben fotóns de diferentes lonxitudes de onda (cores da luz).
Opsinas

As proteínas opsinas son os pirgmentos visuais que se unen ao retinal atopados nas células fotorreceptoras da retina. Unha opsina está formada por un feixe de sete hélices alfa transmembrana conectadas por seis bucles. Nos bastóns as moléculas de opsina están incrustadas nas membranas de discos que están completamente dentro da célula. A cabeza N-terminal da molécula esténdese ao interior do disco, e a cola C-terminal esténdese ao citoplasma da célula. En células cono os discos son definidos pola membrana plasmática da célula, polo que a cabeza N-terminal esténdese fora da célula. O retinal únese covalentemente a unha lisina na hélice transmembrana máis próxima ao C-terminal da proteína por medio dun enlace de base de Schiff. A formación do enlace de base de Schiff implica a eliminación do átomo de oxíxeno do retinal e dous átomos de hidróxeno do grupo amino libre da lisina, orixinando H2O. O retinilideno é o grupo divalente formado ao quitar o átomo de oxíxeno do retinal, e por iso as opsinas foron chamadas proteínas retinilideno.
As opsinas son receptores acoplados á proteína G (GPCRs) prototípicos.[13] A rodopsina bovina, a opsina dos bastóns das vacas, foi ao primeiro GPCR do que se determinou a súa estrutura de raios X.[14] A rodopsina bovina contén 348 residuos de aminoácidos. O cromóforo retinal únese á Lys296.
Aínda que os mamíferos usan o retinal exclusivamente como o cromóforo da opsina, outros grupos de animais utilizan adicionalmente catro cromóforos estreitamente relacionados ao retinal. Son o 3,4-dideshidrorretinal (vitamina A2), o (3R)-3-hidroxirretinal, (3S)-3-hidroxirretinal (ambos vitamina A3) e o (4R)-4-hidroxirretinal (vitamina A4). Moitos peixes e anfibios usan o 3,4-dideshidrorretinal, tamén chamado deshidrorretinal. Coa excepción da suborde de dípteros Cyclorrhapha, todos os insectos examinados usan o enantiómero R do 3-hidroxirretinal. O enantiómero R é o esperado se o 3-hidroxirretinal se produce directamente a partir de xantofilas. Os Cyclorrhapha, como Drosophila, usan o (3S)-3-hidroxirretinal.[15][16] A lura Watasenia scintillans utiliza o (4R)-4-hidroxirretinal.
Ciclo visual

- Véxase tamén: Rodopsina#Estrutura.
O ciclo visual é unha vía encimática circular, da que depende a fototransdución. Xera 11-cis-retinal. Por exemplo, o ciclo visual dos bastóns de mamíferos é o seguinte:
- todo-trans-retinil éster + H2O → 11-cis-retinol + ácido graxo ; (RPE65 isomerohidrolases)[17]
- 11-cis-retinol + NAD+ → 11-cis-retinal + NADH + H+ ; (11-cis-retinol deshidroxenases)
- 11-cis-retinal + aporrodopsina → rodopsina + H2O; forma un enlace de base de Schiff coa lisina, -CH=N+H-,
- rodopsina + hν → metarrodopsina II, i.e. 11-cis fotoisomerízase a todo-trans,
- rodopsina + hν → fotorrodopsina → batorrodopsina → lumirrodopsina → metarrodopsina I → metarrodopsina II,
- metarrodopsina II + H2O → aporrodopsina + todo-trans-retinal,
- todo-trans-retinal + NADPH + H+ → todo-trans-retinol + NADP+ ; (todo-trans-retinol deshidroxenases)
- todo-trans-retinol + ácido graxo → todo-trans-retinil éster + H2O ; (lecitina retinol aciltransferases (LRATs)).[18]
Os pasos 3, 4, 5 e 6 teñen lugar nos segmentos externos dos bastóns, e os pasos 1, 2 e 7 prodúcense nas células do epitelio pigmentario retiniano.
As RPE65 isomerohidrolases son homólogas das beta-caroteno monooxixenases;[6] o encima homólogo ninaB en Drosophila ten actividade de carotenoide-oxixenase formadora de retinal e actividade de isomerase de todo-trans a 11-cis.[19]
Remove ads
Rodopsinas microbinanas
- Artigo principal: Rodopsinas microbianas.
O todo-trans-retinal é tamén un compoñente esencial de opsinas microbiansas como a bacteriorrodopsina, a canlerrodopsina e a halorrodopsina. Nestas moléculas, a luz causa que o todo-trans-retinal se converta en 13-cis-retinal, que despois cicla de novo a todo-trans-retinal no estado escuro. Estas proteínas non están relacionadas evolutivamente coas opsinas animais e non son GPCRs; o feito de que ambas utilicen o retinal é o resultado dunha evolución converxente.[20]
Historia
O bioquñimico norteamericano George Wald e outros delimitaron o ciclo visual en 1958. Polo seu traballo Wald gañou en 1967 o Premio Nobel de Fisioloxía ou Medicina compartido con Haldan Keffer Hartline e Ragnar Granit.[21]
Notas
Véxase tamén
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads