Timeline
Chat
Prospettiva
Aritmia
alterazione del ritmo cardiaco normale, che si riferisce al ritmo che origina dal nodo del seno, regolare per frequenza e conduzione elettrica del cuore Da Wikipedia, l'enciclopedia libera
Remove ads
Il termine aritmia viene utilizzato per indicare un'alterazione della frequenza o della regolarità del battito cardiaco, nonché un'alterazione della sequenza fisiologica di conduzione dell'impulso elettrico dal nodo senoatriale al sistema di His-Purkinje e ai ventricoli.[1]


Remove ads
Etimologia
Si tratta di un sostantivo composto di a privativa (in greco antico ἀ) e -ritmia (da ritmo in greco antico ῥυθμός) che significa "ritmo", pertanto la parola aritmia significa "mancanza di ritmo".[2]
Classificazione
Riepilogo
Prospettiva
Le aritmie possono essere classificate in base a diversi criteri. Il modo più comune per categorizzarle è in base alla frequenza di conduzione.[3][4]
Remove ads
Epidemiologia e storia
Si stima che la prevalenza delle aritmie nella popolazione generale sia compresa tra l’1,5% e il 5%, con la fibrillazione atriale come forma più comune.[7] Poiché le aritmie possono produrre sintomi oppure rimanere asintomatiche e possono essere parossistiche, risulta difficile stimarne la reale prevalenza. La presenza complessiva di aritmia è associata a una maggiore morbilità e mortalità.[3]
Modelli sperimentali per valutare l'elettrofisiologia delle cellule cardiache e le variazioni nella dipendenza da tempo e voltaggio, così come l'andamento temporale delle correnti ioniche che sottendono il potenziale d'azione, sono disponibili sin da quando furono inizialmente descritti dal professor Noble nel 1962.[8]
Eziologia
Riepilogo
Prospettiva
La maggior parte delle aritmie cardiache si verifica a seguito di una malattia strutturale del miocardio, ma può anche manifestarsi in risposta a vari fattori di rischio genetici e ambientali, nonché a una regolazione epigenetica alterata.[9]
Sono state individuate numerose mutazioni nei canali ionici che configurano il potenziale d’azione cardiaco. Altre mutazioni sono note per risiedere in geni che codificano proteine con funzioni biologiche diverse, come l’architettura del citoscheletro, la gestione del calcio, il trasporto del sodio e la segnalazione delle citochine.[10][11][12] Difetti in numerose proteine del citoscheletro (desmina, lamina, titina, filamina, ecc.) compromettono significativamente l’integrità strutturale e la meccanotrasduzione nei cardiomiociti.[13]
Analogamente, mutazioni nei geni che regolano l’omeostasi del calcio (fosfolambano, SERCA2, recettore della rianodina, ecc.) possono potenzialmente provocare aritmogenesi. Le analisi di associazione su scala genomica sono particolarmente utili e hanno rivelato un gran numero di varianti genetiche di rischio, per lo più localizzate in regioni intergeniche/introniche, associate alla fibrillazione atriale.[14]
Numerosi microRNA svolgono un ruolo fondamentale nella regolazione di componenti chiave (rimodellamento elettrico e strutturale) della conduzione elettrica. L’alterazione di uno qualsiasi di questi componenti può portare allo sviluppo di fibrillazione atriale.[15] Anche gli RNA non codificanti potrebbero essere coinvolti nella modulazione della fibrosi, della funzione dei canali ionici o del metabolismo energetico.[16][17][18]
Alcuni dati suggeriscono che le deacetilasi istoniche, associate al silenziamento genico, potrebbero influenzare la regolazione post-trascrizionale di specifiche proteine, cioè quelle cito-scheletriche o coinvolte nella conduzione, nei cardiomiociti, contribuendo così allo sviluppo della fibrillazione atriale.[19][20][21]
Remove ads
Patogenesi
Riepilogo
Prospettiva
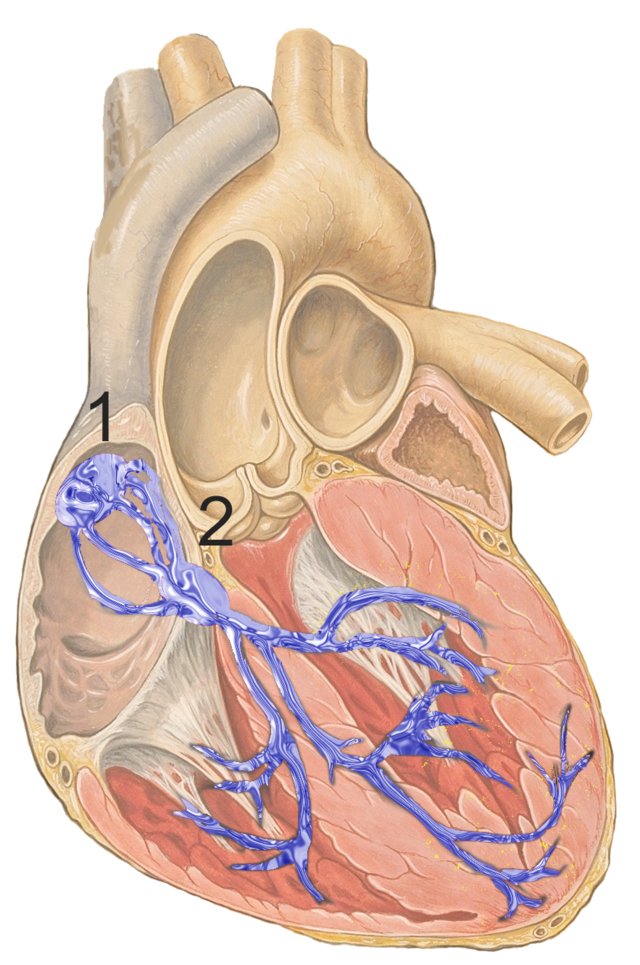
Il ritmo cardiaco è considerato regolare quando la distanza fra i battiti consecutivi non supera i 160 msec. Ci si riferisce ad una frequenza normale, nell'adulto a riposo, con una variazione dai 60 ai 100 battiti/min. Si parla di una conduzione normale quando all'ECG l'onda P è <120 msec, l'intervallo PR non supera i 200 msec e il complesso QRS è di durata <100 msec.[22]
Esistono tre cause comuni delle aritmie cardiache:[23]
- automaticità, alterazioni del meccanismo cellulare di scambio ionico, che si manifesta come potenziale d'azione;
- reentry o rientro, se si verifica un’ostruzione o tessuto cicatriziale post-infarto, l’impulso può circolare attorno all’ostruzione, creando un circuito di rientro;
- triggered o innescata, raramente farmaci o condizioni patologiche possono alterare i potenziali d’azione delle cellule, innescando l’inizio anomalo di impulsi elettrici;
Spesso, le aritmie cardiache pronunciate sono causate da una malattia, come ad esempio:[24]
- cardiopatia coronarica (CHD)
- infarto del miocardio;
- miocardite: può insorgere dopo la diffusione di un'infezione;
- malattie delle valvole cardiache o del muscolo cardiaco;
- malattie dei canali ionici del cuore;
- difetti cardiaci congeniti;
- ipertensione arteriosa.
Il rischio di aritmie acquisite comuni aumenta notevolmente in presenza di una cardiopatia strutturale causata da infarto miocardico, a causa della formazione di cicatrici fibrotiche, o da disfunzione del ventricolo sinistro.[25] I polimorfismi genetici influenzano la struttura o l'eccitabilità del substrato miocardico, aumentando la vulnerabilità o il rischio di aritmie nei pazienti.
Analogamente, i polimorfismi genetici degli enzimi coinvolti nel metabolismo dei farmaci danno origine a sottogruppi distinti all'interno della popolazione, che influenzano specifiche reazioni di biotrasformazione dei farmaci. L'alterazione delle proprietà cellulari ed elettrofisiologiche (attività indotta, automaticità atipica, rientro) all'interno del miocardio aumenta notevolmente il potenziale di insorgenza di aritmie cardiache.[25]
Nell'insufficienza cardiaca, il rimodellamento elettrico aumenta la suscettibilità sia alle aritmie atriali che a quelle ventricolari.[26][27] Contribuisce all’alterazione della durata del potenziale d’azione, alla sindrome del QT lungo, alla torsione di punta, al blocco atrioventricolare e ad altre anomalie della ripolarizzazione che possono influenzare ulteriormente l’instabilità miocardica.[28]
Una molteplicità di fattori, tra cui l'accorciamento del potenziale d'azione, l'induzione di correnti depolarizzanti in entrata e la compromissione della conduzione intracellulare, contribuisce alla genesi delle aritmie dopo un'ischemia cardiaca acuta.[29] Il contributo dell’infiammazione come causa delle aritmie cardiache è ampiamente trascurato, tuttavia, il suo ruolo nello sviluppo della fibrillazione atriale è sempre più evidente, come dimostrato dall’aumento acuto osservato delle proteine infiammatorie nei pazienti.[30][31][32]
Altre condizioni che inizialmente sembrano non avere nulla a che fare con il cuore, ma che possono influenzarlo sono:[24]
- anemia
- ipertiroidismo e ipotiroidismo
- malattie polmonari (es. BPCO o asma)
- carenza di ossigeno nei tessuti
- disturbi dell'equilibrio elettrolitico (es. acidosi metabolica)[33][34]
- disordini metabolici
- disregolazioni del sistema nervoso autonomo
Lo stile di vita può influenzare il ritmo cardiaco, ad esempio consumare troppo caffè o alcol, o essere costantemente sottoposti a stress può portare allo sviluppo di aritmie cardiache.[24] L’accumulo di lipidi nel miocardio compromette generalmente il metabolismo degli acidi grassi e l’infiammazione, aumentando la vulnerabilità ad aritmie persistenti o addirittura fatali.[35][36][37]
Alcuni farmaci e le droghe possono causare aritmie cardiache come effetto collaterale.[24] L'elettrofisiologia cardiaca e l'aritmogenesi sono significativamente influenzate dalla disfunzione del sistema nervoso autonomo a causa della marcata diversità dei fattori scatenanti autonomici.[38][39] L'aumento della stimolazione simpatica compromette gli effetti dannosi dell'ischemia e delle alterazioni del ritmo sottostanti.[40]
Complicazioni
Le aritmie cardiache e l'insufficienza cardiaca sono solitamente interconnesse e si influenzano reciprocamente.[41] Le complicazioni delle aritmie non trattate possono includere insufficienza cardiaca, ictus e arresto cardiaco improvviso.[42]
Remove ads
Clinica
Riepilogo
Prospettiva
Segni e sintomi
I segni tipici dell'aritmia sono:[24]
- cardiopalmo
- battito cardiaco irregolare, spesso percepito come sussulto al cuore
- vertigini
- sensazione di svenimento
I sintomi della brachicardia sono: diminuzione della performance, debolezza, vertigini, collasso circolatorio e arresto circolatorio. I sintomi della della tachicardia invece sono simili a quelli della brachicardia a cui si aggiunge la perdita di conoscenza e in alcuni casi nervosismo.[24] I meccanismi molecolari delle aritmie cardiache e dell'insufficienza cardiaca sono ancora poco chiari, e nuovi difetti e percorsi molecolari devono ancora essere identificati per lo screening, la diagnosi molecolare, lo sviluppo di bersagli farmacologici e la medicina personalizzata.[41]

Esami di laboratorio e strumentali
Nei pazienti con sospetta aritmia, l’elettrocardiogramma (ECG) rappresenta il primo passo diagnostico e solitamente consente di formulare la diagnosi. Tuttavia, in alcuni casi, il paziente può soffrire di aritmie parossistiche pertanto si possono utilizzare le seguenti modalità per la diagnosi, in base alla frequenza dei sintomi che il paziente presenta secondariamente alla sospetta aritmia:[3][43]
- monitoraggio ambulatoriale dell'ECG per pazienti con sintomi frequenti
- registratore di eventi attivato dal paziente, non adatto a pazienti con sincope
- registratore di eventi a ciclo (loop recorder) che registra fino a 2 minuti prima dell'attivazione, adatto a pazienti con sincope
- registratore a ciclo impiantabile per pazienti con sintomi meno frequenti
- alternanza dell'onda T, un metodo diagnostico non invasivo in grado di evidenziare il rischio aritmico cioè di valutare se l'aritmia di tipo ventricolare è maligna o no[44]
Remove ads
Trattamento
Riepilogo
Prospettiva
Il trattamento di prima linea contro le aritmie cardiache viene effettuato principalmente mediante farmaci antiaritmici. Tuttavia, le evidenze sull'efficacia complessiva della farmacoterapia sono incomplete. Questo ha stimolato lo sviluppo di interventi come pacemaker elettronici impiantabili, defibrillatori e ablazione transcatetere.[25]

Trattamento chirurgico
La stimolazione elettrica per modulare l’attività meccanica del cuore) è stata introdotta clinicamente negli anni ’30.[25] I dispositivi elettronici pacemaker (unipolari, bipolari), che emettono un impulso elettrico sufficiente a depolarizzare il miocardio (soglia di stimolazione), rappresentano una terapia standard per i sintomi della bradicardia sintomatica causata da blocco del nodo atrioventricolare o disfunzione del nodo del seno, e per la disfunzione grave del ventricolo sinistro.[45]
Sebbene i defibrillatori cardioverter siano efficaci nell'interrompere le aritmie, non sono in grado di prevenirne l'insorgenza.[46] Il trattamento combinato con farmacoterapia, in aggiunta a un defibrillatore cardioverter impiantabile per la gestione delle aritmie nei pazienti, si è recentemente dimostrato utile per ridurre la soglia di defibrillazione richiesta per la cardioversione.[47]
L'ablazione transcatetere della fibrillazione atriale è una modalità terapeutica ampiamente utilizzata nei pazienti sintomatici con fibrillazione atriale incontrollabile o persistente, refrattaria o intollerante ai farmaci antiaritmici.[25]
Trattamento farmacologico
Il sistema di classificazione di Vaughan Williams è ampiamente utilizzato per classificare la moltitudine di farmaci antiaritmici ed è basato sul coinvolgimento dei canali ionici e sugli effetti sul potenziale d’azione, sulla funzione del nodo del seno e sulla conduzione atrioventricolare.[48][49][50]
I farmaci di classe I hanno una vasta gamma di effetti che mirano al blocco dei canali del sodio. Questi farmaci bloccano la corrente di sodio in entrata, influenzando così la depolarizzazione e la conduzione cardiaca, insieme al prolungamento della ripolarizzazione tramite il blocco dei canali del potassio a rettificazione ritardata. Influenzano anche la durata del potenziale d’azione e del periodo refrattario efficace, incidendo quindi sull’automaticità.[51]
I farmaci di classe II (betabloccanti) agiscono attenuando l’attività simpatica, con conseguente riduzione della velocità della depolarizzazione iniziale del potenziale d’azione, il che mitiga l’automaticità e la velocità di conduzione.[51][52]
I farmaci di classe III (bloccanti dei canali del potassio) agiscono principalmente bloccando il canale del potassio a rettificazione ritardata, prolungando così la ripolarizzazione.[53][54]
I farmaci di classe IV (bloccanti dei canali del calcio) agiscono principalmente a livello del nodo atrioventricolare bloccando le correnti lente in entrata di calcio; ciò comporta un prolungamento del periodo refrattario effettivo, con effetti minimi sui cardiomiociti o sul sistema di conduzione His–Purkinje.[55][56]
Attualmente sono allo studio terapie geniche tramite la somministrazione di sequenze di acidi nucleici nelle cellule o nei tessuti bersaglio per la manipolazione delle correnti ioniche e trattamenti con cellule staminali.[57][58]
Remove ads
Note
Bibliografia
Voci correlate
Altri progetti
Collegamenti esterni
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads

