Timeline
Chat
Prospettiva
Nitrosoderivati
Da Wikipedia, l'enciclopedia libera
Remove ads
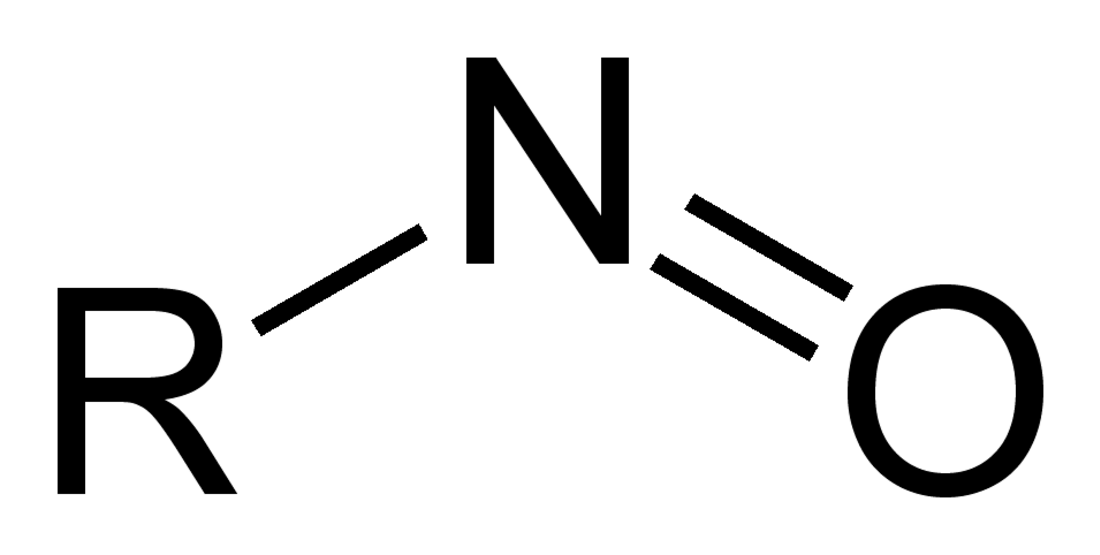
I nitrosoderivati, o nitrosocomposti sono una categoria di composti organici contenenti uno o più gruppi funzionali "−N=O" detti "nitroso" legati ad una parte organica. I nitrosoderivati possono essere suddivisi in base alle proprietà e al tipo di atomo del sostituente a cui è legato il gruppo funzionale: si possono citare i nitrosoalcani (R−N=O), i nitrosotioli (R−S−N=O), le nitrosammine (RR’N−N=O) e i nitriti alchilici (RO−N=O).

Remove ads
Sintesi
I nitrosocomposti possono essere ottenuti attraverso la riduzione dei nitrocomposti[1] o l'ossidazione delle idrossilammine.[2] Gli orto-nitrosofenoli possono essere prodotti tramite la reazione di Baudisch. Nel riarrangiamento di Fischer–Hepp, si preparano 4-nitrosoaniline aromatiche a partire dalle corrispondenti nitrosamine. Un particolare tipo di alcoli, funzionalizzati con un gruppo nitroso in posizione δ rispetto al gruppo OH, possono essere sintetizzati tramite la reazione di Barton, una reazione fotochimica che comporta la fotolisi di un nitrito alchilico per formare un nitrosoderivato idrossilato.
Remove ads
Proprietà
Riepilogo
Prospettiva
Grazie alla relativa stabilità del radicale libero ·N=O (monossido di azoto), i nitrosoderivati tendono ad avere energie di dissociazione del legame C–N molto basse. Ad esempio, i nitrosoalcani hanno energie di dissociazione dell'ordine di 30–40 kcal/mol, mentre i nitrosoareni variano tra 50–60 kcal/mol. Di conseguenza, i composti sono generalmente sensibili al calore e alla luce. I composti con legami O–NO o N–NO presentano generalmente energie di dissociazione del legame ancora più basse. Per esempio, nella N-nitrosodifenilammina, Ph2N–N=O, l'energia di dissociazione del legame N–N di sole 23 kcal/mol (96 kJ/mol).[3]
I nitrosocomposti agiscono anche come ligandi, formando complessi con metalli di transizione.[4]
Nitrosoalcani
I nitrosoalcani primari e secondari (con il gruppo nitroso legato rispettivamente ad un atomo di carbonio primario e secondario) si isomerizzano a ossime una volta solubilizzati in solventi protici.[5] Alcuni nitrosoalcani terziari si isomerizzano anch'essi a ossime tramite la scissione del legame C-C, specialmente se il legame è povero di elettroni.[6]

Nitrosoareni
I nitrosoareni Ar−N=O sono caratterizzati da un equilibrio monomero-dimero:
2 Ar−N=O ⇄ Ar−(–O)+N=N+(O–)−Ar
I dimeri, ovvero N,N'-diossido azoareni, spesso di colore giallo pallido, sono generalmente favoriti nello stato solido, mentre i monomeri, di colore verde scuro, sono favoriti in soluzione diluita o ad alte temperature. I dimeri presentano isomeria, esistendo nelle forme cis e trans.[8] Nel dimero il legame centrale "doppio" ha in realtà un ordine di legame di circa 1,5.[6] In soluzione i nitrosofenoli e i nitrosonaftoli si isomerizzano reversibilmente in ossime chinoniche, mentre gli eteri nitrosofenolici tendono a dealchilarsi per facilitare l'isomerizzazione. Le nitrosoaniline terziarie invece non subiscono una reazione di dealchilazione come riportato per gli eteri nitrosofenolici.[9]
Remove ads
Reazioni
I nitrosocomposti reagiscono con ammine primarie in ambiente acido per formare nitrosamine.
Esistono molte reazioni che utilizzano i nitrosocomposti come intermedi: la reazione di Barton e la reazione Davis–Beirut, e nella sintesi di indoli, come ad esempio:
- reazione di Baeyer–Emmerling
- reazione di Bartoli.
Nella reazione di Saville, il mercurio viene usato per sostituire un nitrosile da un gruppo tiolico.
I composti C-nitroso vengono utilizzati nella sintesi organica come sintoni in reazioni documentate, come la reazione etero Diels-Alder, la reazione nitroso-ene e la reazione nitroso-aldolica.[10]
Nitrosile in chimica inorganica

I complessi nitrosilici o metallo nitrosili sono composti inorganici in cui il gruppo NO è legato direttamente ad un metallo tramite l'atomo di azoto. Altri composti nitrosilici sono quelli in cui il gruppo NO è legato a un non metallo, come ad esempio nel cloruro di nitrosile (Cl−N=O).
La molecola di monossido di azoto è un radicale libero stabile e come tale ha un elettrone spaiato. La riduzione del monossido di azoto produce l'anione nitrosile, NO−:
NO + e− → NO−
mentre l'ossidazione genera il catione nitrosonio, NO+:
NO → NO+ + e−
Il monossido di azoto può anche fungere da legante formando complessi di nitrosile metallici o semplicemente nitrosili metallici.
Remove ads
Salute umana
Riepilogo
Prospettiva
Una volta raggiunto lo stomaco, i nitrosoderivati a contatto con i succhi gastrici reagiscono formando le corrispondenti nitrosamine, che il metabolismo umano converte in diazocomposti mutageni.
Piccole quantità di nitrocomposti e nitrosoderivati si formano durante i processi di stagionatura delle carni; la loro tossicità contribuisce a preservare la carne dalle infezioni batteriche. Dopo il completamento della stagionatura, la concentrazione di questi composti sembra diminuire nel tempo. La loro presenza nei prodotti finiti è stata strettamente regolamentata a seguito di diversi casi di intossicazione alimentare all'inizio del XX secolo,[11] ma il consumo di grandi quantità di carni lavorate può essere ancora causa di un lieve aumento del rischio di sviluppare tumori dello stomaco e dell'esofago.[12][13][14][15]
Ad esempio, durante gli anni 70, alcuni animali da allevamento norvegesi iniziarono a mostrare livelli elevati di tumore al fegato. Gli animali erano stati alimentati con farina di aringa, a cui era stato aggiunto nitrito di sodio come conservante. Il nitrito di sodio aveva reagito con la dimetilammina presente nel pesce, producendo dimetilnitrosammina, composto che fu la probabile causa dell'aumento delle patologie osservate.[16]
Gli effetti dei composti nitroso variano notevolmente lungo il tratto gastrointestinale e in base alla dieta. I composti nitroso presenti nelle feci non inducono la formazione di nitrosammine, poiché le feci hanno un pH neutro.[17][18] I succhi gastrici, invece, provocano la formazione di nitrosammine, ma il processo può essere inibito quando la concentrazione di ammine è bassa, come ad esempio in una dieta povera di proteine o priva di cibi fermentati. Il processo può essere inibito anche in presenza di un'elevata concentrazione di vitamina C (acido ascorbico), come in una dieta ricca di frutta.[19][20][21] Tuttavia, quando il 10% del pasto è composto da grassi, l'effetto si inverte, e l'acido ascorbico aumenta notevolmente la formazione di nitrosamine.[22][23]
Remove ads
Note
Voci correlate
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads