トップQs
タイムライン
チャット
視点
ヘパラン硫酸
ウィキペディアから
Remove ads
ヘパラン硫酸(ヘパランりゅうさん、英: heparan sulfate、略称: HS)は、全ての動物組織に存在する直線形構造の多糖である[1]。細胞表面近傍で2つから3つのHS鎖が付加されたプロテオグリカン(ヘパラン硫酸プロテオグリカン)として、または細胞外マトリックスタンパク質として存在する[2][3]。HSはこうした形態をとっているときにWntなどのさまざまなタンパク質リガンドを結合し[4][5]、発生過程、血管新生、血液凝固、グランザイムBの剥離活性の無効化[6]、腫瘍の転移など広範囲の生物学的過程を調節する。HSはRSウイルスなどいくつかのウイルスの細胞受容体となることも示されている[7]。SARS-CoV-2の感染時、特にウイルスがACE2に接着する際にHSが関与していることを示唆する研究もある[8]。

プロテオグリカン
細胞膜上の主要なヘパラン硫酸プロテオグリカン(HSPG)は、膜貫通タンパク質シンデカンとGPIアンカータンパク質グリピカンである[9][10]。その他マイナーな膜上HSPGとしては、TGFBR3や[11]、ケラチノサイトと活性化された単球上に存在するCD44のv3アイソフォーム[12]などがある。
細胞外マトリックス、特に基底膜やフラクトンでは、マルチドメインタンパク質パーレカン、アグリン、XVIII型コラーゲンコアタンパク質が主要なHS含有タンパク質である。
構造およびヘパリンとの差異
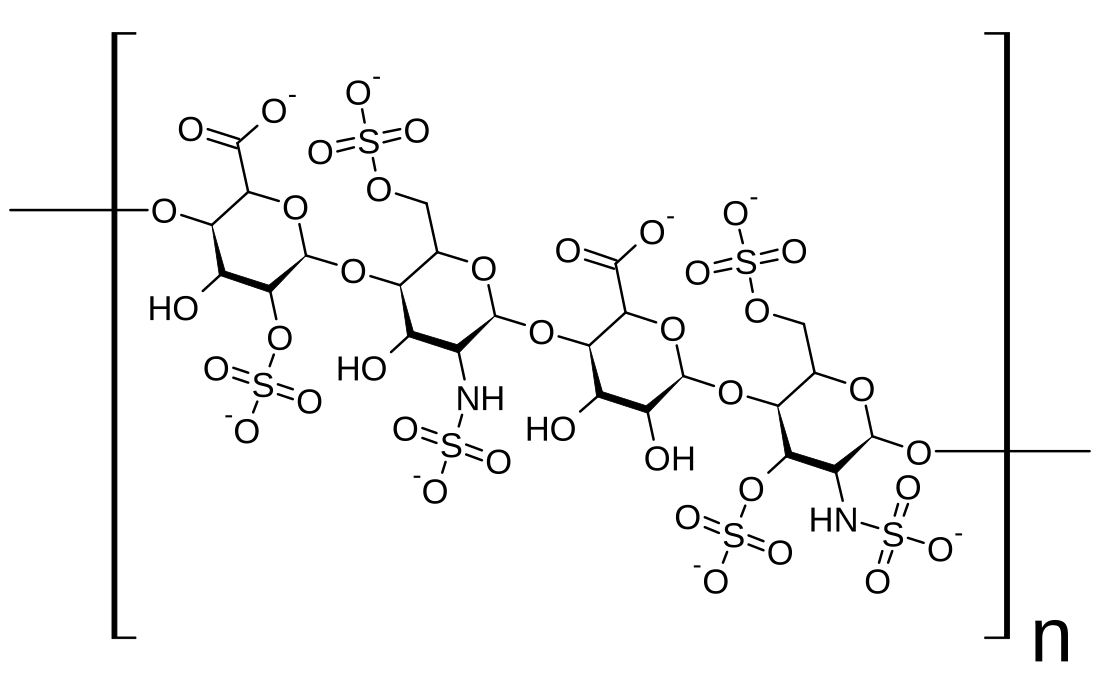
ヘパラン硫酸はグリコサミノグリカン(GAG)ファミリーの炭水化物であり、その構造はヘパリンと密接に関連している。抗凝固薬として広く知られているヘパリンはHSの高度に硫酸化された形態であり、HSとは異なりマスト細胞の分泌顆粒に主に存在する[13]。どちらもさまざまな硫酸化が施された二糖単位の反復構造から構成される。ヘパラン硫酸やヘパリンでみられる主要な二糖単位を下に示す。
ヘパラン硫酸で最も一般的な二糖単位はグルクロン酸(GlcA)とN-アセチルグルコサミン(GlcNAc)が結合したものであり、全二糖単位の約50%を占める。一方ヘパリンでは、IdoA(2S)-GlcNS(6S)がウシ肺由来ヘパリンの86%、ブタ腸管粘膜由来ヘパリンの75%を占める。問題が生じるのは、「ヘパリン様」構造と「HS様」構造の双方を持つハイブリッド型GAGを定義する際である。N-硫酸基の含有量がN-アセチル基の含有量を大きく上回り、O-硫酸基の濃度がN-硫酸基の濃度を上回る場合にのみ、ヘパリンとすることが提案されている[14]。
下に示されていな稀な二糖としては、3-O-硫酸化修飾がなされたグルコサミン(GlcNS(3S,6S))や修飾されていないアミン基を持つグルコサミン(GlcNH3+)を含むものがある。生理的条件下では、エステルやアミドで連結された硫酸基は脱プロトン化しており、正に荷電した対イオンを誘引して塩を形成している。細胞表面では、HSはこうした形態で存在していると考えられている。
- GlcA-GlcNAc
- GlcA-GlcNS
- IdoA-GlcNS
- IdoA(2S)-GlcNS
- IdoA-GlcNS(6S)
- IdoA(2S)-GlcNS(6S)
略号
Remove ads
生合成
要約
視点
多くの細胞種でさまざまな一次構造を持つヘパラン硫酸鎖が産生される。HS鎖の合成にはかなり多様な方法が存在し、「ヘパラノーム」("heparanome")と総称される構造的多様性が生み出される。ヘパラノームは特定の細胞、組織または個体で産生される一次構造の総体である[15]。一次配列に関わらず、HSの形成にはさまざまな生合成酵素が不可欠である。こうした酵素にはグリコシルトランスフェラーゼ、スルホトランスフェラーゼ、エピメラーゼが含まれる。また、同じ酵素がヘパリンの合成にも関わっている。
1980年代にJeffrey Eskoは、ヘパラン硫酸の構築に変化が生じた動物細胞変異体を初めて単離し、特性解析を行った[16]。現在ではヘパラン硫酸合成に関わる酵素は精製や分子クローニングがなされており、発現パターンの研究が行われている。この研究やHS/ヘパリン生合成の初期の基礎的研究はマウス肥満細胞腫無細胞系を用いて行われ、酵素の反応順序や特異性など多くのことが明らかとなった[17]。
糖鎖形成の開始

HSの合成は、キシロシルトランスフェラーゼ(XT)によってキシロース(Xyl)がUDP-キシロースからコアタンパク質内の特定のセリン残基へ転移されることで開始される。ガラクトシルトランスフェラーゼI、II(GalTI、GalTII)によって2つのガラクトース(Gal)、そしてグルクロノシルトランスフェラーゼI(GlcATI)によってグルクロン酸(GlcA)が付加されることで、コアタンパク質のセリン残基にO-結合した四糖プライマー(βGlcA-(1→3)-βGal-(1→3)-βGal-(1→4)-βXyl-O-Ser)が完成する。
コアタンパク質へのキシロースの付加は小胞体で行われ、残りの連結の組み立てはゴルジ体で行われると考えられている。
HS/ヘパリン、コンドロイチン硫酸(CS)、デルマタン硫酸(DS)の生合成経路はこの共通した四糖構造の形成後に分岐する。次に作用する酵素がGlcNAcTIであるかGalNAcTIであるかによって、HS/ヘパリンとCS/DSのどちらが合成されるかが決定される。
糖鎖の伸長
最初のN-アセチルグルコサミン(GlcNAc)残基が付加された後、四糖リンカーの伸長はGlcAとGlcNAcの段階的付加によって継続される。これらの糖はUDP-糖ヌクレオチドから転移される。この反応は外骨腫(EXT)遺伝子ファミリーのメンバーの酵素によって行われる。
EXT1、EXT2、EXT3遺伝子座の変異によって細胞はHSを産生することができなくなり、このことが遺伝性多発性外骨腫(MHE)の発症の原因となる。骨軟骨腫または外骨腫と呼ばれる、軟骨帽に覆われた腫瘍によってMHEは特徴づけられ、こうした腫瘍は幼児期から思春期にかけて主に長骨に発生する[18]。
糖鎖の修飾
HS鎖が重合するにつれて、4種類のスルホトランスフェラーゼと1種類のエピメラーゼによって一連の修飾反応が行われる。スルホトランスフェラーゼの活性には、硫酸基の供与体となる3'-ホスホアデノシン-5'-ホスホ硫酸(PAPS)の存在が重要である[19][20]。
N-脱アセチル化/N-硫酸化
最初に行われるポリマーへの修飾は、GlcNAc残基に対するN-脱アセチル化/N-硫酸化によるGlcNSへの変換である。この修飾はその後の全ての修飾反応の必要条件であり、4つのGlcNAc N-デアセチラーゼ/N-スルホトランスフェラーゼ(NDST)ファミリーのメンバーによって行われる。初期の研究では、修飾酵素は形成中のポリマー内のいかなるN-アセチル化残基に対しても認識し、作用できることが示されている[21]。そのためGlcNAc残基の修飾は鎖中でランダムに生じることが予想されるが、実際にはN-硫酸化残基は主に集まって存在しており、未修飾GlcNAcのN-アセチル化領域によって隔てられて位置している。
NDSTには4種類のアイソフォーム(NDST1–4)が存在する。NDSTの全てのアイソフォームがN-デアセチラーゼ活性とN-スルホトランスフェラーゼ活性の双方を有するが、その酵素活性はそれぞれ大きく異なる[22]。
GlcNH2の生成
N-デアセチラーゼとN-スルホトランスフェラーゼは同じ酵素によって行われるため、通常、N-硫酸化はN-脱アセチル化と密接に共役している。一方で、2つの活性の脱共役によって形成されたと思われるGlcNH2残基もヘパリンや一部のHSに存在している[23]。
エピマー化と2-O-硫酸化
エピマー化はGlcA C5エピメラーゼまたはヘパロサン-N-硫酸-グルクロン酸 5-エピメラーゼ(EC 5.1.3.17)と呼ばれる1つの酵素によって触媒される。この酵素はGlcAをイズロン酸(IdoA)へエピマー化する。基質認識には、標的となるGlcAの非還元末端側に結合したGlcN残基がN-硫酸化されていることが必要である。その結果形成されたIdoA残基はウロノシル-2-O-スルホトランスフェラーゼ(2OST)によって硫酸化される。
6-O-硫酸化
硫酸化または非硫酸化IdoAに隣接したGlcNS(6S)の形成を担うグルコサミニル-6-O-スルホトランスフェラーゼ(6OST)が3種類同定されている。成熟型HS鎖にはGlcNAc(6S)も存在する。
3-O-硫酸化
現在では、哺乳類には7種類(ゼブラフィッシュでは8種類)のグルコサミニル-3-O-スルホトランスフェラーゼ(3OST、HS3ST)が存在することが知られている[24][25]。3OSTは、GlcA-GlcNS(3S±6S)(HS3ST1、HS3ST5による修飾)、IdoA(2S)-GlcNH2(3S±6S)(HS3ST3A1、HS3ST3B1、HS3ST5、HS3ST6)、GlcA/IdoA(2S)-GlcNS(3S)(HS3ST2 、HS3ST4)など、いつくかの3-O-硫酸化二糖を形成する[26][27]。他の全てのヘパラン硫酸スルホトランスフェラーゼと同様、3OSTはPAPSを硫酸基供与体として利用する。3OSTはヘパラン硫酸修飾酵素の中で最大のファミリーを構成しているものの、3OSTによって行われる修飾は最も稀であり、特定のグルコサミン残基のC3-OHが硫酸化される[28]。
3OSTは、アンチトロンビンIII結合部位を形成するもの(HS3ST1、HS3ST5)、そして単純ヘルペスウイルス1型糖タンパク質D(HSV-1 gD)結合部位を形成するもの(HS3ST2、HS3ST3A1、HS3ST3B1、HS3ST4、HS3ST5、HS3ST6)という2つの機能的サブカテゴリに分類される[26][27][29][30][31][32][33][34][35][36][37]。3OSTはHS修飾酵素の中で最大のファミリーであること、そしてこれらの作用が律速段階であり、基質特異性があり、稀な修飾を形成することから、3OSTによって修飾されたHSは生物学的過程において重要な調節機能を果たしていることが予想されている[30][32]。3-O-硫酸化はWntのグリピカンへの結合を強化することが示されており、がんにおけるWntの調節に関与している可能性がある[5][10]。
Remove ads
リガンド結合
ヘパラン硫酸は多数の細胞外タンパク質に結合する。これらは類縁多糖であるヘパリンを用いたアフィニティクロマトグラフィーによって単離されたため、まとめて「ヘパリンインタラクトーム」("heparin interactome")または「ヘパリン結合タンパク質」("heparin-binding proteins")と呼ばれることも多いが、「ヘパラン硫酸インタラクトーム」("heparan sulfate interactome")という語の方がより正確である。ヘパラン硫酸結合タンパク質の機能は、細胞外マトリックスの構成要素、酵素、血液凝固因子、成長因子、サイトカイン、ケモカイン、モルフォゲンなどさまざまである[38]。
ファージディスプレイによって、ヘパラン硫酸に対して高い親和性で結合するHS20ヒトモノクローナル抗体が単離されている[39]。この抗体はヘパラン硫酸に結合するが、コンドロイチン硫酸には結合しない[5]。HS20のヘパラン硫酸への結合には、C2位とC6位の双方の硫酸化が必要である。HS20はWntのヘパラン硫酸への結合を遮断し[5]、また病原性JCポリオーマウイルスの侵入感染も阻害する[40]。
インターフェロンγ
インターフェロンγの細胞表面受容体結合領域は、C末端付近に位置するHS結合領域と重複している。HSの結合は受容体結合部位を遮断し、そのためHSとの複合体は不活性である[41]。
Wnt
グリピカン3(GPC3)はWntとFrizzledの双方と相互作用し、下流のシグナル伝達を開始する複合体を形成する[4][10]。WntはGPC3のIdoA2SとGlcNS6Sを含むヘパラン硫酸モチーフを認識し、GlcNS6S3Sへの3-O-硫酸化は結合を強化することが実験的に示されている[5]。
その他多くのタンパク質のHS結合特性の研究が行われている。
Remove ads
ヘパラン硫酸アナログ
→詳細は「ヘパラン硫酸アナログ」を参照
ヘパラン硫酸アナログは、創傷部位などタンパク質分解環境でも安定であることを除いて、ヘパラン硫酸と同一の性質を示すと考えられている[42][43]。ヘパラン硫酸は慢性創傷部位ではヘパラナーゼによって分解され、こうしたヘパラン硫酸が存在しない部位でヘパラン硫酸アナログは結合する。そして既知のいかなるヘパラナーゼやグリカナーゼによっても分解されない。ヘパラン硫酸アナログの機能はヘパラン硫酸と同じであり、成長因子やサイトカインなどさまざまなタンパク質リガンドを保護する。それらを正しい場所に保持することで、組織はさまざまなタンパク質リガンドを増殖のために利用することができるようになる[44]。
出典
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads