상위 질문
타임라인
채팅
관점
플루오로안티몬산
위키백과, 무료 백과사전
Remove ads
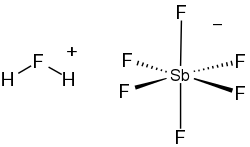
플루오로안티몬산 또는 플루오르안티모닉산은 화학식이 H2FSbF6인 이온화된 액체이다. 수소화 헬륨 이온을 제외한 지구상에서 가장 강력한 초강산으로 알려져있으며, 거의 모든 종류의 유기 화합물과 반응하여 탈수소화 시켜 분해한다.
이 문서의 내용은 출처가 분명하지 않습니다. (2019년 11월) |
Remove ads
화학적 성질
플루오로안티몬산은 거의 모든 종류의 유기화합물을 수소 기체와 탄소 양이온으로 탈 수소화 시켜버릴 만큼 강력하다. 다음 화학식은 플루오로안티몬산의 양성자가 이소뷰테인을 수소 기체와 이소뷰틸 양이온으로, 네오펜테인을 메테인과 이소뷰틸 양이온으로 탈수소화 시켜 분해하는 과정이다.
- (CH3)3CH + H+ → (CH3)3C+ + H2
- (CH3)4C + H+ → (CH3)3C+ + CH4
생성
액체상태의 플루오린화 수소 용액에 오플루오린화 안티모니를 가하여 만든다. 이때, 두 물질의 혼합 비율이 2:1일 때 용액의 산성도가 가장 강하다.
- 2HF + SbF5 → H2F+ + SbF6-
생성물이 안정하지 않아 전체적인 반응이 발열성이다.
오플루오린화 안티모니가 용액 속의 플루오린화 이온(F-)을 전부 흡수하여 결과적으로 플루오로늄(H2F+) 이온의 농도가 증가한다.
산성도
용액에서 SbF5의 비율은 산성도에 영향을 끼치는데, 순수한 HF용액의 Hammet산도함수는 -15정도이지만 SbF5를 몰당 1%(100:1비율)만 첨가해도 -20까지 내려가며, 몰당 농도가 10%(10:1비율)에 도달할 경우에는 -21, 농도가 50%(2:1비율)를 넘을 경우 최대 -23까지 도달할 수 있다고 한다. 이는 순수 황산보다 2*1020배 더 강력한 것이며 위에서 언급한 수소화 헬륨 이온(-63)에 이어 두 번째로 높은 산성도이다.
부산물로 내놓는 SbF6- 음이온은 매우 약한 친핵체이자 SbF5의 짝염기이기도 하다.
용도
- 카베늄 이온을 만들 때 사용된다.
- 제논화 금(IV) 화합물 제조에 사용된다.
안전성
- 용액에 포함된 안티모니는 중금속이며 사람에게 독성이 있다.
- 절대로 수분이 포함된 용매를 사용하여 플루오로안티몬산을 희석시키면 안 된다. 물과 닿으면 매우 강하게 폭발하여 매우 부식성인 플루오린화 수소 기체를 다량 방출시키기 때문에, 이러한 행동을 하는 것은 명백한 자살행위나 다름없다. 반드시 순도100% 액체 플루오린화 수소산만을 희석 용매로 사용해야 한다.
- 보관할 때에는 플루오린계 초강산에도 녹지 않는 테플론 용기 등에 보관한다.
같이 보기
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads