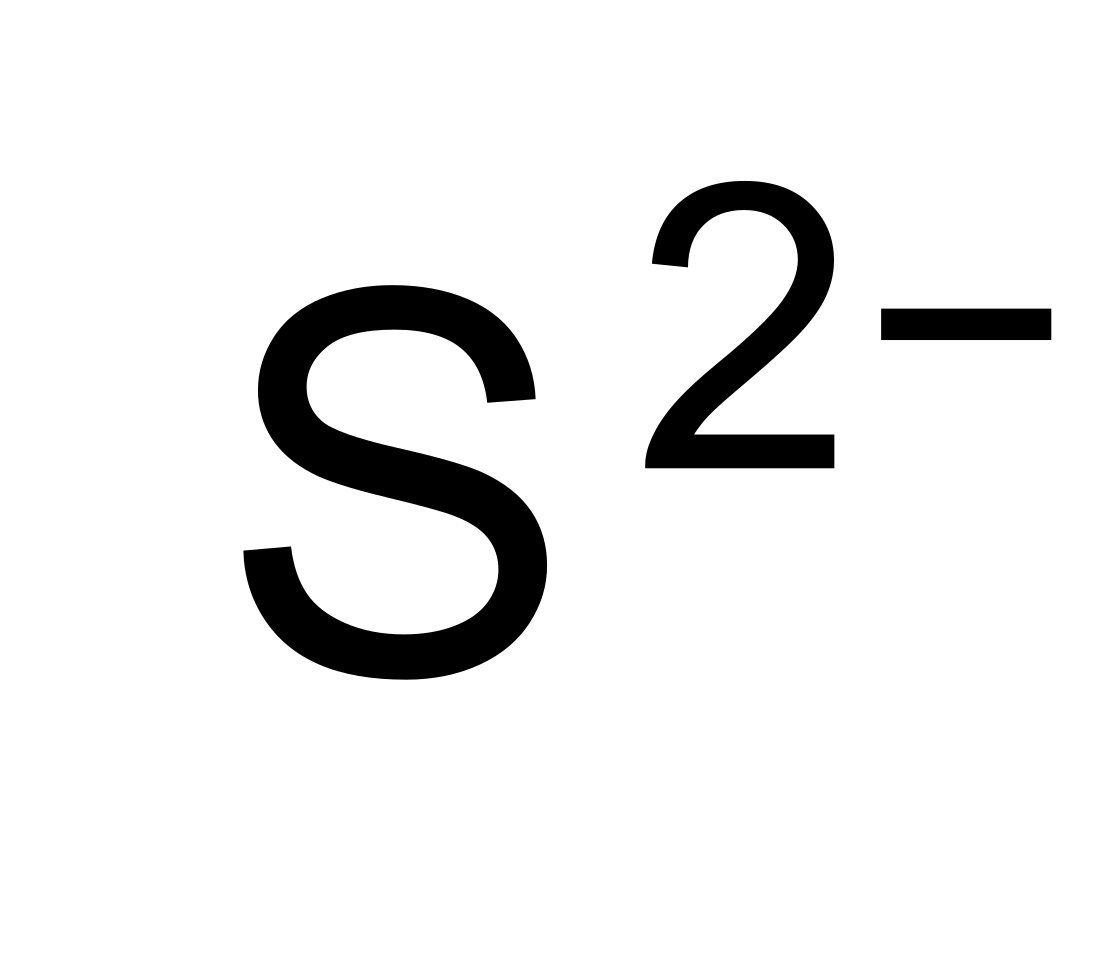Сулфид
From Wikipedia, the free encyclopedia
Remove ads
Сулфид — неоргански анјон на сулфурот со хемиска формула S2− или хемиско соединение кое содржи еден или повеќе јони S2−. Растворите на сулфидните соли се корозивни. Сулфидите се големи семејства на соединенија на неоргански органски соединенија, како на пр. олово сулфидот и диметил сулфидот. Сулфурводородот (H2S) и бисулфидот (SH−) се конјугирани киселини на сулфидот.
Remove ads
Хемиски својства
Сулфидниот јон (S2−) не постои во водни алкални раствори раствори на Na2S,[2][3] туку сулфидот се претвора во хидросулфид:
- S2− + H2O → SH− + OH−
При обработка со киселина, сулфидните соли се претвораат во сулфурводород:
- S2− + H+ → SH−
- SH− + H+ → H2S
Оксидацијата на сулфидот е сложен процес. Зависно од условитетаа може да даде елементен сулфур, полисулфиди, политионати, сулфит или сулфат. Металните сулфиди реагираат со халогени, образувајќи сулфур и метални соли.
- 8 MgS + 8 I2 → S8 + 8 MgI2
Remove ads
Метални деривати
Водените раствори на преоднометални катјони реагираат со сулфидни извори (H2S, NaHS, Na2S), со што се таложат цврсти сулфиди. Ваквите неоргански сулфиди се слабо растворливи во вода, а многу од нив се сродни на минералите со истиот состав. Еден познат пример е силножолтиот вид CdS или „кадмиумско жолто“. Црните дамки што се појавуваат на сребрени предмети се Ag2S. Таквите видови понекогаш се нарекуваат соли. Сврзувањето на преднометални сулфиди е впрочем мошне ковалентно, што доведува до нивните полуспроводнички својства, кое пак е поврзано со заситените бои. Неколку од нив наоѓаат практична примена како пигменти, во сончеви ќелии и како катализатори. Габата црна кропилка (Aspergillus niger) игра улога во растворливоста на тешкометалните сулфиди.[4]
Remove ads
Геологија
- Главната статија за оваа категорија е Сулфидни минерали.
Голем број на важни метални руди се сулфиди.[5] Позначајни примери се: аргентитот (сребро сулфид), цинабаритот (жива сулфид), галенитот (олово сулфид), молибденитот (молибден сулфид), пентландитот (никел сулфид), реалгарот (арсен сулфид), стибнитот (антимон), сфалеритот (цинк сулфид), пиритот (железо дисулфид) и халкопиритот (железо-бакар сулфид).
Корозија предизвикана од сулфиди
Растворените слободни сулфиди (H2S, HS− и S2−) предизвикуваат многу агресивна корозија кај бројни метали како челикот, не’рѓосувачкиот челик и бакарот. Сулфидите присутни во воден раствор се одговорни за напрежното напукнување на челикот, наречено и сулфидно напрежно напукнување. Посебни мерки против корозија се посветуваат во индустриските погони кои обработуваат сулфиди: дробилки на сулфидни руди, длабоки нафтени извори, цевководите за сулфуреста нафта и фабриките на натронска хартија.
Корозијата поттикната од микроби или биогени сулфиди е предизвикана од сулфаторедуцирачки бактерии кои произведуваат сулфид што се испушта во воздухот и потоа оксидира во сулфурна киселина под дејство на сулфурооксидирачките бактерии. Биогената сулфурна киселина реагира со фекалии, ги напукнува канализациските цевки до степен на структурно пропаѓање. Овие оштетувања се голем проблем во јавната канализација низ целиот свет.
Оксидацијата на сулфидот може да создаде тиосулфат (S2O2−
3), кој е преоден вид одговорен за тешки проблеми со дупчеста корозија на челикот и не’рѓосувачкиот челик, а сердината исто така се закиселува со производството на сулфурна киселина кога оксидацијата е понапредната.
Remove ads
Органска хемија
Во органската хемија, поимот „сулфид“ се однесува на спојот C–S–C, иако поимот тиоетер е поеднозначен. На пример, тиоетерот диметил сулфид е CH3–S–CH3. Полифенилен сулфидот (вид. подолу) ја има емпириската формула C6H4S. Понекогаш под сулфиди се подразбираат молекулите кои ја содржат фунционалната група –SH. На пример, метил сулфид може да значи CH3–SH. Претпочитаниот описник за овие соединенија со SH е тиол или меркаптан, т.е. метантиол или метил меркаптан.
Remove ads
Дисулфиди
Поимот „дисулфид“ предизвикуа забуна бидејќи има различни значења. Молибден дисулфидот (MoS2) се состои од раздвоени сулфидни средишта здружен со молибденот во формалната оксидациска состојба +4 (т.е. Mo4+ и два S2−). Од друга страна, железо дисулфидот (пирит, FeS2) се состои од S2−
2, или двоанјонот −S–S− здрижен со двовалентно железо во формалната оксидациска состојба +2 (црно железо: Fe2+). Диметил дисулфидот ја има хемиската врска CH3–S–S–CH3, а пак јаглерод дисулфидот нема врска S–S, туку S=C=S (линеарномолекулен аналог на CO2). Во сулфурната хемија и биохемијата, дисулфид најчесто ѝ се дава на сулфурниот аналог на пероксидната врска –O–O–. Дисулфидната врска (–S–S–) игра важна улога во конформацијата на белковините и во каталитичкото дејство на ензимите.
Remove ads
Примери
Remove ads
Добивање
Сулфидните соединенија можат да се добијат на неколку различни начини:[6]
- Непосредно здружување на елементи:
- Пример: Fe(ц) + S(ц) → FeS(ц)
- Редукција на сулфат:
- Пример: MgSO4(ц) + 4C(ц) → MgS(ц) + 4CO(г)
- Таложење на нерастворлив сулфид:
- Пример: M2+ + H2S(г) → MS(ц) + 2H+(вр)
Remove ads
Безбедност
Многу метални сулфиди се толку нерастворливи во вода што веројатно не се токсични. Некои од нив испуштаат токсичен сулфурводород кога ќе се изложат на силна минерална киселина, вкучувајќи ги желудочните киселини.
Органските сулфиди се многу запаливи. Кога гори, сулфидот го ослободува гасот сулфур диоксид (SO2).
Сулфурводородот, некои од неговите соли и речиси сите органски сулфиди имаат силна скапана миризба; нив ги ослободува биомасата кога гние.
Поврзано
- Органски сулфид (тиоетер)
- Сулфидни минерали
Наводи
Надворешни врски
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads