Сулфурна киселина
хемиско соединение From Wikipedia, the free encyclopedia
Remove ads
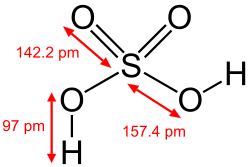
Сулфурна киселина ― високо корозивна силна неорганска киселина со молекулска формула H2SO4. Таа претставува остра-етерична, безбојна до малку жолта вискозна течност која е растворлива во вода во сите концентрации.[4] Понекогаш, тоа е обоена темнокафеава во текот на производството за да се алармираат луѓето на опасност.[5] Историското име на оваа киселина е „масло од камен“,[6] а нејзината густина е околу двапати поголема од онаа на водата. Во молекулата на сулфурната киселина има два водордодни атома што можат да се одделат од неа. При постепеното откинување на овие атоми се образуваат два јона и тогаш сулфурната киселина образува два вида соли: сулфати и хидрогенсулфати. Сулфурната киселина е една од најсилните солни киселини, а концентрираната сулфурна киселина делува дехидратационо, т.е. одзема вода од воздухот, па удри и од супстанциите во кои нема молекули на вода, туку само атоми од водород и кислород (сахароза, целулоза итн.). При разредувањето на сулфурната киселина секогаш треба да се додава сулфурна киселина во вода, а не обратно.[7]
Сулфурната киселина е дипротонска киселина и покажува различни својства во зависност од концентрацијата. Предизвикува корозија на многу материјали, како металите, животинските ткива, дури и на камен. Таа е главно со силно кисела одлика доколку е концентрирана, има дехидратациски и оксидациски својства. Сулфурната киселина со висока концентрација може да предизвика многу тешки оштетувања преку директен допир, и тоа хемиски изгореници преку хидролиза, но исто така и среднотоплински изгореници преку дехидратација.[8][9] Тоа може да води до трајно слепило ако се распрсне кон очите и иреверзибилни оштетувања доколку се проголта.[8] Според тоа, безбедносните мерки на претпазливост треба строго да се почитуваат при работа со неа. Покрај тоа, таа е хигроскопна, лесно впива водена пареа од воздухот.[4]
Remove ads
Добивање и примена
Сулфурот образува два оксида: сулфур диоксид со оксидационен број +4 и сулфур триоксид со оксидационен број +6. Сулфур диоксидот се среќава многу почесто, но за добивањето на сулфурната киселина е поважен сулфур триоксидот кој е анхидрид на сулфурната киселина. Сулфур триоксидот може да се раствора во вода, но побезбедно е ако се раствора во концентрирана сулфурна киселина при што добиениот продукт се вика олеум. Со делумно разредување на олеумот се добива концентрирана сулфурна киселина во која масениот удел на H2SO4 изнесува околу 0,98.[10]
Сулфурната киселина е најважното соединение на сулфурот и еден од најважните прозиводи во хемиската индустрија. Сулфурната киселина наоѓа широка примена во добивањето на другите киселини, во производството на вештачки ѓубрива, како електролит во оловните акумулатори, а се употребува и во лабораториската практика. Основна суровина за добивање на сулфурната киселина е сулфур диоксидот кој се добива со согорување на сулфурот (таму каде што постои амороден сулфур). Ако не постои самороден сулфур, тогаш сулфур диоксидот се добива како спореден производ во производството на бакар, олово и цинк. Сулфур диоксидот се претвора во сулфур триоксид со каталитичка оксидација. Во минатото како катализатор се користел азот диоксид, а целата постапка се одвивала во оловни комори. Денес се користи т.е. контактен процес во кој како катализатор служи диванадиум пентаоксид.[11]
Remove ads
Хемиски својства
Реакции со метали
Дури и разредената сулфурна киселина реагира со многу метали преку една реакција на поместување, како и другите вообичаени киселини, произведувајќи гас водород и сол (метален сулфат). Напаѓа реактивни метали (метали на положби над бакар во низа на реактивност) како што се железо, алуминиум, цинк, манган, магнезиум и никел.
- Fe + H
2SO
4 → H
2 + FeSO
4
Концентрираната сулфурна киселина може да послужи како оксидирачки агенс, ослободувајќи сулфур диоксид:[8]
- Cu + 2 H
2SO
4 → SO
2 + 2 H
2O + SO2−
4 + Cu2+
Оловото и волфрамот, сепак, се отпорни на сулфурна киселина.
Реакции со јаглерод и сулфур
Топла концентрирана сулфурна киселина го оксидира јаглеродот[12] (како битуменски јаглен) и сулфур:
- C + 2 H
2SO
4 → CO
2 + 2 SO
2 + 2 H
2O - S + 2 H
2SO
4 → 3 SO
2 + 2 H
2O
Реакција со натриум хлорид
Таа реагира со натриум хлорид и дава гас хлороводород и натриум бисулфат:
- NaCl + H
2SO
4 → NaHSO
4 + HCl
Електрофилна ароматична замена
Бензенот е подложен на електрофилна ароматична замена со сулфурна киселина за да ги даде соодветните сулфонски киселини:[13]
Remove ads
Галерија
- Дехидратациони својства на концентрирана сулфурна киселина
- Реакција на бакар (II) оксид со сулфурна киселина
- Реакција на литиум со сулфурна киселина
- Реакција на натриум со сулфурна киселина
- Реакција на калиум со сулфурна киселина
- Самозапалива смеса на база на калиум хлорат, шеќер и сулфурна киселина
Поврзано
- Царска вода
- Диетил етер – исто така познато како „слатко масло од витриол“
- Пирански раствор
- Сулфурна оксокиселина
- Труење со сулфурна киселина
Наводи
Надворешни врски
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads