Точка на топење
From Wikipedia, the free encyclopedia
Remove ads
Точка на топење — температурата на која супстанца ја менува состојбата од цврста во течна при атмосферски притисок. При точката на топење цврстата и течната фаза егзистираат во еквилибриум. Точката на топење на супстанците зависи од притисокот кои вообичаено е определен како стандарден. Кога се разгледува температурата на која течноста се менува во цврст облик, таа се нарекува како точка на мрзнење или точка на кристализација. Затоа што некои супстанци имаат способност да бидат суперстудени, точката на мрзнење не се смета како карактеристично својство на супстанцата. Кога „карактеристичната точка на мрзнење“ на супстанцата е определена, всушност актуелната методологија е секогаш „принцип на губење повеќе од замразување“, тоа е точка на топење.[1]

Remove ads
Примери
За најголем број супстанци, точката на топење и точката на мрзнење се приближно еднакви. На пример, точката на топење и точката на мрзење на жива е 234,32 келвини (−38,83 °C).[2] Како и да е,некои супстанци поседуваат различни цврсто-течни транзициони температури. На пример,агарсе топи на 85 °C (185 °F),а се сцврстнува од 31 °C to 40 °C (89.6 °F to 104 °F); оваа зависност е позната како хистереза.
Точката на топење на мраз при притисок од 1 атмосфера е многу блиску [3] to 0 °C (32 °F, 273.15 K);тоа е исто така познато како точка на мраз. Во присуство на јадрени супстанции точката на мрзење на вода е исто како точката на топење,но во отсуство на нуклатори водата може да биде суперстудена до −42 °C (−43.6 °F, 231 K) пред да се замрзне.
Хемискиот елемент со највиска точка на топење е волфрам, на 3687 К(3414 °C, 6177 °F)[4] што го прави одличен за употреба. Често споменуваниот јаглерод не се топи при нормален притисок, но сублимира на околу 4000 K; во течна фаза егзистира само при притисок 10 MPa и 4300–4700 K. Тантал хафниум карбидот (Ta4HfC5) е рефракторометриско соединение со многу висока точка на топење од 4215 K (3942 °C, 7128 °F).[5] На другата страна од скалата, хелиумот не се замрзнува при нормален притисок, дури при температури блиски до апсолутна нула. За негово замрзнување потребен е притисок 20 пати поголем од нормалниот атмосферски притисок.
Remove ads
Мерење на точка на топење
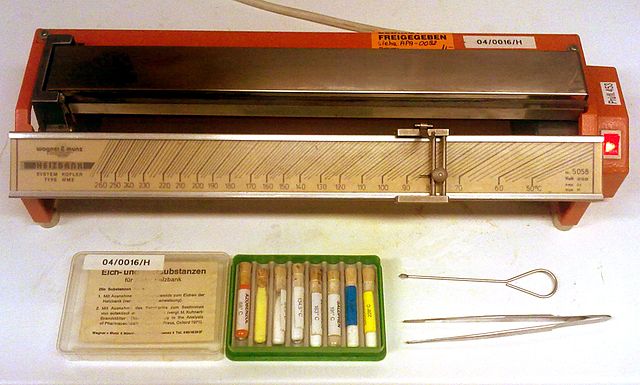
Многу лабораториски техники постојат за одредување за точката на топење. Kofler bench е метална трака со облежани температури (од собна температура до 300 °C). Било која супстанца која ќе се стави на делот од траката се однесува согласно со температурата која што е ставена.Differential scanning calorimetryдава за информација за точка на топење заедно со неговата енталпија на соединување.

Основниот апарат за мерење на точка на топење на кристалните супстанци се состои од маслена бања со транспаренто прозорче (најчест дизајн: Тијаловата туба). Неколку зрнца на цврстата супстанца се става во тенка стаклена туба и делумно се потпува во маслената бања. Маслената бања се загрева со мешање и со помош на додаден извор на светлина и топењето на поединечни кристали може да се приметат при одредена температура. Кај големо/мали дадатоци, пробата може да се смести во блокот за загревање и оптичката детекција е автоматска. Мерењето може исто така да се направи континуиарно со оперативен процес. На пример, рафинериите за масло ја мерат точката на мрзнење на дизелот онлајн,што значи дека пробата се зема од процесот на добивање и се мери автоматски. Ова значи дека за почестите мерења на пробите немора да се земаат рачно и да се собираат за лабораторија.
Remove ads
Термодинамика

Не само загревање е потребно да ја покачи температурата на цврстите супстанци до точката на топење,но топењето само по себе бара топлина која се нарекува топлина на соединување.
Од термодинамична гледна точка, точката на топење во Гипсова слободна енергија (ΔG) на материјалот е нула,но енталпијата (H) и ентрпијата (S) на материјалот е растечка (ΔH, ΔS > 0). Феноменот на топење се случува кога Гипсовата слободна енергија на течноста ќе стане пониска од таа на цврстиот облик на материјалот.При различни притисоци ова се случува на специфични температури.Ова исто така може да биде претставено како:
Каде што T, ΔS и ΔH се соодветни температури на точка на топење, промена на енторпијата при топењето и промена на енталпија при топењето.
Точката на топење е осетлива при екстремно големи промени во притисокот.Ако,во најчест број разгледувани случаи се во цврста состојба отколку во течна, точката на топење ќе се зголемува со зголемувањето на притисокот. Поинаку кажано и со спротивното однесување ќе се забележи соодветно.Забележан е случајот со водата која е графички илустирана на десно,но исто така и Si, Ge, Ga, Bi. При екстемно големи промени во притисокот,се забележуваат и екстремно големи промени и во точката на топење. На пример, точката на топење на силициум при нормален притисок (0.1 MPa)е 1415 °C, но при притисок од 10 GPa таа се намалува на 1000 °C.[8]
Точката на топење најчесто се употребува за каракгеризација на органски и неоргански соединенија и за да одреди нивната чистота. Точката на топење на чистите супстанци е секогаш повисока и има помал ранг од точката на топење на онечистена супстанца.Што е поголемо количеството на други компоненти точката на топење е пониска со поширок ранг на точка на топење.Температурата на која што почнува топењето е позната како "solidus" додека температурата на која што топењето е комплетно се вика "liquidus". Еутектички смеси се специјални типови на микстури коишто се однесуваат како едната фаза.Тие се топат на константна температура и формираат течност на истото соединение.Алтернативно, со ладење на течностите кај еутектичките композиции ќе се сцврснат како униформни дисперзии, малечки мешани кристали од истото соединение.
Наспроти кристалните супстанци,стакленитене поседуваат точка на топење; кога се загреваат тие преидуваат во мека стаклена транзиција и после преминуваат во вискозна течност. Ако продолжи загревањето,тие постапно омекнуваат коишто се одликува со точка на омекнување.
Remove ads
Намалување на точка на мрзнење
Точката на мрзнење на раствор се намалува кога ќе и се додаде друго соединение, што значи дека растворотима пониска точка на мрзнење отколку чистиот растворувач. Овој фонемен се користи во технички апликации за да се избегне смрзнувањето, на пример со додавање на сол или етилен гликол во вода.
Карнеловиот закон
Во органската хемија Карнеловиот закон, потврден во 1882 од Томас Карнели, стои дека високата молекуларна симетрија е поврзана со високата точка на топење.[9] Карнели го базирал неговиот закон на исптувања на 15,000 хемиски супстанци,На пример, за три структурни изомери со молекуларна формула C5H12 точката на топење расте во сериите изопентан −160 °C (113 K) n-пентан −129.8 °C (143 K) and неопентан −16.4 °C (256.8 K).[10] Исто така и кај кслиените и дихлоробензенитеточката на топење расте по редослед метаорто и потоа пара. Пиридинот има помала симетрија од бензените и соодветно пониска точка на топење, но точката на топење повторно се зголемува кај диазините и триазините. Многу циклични соединенија како адамантан и кубан со висока симетрија имаат релативно висока точка на топење.
Високата точка на топење резултира од високата топлина на соединување и ниска ентропија на соединување или комбинација од дветте. Во високо симтеричните молекули кирсталната фаза е густо спакувана со доволен број меѓумолекулски интеркации и висока енталпија која ја менува топењето
Remove ads
Предвидување на точка на топење на супстанци
Како додадок на предвидувањето на точката на топење на кристалните материјали првпат е поставено во 1910 од Frederick Lindemann[11] Идејата позади теоријата беше да се набљудуваат средните амплитуди од термалните вибрации коишто се зголемуваат со зголемувањето на температурата. Топењето почнува кога амплитудата на вибарацијата станува доволно голема да ги одвои атомите во истиот простор. Во Лидеманиовиот критериум стои дека топењето е очекувано кога коренот на амплитудата на вибарцијата ја надмниува долната граница.
Предпоставувајќи дека сите атоми во кристалот вибрираат со иста фрекфренција ν, и средната топлинска енергија може да се предтави со равенкатаequipartition theorem as[12]
m - атомска маса, ν - фрекфренција, u средна вибрациона амплитуда, kB - Boltzmann constant, и T - апсолутна температура. Кога граничната вредност u2 е c2a2 каде c е Линдеманова константа иa е атомски пристор, тогаш точката на топење може да се претстави како
Други често употребувани равенки од Линдеманиовиот кретериум се is[13]
Од равенксата за Debye фрекфренција заν, ние имаме
каде θD еDebye температура и h е Планкова константа. Вредноста c се движи во ранг од 0.15-0.3 за најголем број на материјали[14]
Remove ads
Отворени подадоци за точка на топење
Во фебрурари 2011[15] Alfa Aesar ослободи над 10,000 точки на топење на соединенија од нивнот каталог како отворени податоци. Овие податоци се лесно достапни и можат да се симнат од интернет[16] Овие податоци може да се употребат за да се создаде рандом форест модел за предвидување на точка на топење[17] познати како слободни за употреба.[18] Отоврени податоци за точка на топење се исто така достапни и од Nature Precedings .[19]
Remove ads
Поврзано
- Список на елементите според точката на топење
- Точки на топење на елементите (податоци)
- Фази на материјата
- Тројна точка
- Топење
- Топлина
- Притисок
- Фазен дијаграм
Наводи
Bibliography
Надворешни врски
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads





