Формалдехид
хемиско соединение From Wikipedia, the free encyclopedia
Remove ads
Формалдехид познат и под името метанал — природно органско соединение со хемиска формула CH
2O и структурна формула H–CHO. Чистото соединение е лут, безбоен гас кој полимеризира спонтано во параформалдехид, па затоа се складира како воден раствор ( „формалин“), кој исто така се користи за складирање на животински примероци. Т ој е наједноставното соединение од алдехидите (R–CHO). Заедничкото име на оваа супстанца доаѓа од нејзината сличност и поврзаност со мравја киселина.
Формалдехидот е важен прекурсор за многу метријали и хемиски соединенија. Во 1996 година, инсталираниот капацитет за производство на формалдехид бил проценет на 8,7 милиони тони годишно.[8] Главно се користи во производството на индустриски смоли.
Remove ads
Форми
Формалдехидот е покомплициран од многу едноставни јаглеродни соединенија со тоа што прифаќа неколку различни форми. Овие соединенија често може да се користат наизменично и може да се претвораат меѓусебно.
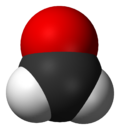
- Молекуларен формалдехид. Безбоен гас со карактеристичен остар, иритирачки мирис. Стабилен е на околу 150 °C, но полимеризира кога се кондензира во течност.
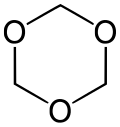
- 1,3,5-триоксан, со формула (CH2O)3, е бела цврста материја која се раствора без разградување во органски растворувачи.
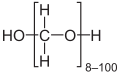
- Параформалдехид, со формула HO(CH2O)nH, е бела цврста материја која е нерастворлива во повеќето растворувачи.
- Метандиол, со формула CH2(OH)2. Ова соединение, исто така, постои во рамнотежа со различни олигомери (кратки полимери), во зависност од концентрацијата и температурата. Заситениот воден раствор, од околу 40 % формалдехид по волумен или 37 % по маса, се нарекува „100 % формалин“.
Мала количина хемиски стабилизатор, како што е метанол, обично се додава за да се потисне оксидација и полимеризација. Типичен формалин од комерцијален степен може да содржи 10-12 % метанол како додаток на различни метални нечистотии.
Формалдехид првпат се користел како трговкса марка во 1893 година по претходното трговско име, „формалин“.[9]
- Главни форми на формалдехидот
- Мономерен формалдехид .
- Триоксан е стабилен цикличен тример на формалдехид.
- Параформалдехид е вообичаена форма на формалдехид за индустриски апликации.
- Метандиол, доминантен вид во разредените водени раствори на формалдехид.
Структура и врски
Молекуларниот формалдехид содржи централен јаглероден атом со двојна врска со атомот на кислород и единечна врска со секој водороден атом. Оваа структура е сумирана со кондензирана формула H2C=O.[10] Молекулата е рамна, во облик на Y и нејзината молекуларна симетрија припаѓа на C2v група на точки.[11] Прецизната молекуларна геометрија на гасовитиот формалдехид е одредена со дифракција на гасни електрони[10][12] и микробранова спектроскопија.[13][14] Должината на врските се 1,21 Å за јаглерод-кислородна врска[10][12][13][14][15] и околу 1,11 Å за јаглерод-водородна врска,[10][12][13][14] додека аголот на H–C–H врска е 117°,[13][14] блиску до аголот од 120° пронајден во идеална тригонална рамна молекула.[10] Некои возбудени електронски состојби на формалдехид се пирамидални наместо рамни како во основната состојба.[15]
Remove ads
Појава
Процесите во горниот дел на атмосфера придонесуваат до 90% од вкупниот формалдехид во животната средина. Формалдехидот е посредник во оксидацијата (или согорувањето) на метан, како и на други јаглеродни соединенија, на пр. во шумски пожари, автомобилски издувни гасови и тутунски чад. Кога се создава во атмосферата со дејство на сончева светлина и кислород на атмосферски метан и други јаглеводороди, тој станува дел од смог. Формалдехид е откриен и во вселената.
Формалдехидот и неговите производи се сеприсутни во живите организми. Се формира во метаболизмот на аминокиселините серин и треонин и се наоѓа во крвотокот на луѓето и другите примати во концентрации од приближно 0,1 милимолар.[16] Експериментите во кои животните биле изложени на атмосфера која содржи изотопски означен формалдехид покажале дека дури и кај намерно изложените животни, поголемиот дел од производите на формалдехид-ДНК кои се наоѓаат во нереспираторните ткива се добиени од ендогено произведен формалдехид.[17]
Формалдехидот не се акумулира во околината, бидејќи се разградува во рок од неколку часа од сончевата светлина или од бактериите присутни во почвата или водата. Луѓето брзо го метаболизираат формалдехидот, претвориќи го во мравја киселина, така што тој не се акумулира во телото.[18] Сепак, тој може да предизвика значителни здравствени проблеми.
Меѓуѕвeзден формалдехид
Формалдехидот бил првата повеќеатомска органска молекула откриена во меѓуѕвездената средина.[19] Од неговото првично откривање во 1969 година, тој е забележан во многу региони на галаксија. Поради широкиот интерес за меѓуѕвездениот формалдехид, тој е опширно проучуван, давајќи нови вонгалактички извори.[20] Предложениот механизам за формирањето е хидрогенирање на CO:[21]
- H + CO → HCO
- HCO + H → CH2O
HCN, HNC, H2CO и прашина се забележани во телото на кометите C/2012 F6 (Lemmon) и C/2012 S1 (ISON) .[22][23]
Remove ads
Синтеза и индустриско производство
Лабораториска синтеза
Формалдехидот првпат бил пријавен во 1859 година од рускиот хемичар Александр Батлеров(1828–86)[24] Во својот труд, Батлеров го нарекол формалдехидот како „диоксиметилен“ (метилен диоксид) [страница 247] бидејќи неговата емпириска формула за него била неточна (C4H4O4). Тоа било дефинитивно идентификувано од Август Вилхелм фон Хофман, кој прв го објавил производството на формалдехид со поминување на пареа на метанол во воздух преку топла платинска жица.[25][26] Со модификации, методот на Хофман останува основата на денешниот индустриски пат.
Добивањето на раствор од формалдехид, исто така, вклучува оксидација на метанол или метил јодид.[27]
Индустрија
Формалдехидот индустриски се произведува со каталитичка оксидација на метанол. Најчести катализатори се сребро метал, железо(III) оксид,[28] железо молибден оксиди [на пр. железо (III) молибдат] со површина збогатена со молибден,[29] или ванадиум оксид. Во најчесто користениот формокс процес, метанолот и кислородот реагираат на околу 250–400 °C во присуство на железен оксид во комбинација со молибден и/или ванадиум за да произведат формалдехид како што е прикажано со хемиската равенка:[8]
- 2 CH3OH + O2 → 2 CH2O + 2 H2O
Катализаторот на база на сребро обично работи на повисока температура, околу 650 °C. Две хемиски реакции, катализирани од ваквиот катализатор, истовремено произведуваат формалдехид: онаа прикажана погоре и реакцијата дехидрогенизација:
- CH3OH → CH2O + H2
Во принцип, формалдехидот може да се генерира со оксидација на метан, но овој пат не е индустриски остварлив бидејќи метанолот полесно се оксидира од метанот.[8]
Во природата
Аминокиселината серин е извор на природен формалдехид според реакцијата подоле, во која како производ се јавува глицинот:
- HOCH2CH(NH2)CO2H → CH2O +H2C(NH2)CO2H
Оваа реакција е катализирана од серин хидроксиметхилтрансферазата, ензим кој содржи пироксидал фосфат.
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads