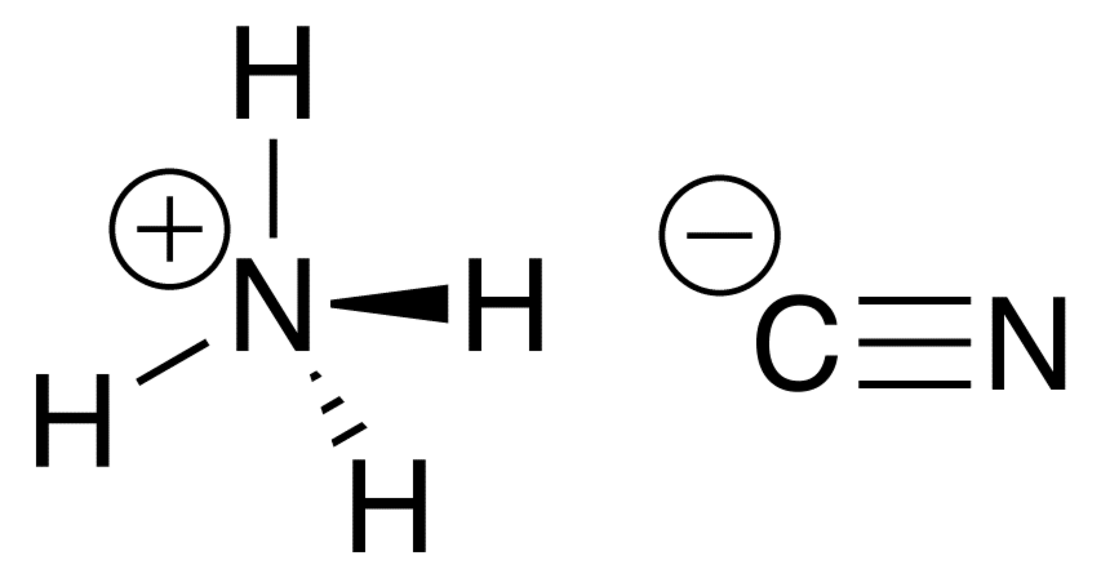അമോണിയം സയനൈഡ്
രാസസംയുക്തം From Wikipedia, the free encyclopedia
Remove ads
സ്ഥിരതയില്ലാത്ത ഒരു അകാർബണിക സയനൈഡ് സംയുക്തമാണ് അമോണിയം സയനൈഡ് (Ammonium cyanide). ഇതിന്റെ തന്മാത്രാ സൂത്രം NH4CN.
Remove ads
ഉപയോഗം
കാർബണിക പദാർത്ഥങ്ങൾ നിർമ്മിക്കാനാണ് അമോണിയം സയനൈഡ് പൊതുവേ ഉപയോഗിക്കുന്നത്. അസ്ഥിര സംയുക്തമായതിനാൽ, വ്യവസായിക ആവശ്യങ്ങൾക്കായി കയറ്റുമതി ചെയ്യാറില്ല.
നിർമ്മാണം
താഴ്ന്ന താപനിലയിൽ, ഹൈഡ്രജൻ സയനൈഡ് ജലീയ അമോണിയയുമായി ബബ്ബ്ളിംഗ് നടത്തി അമോണിയം സയനൈഡ് നിർമ്മിക്കാം
- HCN + NH3(aq) → NH4CN(aq)
കാൽസ്യം സയനൈഡ്, അമോണിയം കാർബണേറ്റ് എന്നിവ തമ്മിൽ പ്രവർത്തിപ്പിച്ചും അമോണിയം സയനൈഡ് നിർമ്മിക്കാം
- Ca(CN)2 + (NH4)2CO3 → 2 NH4CN + CaCO3
പൊട്ടാസ്യം സയനൈഡ് അല്ലെങ്കിൽ പൊട്ടാസ്യം ഫെറോസയനൈഡ് അമോണിയം ക്ലോറൈഡുമായി പ്രവർത്തിപ്പിച്ച് ലഭിക്കുന്ന വാതകം ഖരീഭവിപ്പിച്ച് അമോണിയം സയനൈഡ് ക്രിസ്റ്റൽ തയ്യാറാക്കാം.
- KCN + NH4Cl → NH4CN + KCl
Remove ads
രാസപ്രവർത്തനങ്ങൾ
അമോണിയം സയനൈഡ് വിഘടിച്ച് അമോണിയ, ഹൈഡ്രജൻ സയനൈഡ് എന്നിവയുണ്ടാകുന്നു.
- [1]
- NH4CN → NH3 + HCN
ലോഹിയ ലവണങ്ങളുമായി പ്രവർത്തിക്കുന്നു. ഗ്ലയോക്സാലുമായി പ്രവർത്തിച്ച് ഗ്ലൈസീൻ (aminoacetic acid) ഉണ്ടാകുന്നു.
- NH4CN + (CHO)2 → NH2CH2COOH + HCN
വിഷം
മാരക വിഷമാണ് അമോണിയം സയനൈഡ്. ശരീരത്തിലെത്തിയാൽ മരണം സംഭവിക്കാം. ലവണം വിഘടിച്ച് ഹൈഡ്രജൻ സയനൈഡ് ഉണ്ടാവുന്നതിനാൽ അതും കൈകാര്യം ചെയ്യുന്നത് അപകടമാണ്.
രാസഘടകം
ഘടകങ്ങൾ: H 9.15%, C 27.23%, N 63.55%.
അവലംബം
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads